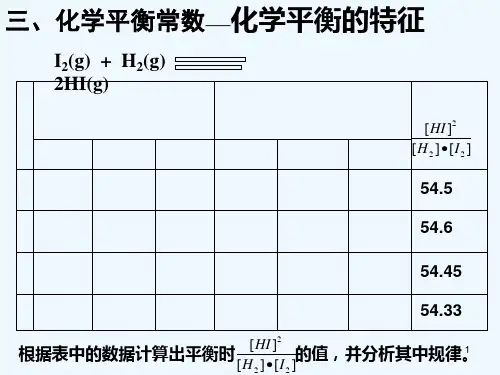
问题2:升高温度,α(H2)如何变化?平衡常数如何变化?
提示:由于ΔH<0,该反应为放热反应,所以升温后,平衡左移,α(H2)降低,K减小。
问题3:上述平衡加压,把容器体积压缩为5 L,计算Q,判断平衡移动方向,此时α(H2)
如何变化?平衡常数如何变化?
提示:容器体积压缩为5 L后,Q=3.125 L2·mol-2<K,平衡右移,α(H2)升高,K不变。
混合加热到一定温度,发生反应 CO(g)+H2O(g)
该反应的平衡常数 K 为 1.0。下列说法正确的是(
A.该反应的平衡常数表达式为 K=
CO2(g)+H2(g),反应达到平衡时,
D )
( )·( )
()
B.反应达到平衡时,c(CO2)+c(H2O)+c(H2)=4.2 mol·L
CH3OH(g)
-1
ΔH1=-90.7 kJ·mol ,将 1 mol CO 和 2 mol H2 混合,测得不同时刻的反应前后压强
关系如下表:
时间(min)
5
10
15
20
25
30
压强比
(p后/p前)
0.98
0.90
0.80
0.70
0.70
0.70
则达到平衡时CO的转化率为
。
后
解析:依据阿伏加德罗定律可知,
用物质的量)。
(2)平衡量=起始量-转化量。
第二行
(3)转化率=
×100%。
第一行
(4)平衡常数根据“第三行”数据(必须为浓度)计算。
(5)第二行数据之比等于化学方程式系数之比。
题组例练
1.(2021·江苏南通月考)某温度下,将含有 H2 和 I2 各 0.10 mol 的气态混合物充入容