(完整版)中学化学中常见的电子式大全(1)
- 格式:doc
- 大小:569.56 KB
- 文档页数:4
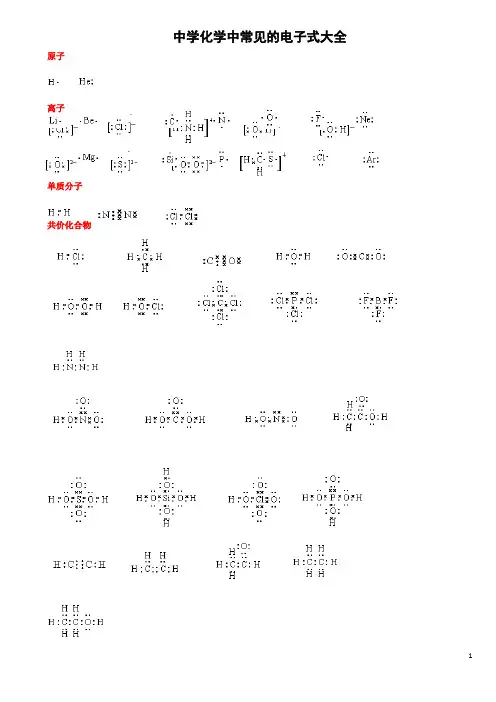
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。


中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N N O 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O HCO 2 O C O HclO H O Cl NH 3H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl Cl NaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -NH 4Cl+ - CaC 2 Ca 2+ 2- ClCl H H N H H Cl C C-CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式 ①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况②例子:HCl 的电子式为;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 +NaCl 的形成过程 + HH C H HO F N H HH H F S2– Cl Na + Na Mg H H O OK + S 2– K + Cl H C O O K 2+ S2– O – H H HH H Na Cl Cl Na +K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
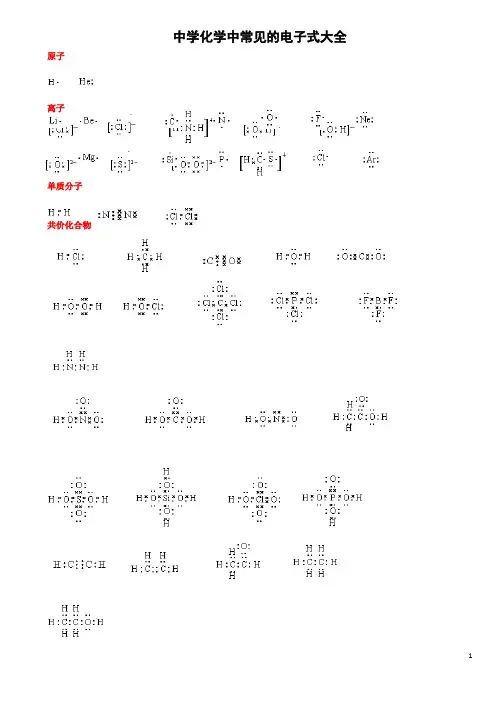
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
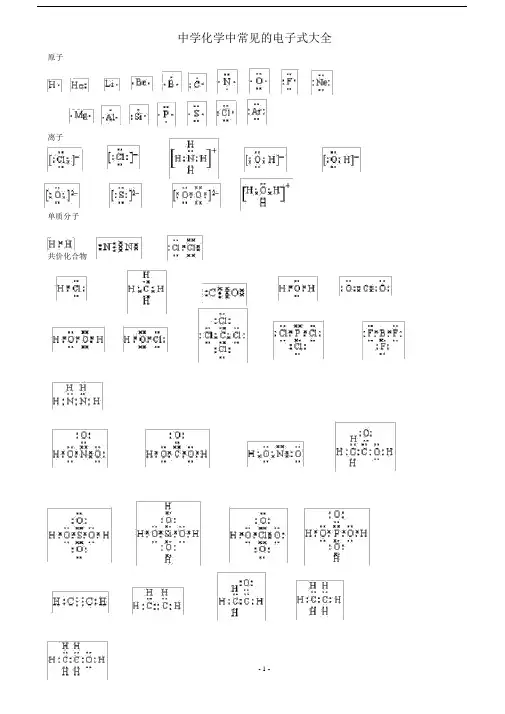
中学化学中常见的电子式大全原子离子单质分子共价化合物- 1 -离子化合物形成过程常见的 20 种电子式N 2N NO 2O OCl ClH O HCl 2H 2OH O O HOC OH O ClH 2O 2 CO 2HclOHClH ClCl C ClH C HH N HCl P ClClCH 4 HNH 3 PCl 3CCl 4+-+O O 2-+〔 O H 〕Na Na- 2+-NaOHNaNa O2 MgCl2 MgCl2HH NHH- 2 -NH 4 Cl+Cl-CaC2Ca2+C C 2-Cl- CH3H CH — OH O HH如何正确书写电子式(李运强湖北省大悟县第一中学高一化学组432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“·”或“×”标出它的最外层电子②例子:钠原子Na ;镁原子Mg;氟原子 F2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子Na+;镁离子 Mg 2+;钡离子 Ba2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子S 2–;氟离子F( 3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷H–②例子:铵根离子H N H;氢氧根离子O H3.单质分子的电子式H①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子H H ;氧气分子O O③技巧:可以根据非金属单质中各原子最外层都要达到8 电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子: NaCl 的电子式为Na+ Cl ;K2S的电子式为2–2+ S 2–+ S + ,(不能写成)K K K(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况- 3 -②例子: HCl 的电子式为H Cl 2的电子式:O C O; CO③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如: H 的形成过程H + H H H2NaCl 的形成过程Na + Cl Na+ ClK S的形成过程 2 K + S + S 2–+K K2注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
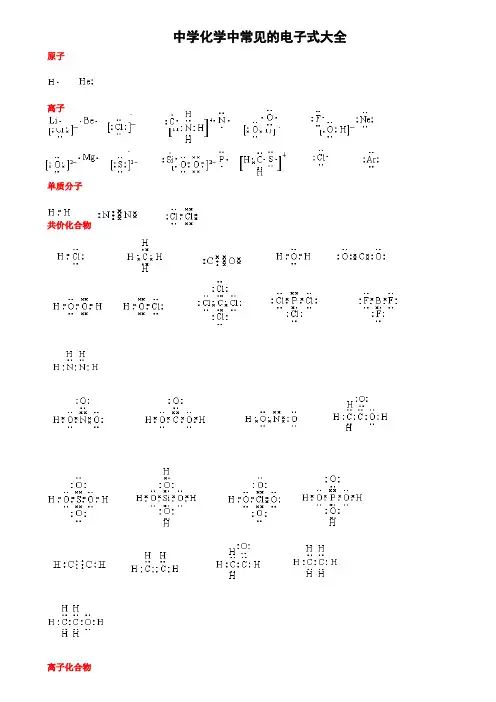


如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式 ①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)复杂的阳离子的电子式 ①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:铵根离子电子式如下图(铵根离子电子式)(3)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子(4)复杂的阴离子的电子式 ①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:过氧根离子和氢氧根离子的电子式分别如下图(过氧根离子电子式)(氢氧根离子电子式)3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数。
4.化合物的电子式(1)离子化合物的电子式FFS 2–Na Mg H H OON H H H H①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为;K 2S的电子式为 ,(不能写成)(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况。

高中化学电子式大全电子式是化学中的一个重要概念,它可以帮助我们更好地理解化学反应和化合物的性质。
在高中化学学习中,电子式的应用非常广泛,因此掌握电子式的相关知识对于学生来说至关重要。
本文将为大家详细介绍高中化学中常见的电子式,希望能够帮助大家更好地理解和掌握这一知识点。
1. 原子的电子式。
原子的电子式是指原子中电子的排布方式。
在化学中,我们通常用电子式来表示原子的电子排布。
原子的电子式由一组数字和字母组成,其中字母代表能级,数字代表在该能级上的电子数。
例如,氢原子的电子式为1s^1,其中1代表能级,s 代表轨道类型,1代表在该能级上的电子数。
2. 分子的电子式。
分子的电子式是指分子中原子之间的化学键和孤对电子的排布方式。
通过分子的电子式,我们可以了解分子的几何构型和化学性质。
例如,氧分子的电子式为O=O,表示氧原子之间的双键。
3. 化合物的电子式。
化合物的电子式是指化合物中各种原子之间的化学键和孤对电子的排布方式。
通过化合物的电子式,我们可以了解化合物的结构和性质。
例如,水的电子式为H-O-H,表示氢原子和氧原子之间的共价键。
4. 化学反应的电子式。
化学反应的电子式是指化学反应中原子之间电子的转移和重新排布方式。
通过化学反应的电子式,我们可以了解反应的机理和平衡状态。
例如,氢气和氧气生成水的电子式为2H_2+O_2→2H_2O,表示氢气和氧气中原子之间的电子转移和重新排布。
5. 电子式的应用。
电子式在化学中有着广泛的应用,它不仅可以帮助我们理解化学现象,还可以指导我们进行化学实验和工程设计。
掌握电子式的相关知识,可以帮助我们更好地理解化学原理,提高化学实验的准确性和效率。
总结。
电子式是化学中的重要概念,它涉及原子、分子、化合物和化学反应等多个方面。
通过学习电子式,我们可以更好地理解化学现象,掌握化学原理,提高化学实验的准确性和效率。
希望本文的介绍能够帮助大家更好地掌握高中化学中的电子式知识,为今后的学习和研究打下坚实的基础。

1~20号元素的电子式
1号元素氢(H)的电子式为1s1,由一个质子(原子核内的正电量)和一个纪录着质子
电量的电子组成,它就像是一个“孤独的旅行者”,只有一个电子组成的氢原子是最轻的原子,也是所有元素的基础。
2号元素氦(He)的电子式为1s2,氦原子由两个质子和两个电子组成,它是稳定的,也
是第二轻的气体,也是太阳核聚变反应的主要原料之一。
3号元素锂(Li)的电子式为1s2 2s1,它由一个质子和2个电子组成,它是活泼的,在
大多数情况下与另一个元素结合,是一种重要的有机物,也是用于制造电池的有效材料。
4号元素硼(Be)的电子式为1s2 2s2,它由两个质子和两个电子组成,它的表现相对比
较稳定,不像其它金属原子一样易于结合,它的表面粗糙,对自然界的环境有重要影响。
5号元素硅(Si)的电子式为1s2 2s2 2p1,其原子内由4个电子和2个电子组成,构成
一个完整的电子壳,在早期被发现它在各种化学反应中具有不同的行为,因此被认为是完
美和最常见的元素之一。
以上只是从氢到硅这六个元素的电子式详细描述,实际上,从1号元素到20号元素,所
有元素的电子式都是由质子和电子组成的,就像一排孩子,每个小孩都在朝着自己的未来
努力不懈。
它们是无数反应的基础,每一个反应都是一个新的故事,比如太阳核聚变反应,太阳系中的所有物质都是经过许多反应的结果。
如果没有电子,这些反应就不能发生,因
此每一个元素的电子式都是令人神往的,它们都像一个棋盘,棋子是放在棋盘上而产生无穷无尽的组合,这也是我们所能研究到的物质世界一切可想象的特性的基础。
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
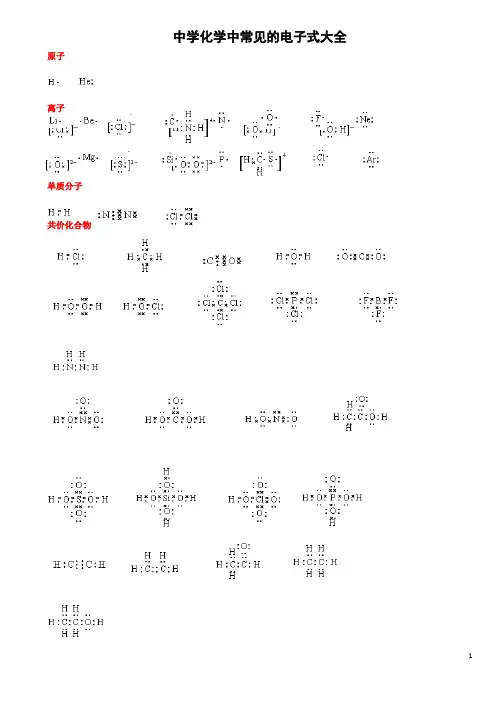
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程1、 原子的电子式:H 、C 、N 、O 、Na 、Mg 、Al 、S 、Cl 。
2、 离子的电子式:O 2-、O -22、S 2-、Cl -、Na +、Mg 2+、Al 3+。
[ ]2-[ ]2-[ ]2-[ ]- Na + Mg 2+ Al 3+4、“根” 的电子式:OH - 、ClO - 、HCOO - 、CH 3COO - 、NH +4。
H H [ ]-[ ]-[ ]-[ ]-[ ]+ H H 5、单质分子的电子式:H 2 、Cl 2 、N 2。
H· ·· ·C· ····N· ·····O·Na· ·Mg· · ·Al· ···· ·S· ·····Cl ∶·· ·· ∶O ∶ ·· ···· ··∶O ∶O ∶ ·· ·· ∶S ∶ ····∶Cl ∶ ···· ∶O ∶H ·· ···· ·· ∶Cl ∶O ∶ ·· ····H∶C ∶O ∶ ·· ∶O ∶ ···· H ∶N ∶HH ∶H ·· ···· ··∶Cl ∶Cl ∶· ·∶N ∶∶N ∶·· ·· ···· ··H ∶C ∶C ∶O ∶·· ∶O ∶6、共价化合物的电子式:(1) 氢化物:HCl 、H 2O 、NH 3。
中学化学中常见的电子式大全【1】原子 离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离OO H Cl OMg 2+ Cl 2(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
中学化学中常见的电子式大全原子
离子
单质分子
共价化合物
离子化合物
形成过程
常见的20种电子式
N 2
N N
O 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2
H O O H CO 2 O C O HclO H O Cl
NH 3 H N H H PCl 3 Cl P Cl Cl CH 4
H H C H H CCl 4 Cl C Cl Cl Cl
NaOH O H 〔 〕-
Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -
Cl H N H
H
NH 4Cl
+ - CaC 2 Ca 2+ 2- -CH 3 —OH
如何正确书写电子式
(李运强 湖北省大悟县第一中学高一化学组 432800)
对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:
1.原子的电子式
①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子
②例子:钠原子 ;镁原子 ;氟原子
2.离子的电子式
(1)简单阳离子的电子式
①书写方法:用该阳离子的离子符号表示
②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+
(2)简单阴离子的电子式
①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式
①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷
②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式
①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但
同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式
表示
②例子:氢气分子 ;氧气分子
③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的
共用电子对数
4.化合物的电子式
(1)离子化合物的电子式
①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并
②例子:NaCl 的电子式为 ;
K 2S 的电子式为 ,(不能写成 )
(2)共价化合物的电子式
①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况
Cl
Cl C C H
H C H H
O F N H H H H F
S 2– Cl Na + Na Mg H H O O
K + S 2– K + K 2+ S 2– O – H
②例子:HCl 的电子式为 ;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数
5.用电子式表示物质的形成过程
如:H 2的形成过程 + NaCl 的形成过程 + K 2S 的形成过程 2 +
注意:①用“ → ”表示形成过程,不用“=”;
②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”
右边是该物质的电子式;
③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失
的关系,也可以不表示。
Cl H C O O
H H H H Na Cl Cl
Na + K S S 2– K
+ K +。