题型复习3流程图题型之1金属资源的回收和利用
- 格式:ppt
- 大小:2.57 MB
- 文档页数:11






一、中考初中化学流程图1.金属材料在我国建设中起着重要的作用。
⑴ 铜可以做导线,主要利用了金属铜的延展性和_______________。
⑵ 回收利用是保护金属资源的一条有效途径。
某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下。
已知: Fe + Fe 2(SO 4) 3 3FeSO 4① 过程Ⅰ中氧化铁发生反应的化学方程式是___________________________。
② 过程Ⅱ、Ⅲ充分反应后,还应有的实验操作是_______。
③ 过程Ⅲ的反应观察到的现象有___________________________________。
④ A~F 中含铁元素的有______________(填序号)。
⑤ 若最后得到铜128克,则原工业废料中含氧化铜的质量是_____________。
【答案】导电 Fe 2O 3 + 3H 2SO 4 = Fe 2(SO 4)3 + 3H 2O 过滤 固体部分减少,有气泡产生,溶液由无色变为浅绿色 BCDF 160g【解析】⑴ 铜可以做导线,主要利用了金属铜的延展性和导电性;(2)①过程Ⅰ发生如下反应:Fe 2O 3 + 3H 2SO 4 = Fe 2(SO 4)3 + 3H 2O ;②铁与硫酸铜反应生成硫酸亚铁和铜;铁与硫酸铁反应生成硫酸亚铁;反应后得到了固体(剩余的铁粉和生成的铜)和液体(硫酸亚铁溶液),过程Ⅱ、Ⅲ充分反应后,还应有的实验操作是过滤;③ 过程Ⅲ中铁和硫酸反应生成硫酸亚铁和氢气,故反应观察到的现象有:固体部分减少,有气泡产生,溶液由无色变为浅绿色;④根据分析推断,A 中含有硫酸,B 中含有硫酸、硫酸铜和硫酸铁,C 是铁,D 中含有铁和铜的混合物,E 是铜,F 中含有硫酸亚铁,故A~F 中含铁元素的有:BCDF ;⑤根据铜的质量全部来自氧化铜,若最后得到铜128克,则原工业废料中含氧化铜的质量是64128100%16080g g ÷⨯=。

流程图题型分析复习(姓名)一、提纯除杂型流程题1、(2017长沙)为了将混有硫酸钾、氯化钙、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钾提纯,并制得纯净的氯化钾溶液,某同学设计的实验流程如下请根据以上流程图中的信息.回答下列问题:(1)步骤①中除去碳酸氢铵的方法是;(2)步骤④中加过量碳酸钾溶液的目的是;(3)此设计方案是否严谨?并说明理由.2、(2016•长沙)海水晒盐工业流程中,得到的粗盐常含有MgCl2、CaCl2等杂质,工业提纯粗盐的流程如图所示:(1)步骤④操作a中需要用到玻璃棒,玻璃棒的作用是;(2)步骤⑥中操作b的名称是:;(3)如果将步骤②和步骤③的顺序颠倒,则所制得的精盐水中还含有.3、化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属.流程如下:(提示:AgNO3+HCl=AgCl↓+HNO3,氯化银为白色沉淀)请回答:(1)四种金属的活动性顺序由强到弱的是;(2)固体丙中一定含有的金属是;(3)写出③中反应的化学方程式;(4)为了检验滤液C 中的溶质成分:向其中加入稀盐酸,有白色沉淀产生,则滤液C 中一定含有的阳离子 .4、某烟气脱硫的工艺不仅能消除2SO ,还能将其转化为石膏(42CaSO 2H O ⋅)等产品,实现“变废为宝”。
主要物质转化关系如下:⑵ 备1中,通过喷淋水脱去烟气中的2SO ,该反应的化学方程式为 。
⑵设备2中,加入3CaCO 的目的是将23H SO 转化为 。
⑶设备3中,反应前后化合价发生改变的元素是 。
二、回收再利用型流程题1、利用废旧电池铜帽(含Cu 、Zn )制取海绵铜(Cu ),并得到硫酸锌溶液,主要流程如下(反应条件已略去):已知:242422Cu 2H SO O 2CuSO 2H O +++△①过程Ⅱ中分离操作的名称是 。
②过程Ⅲ中有气体产生,反应的化学方程式为 。
③A~E 中含铜、锌两种元素的物质有 (填字母序号)。

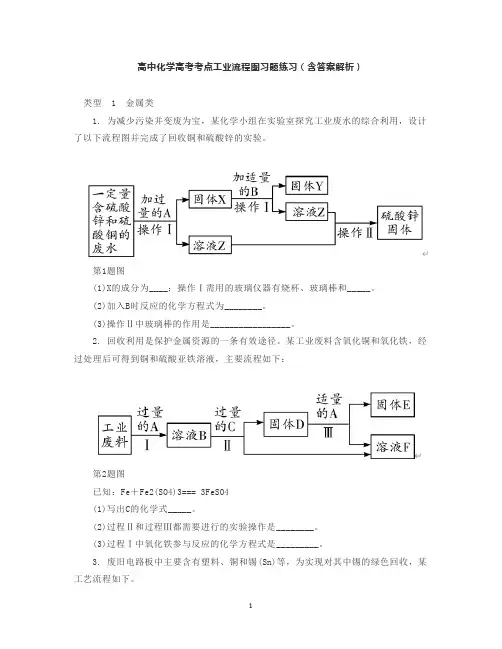
高中化学高考考点工业流程图习题练习(含答案解析)类型 1 金属类1. 为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验。
第1题图(1)X的成分为____;操作Ⅰ需用的玻璃仪器有烧杯、玻璃棒和_____。
(2)加入B时反应的化学方程式为________。
(3)操作Ⅱ中玻璃棒的作用是_________________。
2. 回收利用是保护金属资源的一条有效途径。
某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下:第2题图已知:Fe+Fe2(SO4)3=== 3FeSO4(1)写出C的化学式_____。
(2)过程Ⅱ和过程Ⅲ都需要进行的实验操作是________。
(3)过程Ⅰ中氧化铁参与反应的化学方程式是_________。
3. 废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
第3题图已知:Sn+SnCl4=== 2SnCl2(1)铜的金属活动性比锡的_____(填“强”或“弱”),固体A中一定含有的金属元素是____。
(2)写出步骤②发生反应的化学方程式。
(3)相比于直接焚烧废旧电路板回收金属,该工艺主要优点有哪些?(回答一点即可)。
4. 钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。
下图是利用钼矿石(主要成分为MoS2)制备金属钼的流程图:第4题图请回答下列问题:(1)MoO3中钼元素的化合价为_____。
(2)反应①常将钼矿石粉碎,其目的是什么?(3)操作Ⅰ的名称是_____;常用NaOH溶液吸收反应①的尾气,写出其反应的化学方程式。
5. 2020年奥运会奖牌制作原料来自于电子垃圾中提炼出来的金属。
从废线路板中提炼贵重金属和制备硫酸铜晶体的一种工艺流程如下:第5题图已知:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
(1)操作①的名称是______;(2)提炼出的贵重金属可制作奖牌,其成分是_________;(3)调节pH的主要目的是除去滤液中________(填金属离子符号);(4)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式。
