第4章 气体动力循环
- 格式:ppt
- 大小:3.26 MB
- 文档页数:66

第一章热科学基础1.1工程热力学基础热力学是一门研究能量储存、转换及传递的科学。
能量以内能(与温度有关)、动能(由物体运动引起)、势能(由高度引起)和化学能(与化学组成相关)的形式储存。
不同形式的能量可以相互转化,而且能量在边界上可以以热和功的形式进行传递。
在热力学中,我们将推导有关能量转化和传递与物性参数,如温度、压强及密度等关系间的方程。
因此,在热力学中,物质及其性质变得非常重要。
许多热力学方程都是建立在实验观察的基础之上,而且这些实验观察的结果已被整理成数学表达式或定律的形式。
其中,热力学第一定律和第二定律应用最为广泛。
1.1.1热力系统和控制体热力系统是一包围在某一封闭边界内的具有固定质量的物质。
系统边界通常是比较明显的(如气缸内气体的固定边界)。
然而,系统边界也可以是假想的(如一定质量的流体流经泵时不断变形的边界)。
系统之外的所有物质和空间统称外界或环境。
热力学主要研究系统与外界或系统与系统之间的相互作用。
系统通过在边界上进行能量传递,从而与外界进行相互作用,但在边界上没有质量交换。
当系统与外界间没有能量交换时,这样的系统称为孤立系统。
在许多情况下,当我们只关心空间中有物质流进或流出的某个特定体积时,分析可以得到简化。
这样的特定体积称为控制体。
例如泵、透平、充气或放气的气球都是控制体的例子。
包含控制体的表面称为控制表面。
因此,对于具体的问题,我们必须确定是选取系统作为研究对象有利还是选取控制体作为研究对象有利。
如果边界上有质量交换,则选取控制体有利;反之,则应选取系统作为研究对象。
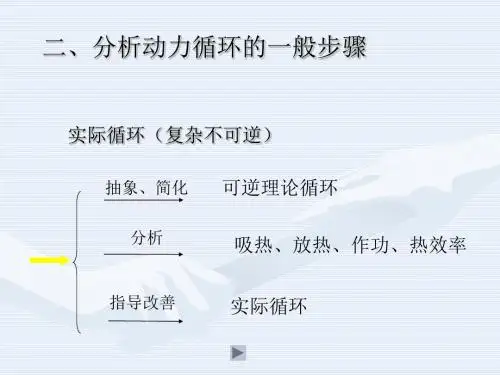
1.1.2平衡、过程和循环对于某一参考系统,假设系统内各点温度完全相同。
当物质内部各点的特性参数均相同且不随时间变化时,则称系统处于热力学平衡状态。
当系统边界某部分的温度突然上升时,则系统内的温度将自发地重新分布,直至处处相同。
当系统从一个平衡状态转变为另一个平衡状态时,系统所经历的一系列由中间状态组成的变化历程称为过程。


14 气体动力循环14.1 燃气轮机装置与定压加热循环燃气轮机装置是以燃气为工质的热动力装置,最简单的燃气轮机装置示意图如图14-1所示,由压气机、燃烧室和燃气轮机三个基本部分组成。
在燃气轮机循环中,空气不断地被压气机吸入,经压缩升压后,送入燃烧室;压缩空气在燃烧室中和供入的燃料在定压下燃烧,形成高温燃气;高温燃气与来自燃烧室夹层通道中的压缩空气混合,使混合气体的温度降到燃气轮机叶片所能承受的温度范围后,进入燃气轮机的喷管;燃气在喷管中膨胀加速,形成高速气流,冲击叶轮对外输出功量;做功后的废气排入环境。
燃气轮机做出的功量除一部分带动压气机外,其余部分(循环净功)对外输出。
显然,上述燃气轮机循环是一个不可逆的开式循环,而且循环中工质的成分、质量都有变化。
为了便于分析,需要把实际循环作理想化的假设: ① 燃烧室中喷入的燃料质量忽略不计;② 忽略阻力的影响,燃烧过程压力变化不大,可以把燃料燃烧的化学过程假定为工质从高温热源吸收热量的定压吸热过程;③ 燃气轮机排出的废气压力和压气机吸入的气体压力都非常接近大气压力,可以把废气的排放假定为 工质向冷源放热后,再返回到压气机的定压放热过程;④ 工质在压气机和燃气轮机中向外散热很少,可以理想化为可逆绝热过程,即定熵过程;⑤ 工质为理想气体,比热容为定值。
通过上述假定,燃气轮机循环就被简化为定量工质完成的可逆的封闭循环。
该循环由定熵压缩过程(1-2)、定压加热过程(2-3)、定熵膨胀过程(3-4)和定压放热过程(4-1)四个可逆过程组成,称为燃气轮机装置的定压加热理想循环,又称布雷顿循环,其p-v 图和T-s 图如图14-2所示。
对组成布雷顿循环的各过程进行能量分析计算,可以得出其热效率如下:吸热量(2-3):()2323T T c h h q p H -=-=放热量(4-1):()1414T T c h h q p L -=-=按照循环热效率的定义,可得:()()23142314111T T T T T T c T T c q q p p HL t ---=---=-=η(14-1)由于1-2以及3-4是定熵过程,并且23p p =,14p p =,可得,κκκκπ111214234312--=⎪⎪⎭⎫ ⎝⎛=--==p p T T T T T T T T把上式代入式(14-1),可得,κπη11-=t (14-2)从这里可以看出,燃气轮机装置的定压加热理想循环的热效率完全取决于参数12p p =π,这一参数定义为循环增压比,并随着π的增大而增大。