血管性缺血再灌注损伤的基础与临床
- 格式:pdf
- 大小:94.59 KB
- 文档页数:4

脑梗死缺血/再灌注损伤机制的研究进展脑梗死是神经系统常见的多发病疾病之一,具有病死率、致残率高的特点,严重威胁患者的生命安全。
目前,脑缺血/再灌注损伤是急性脑梗死发生的主要原因,其机制较为复杂,研究显示主要与自由基过度形成、兴奋性氨基酸毒性作用、细胞内钙超载、炎性反应等多种机制相关。
多种环节互相作用,进一步促进脑缺血/再灌注损伤后神经细胞损伤加重、脑梗死灶的形成。
由此,临床在早期治疗过程中,减轻脑梗死后缺血/再灌注损伤程度,可有效挽救或保护濒死脑组织,提高患者生存质量,改善脑梗死患者临床预后效果。
以下综述脑梗死缺血/再灌注损伤机制的研究进展,为临床治疗脑梗死提供一定的参考依据。
标签:脑梗死;缺血再灌注;损伤机制随着人们生活水平的不断提高,饮食结构、生活习惯发生了巨大变化,脑梗死发病率呈逐年上升趋势[1]。
脑梗死的发生不仅会影响患者的生存治疗,而且会增加家庭的巨大经济负担。
研究显示脑缺血发生后,血液恢复供应,其功能不但不能有效恢复,而且可能出现更严重的脑功能障碍,即所谓的缺血/再灌注损伤[2]。
因此,脑梗死导致的神经功能缺损和死亡机制中,缺血/再灌注损伤机制起着至关重要作用。
因此,临床尽早恢复脑缺血、缺血半暗带区的血供、挽救濒死的脑神经细胞是治疗脑梗死的核心。
为了降低脑梗死缺血/再灌注损伤对神经细胞的损害,有效保护神经细胞,本文作者对脑梗死缺血/再灌注损伤机制研究进展进行综述,为临床的早期治疗奠定基础。
现综述如下:1大脑对缺血缺氧敏感的原因脑组织会消耗全身20%~25%的氧气,是人体所有器官中每一单位重量代谢最高的器官[3]。
但是脑组织内糖和糖原的储备量却很低,因此大脑对血流供应减少极为敏感。
一般在缺血20 min即会发生不可逆性损伤。
与其他的脏器对比,大脑富含多元不饱和脂肪酸,而保护性抗氧剂如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶水平非常低,故对氧化应激损伤也同样敏感。
此外,缺血再灌注后会造成特定递质大量释放,例如谷氨酸盐、多巴胺,从而会导致神经元的钙超载和细胞毒性。

第二十三讲缺血再灌注损伤概论Document number:PBGCG-0857-BTDO-0089-PTT1998第二十三章缺血-再灌注损伤一、基本要求1. 掌握自由基、活性氧、缺血-再灌注损伤、氧反常、钙反常、pH反常、钙超载、无复流现象和呼吸爆发的概念, 重点掌握缺血-再灌注损伤的发生机制。
2. 熟悉缺血-再灌注损伤的原因和条件, 熟悉缺血-再灌注损伤时机体的功能和代谢变化。
3. 了解防治缺血-再灌注损伤的病理生理基础。
二、知识点纲要(一)缺血-再灌注损伤的概念各种原因造成组织血液灌流量减少,可使细胞发生缺血性损伤。
再灌注具有两重性,多数情况使缺血组织和器官的功能结构得以修复,患者病情得到控制。
但是,部分患者或动物缺血后再灌注,不仅没使组织器官功能恢复,反而使缺血所致功能代谢障碍和结构破坏进一步加重,这种现象称为缺血-再灌注损伤。
与之密切相关的概念,还有氧反常、钙反常和pH反常。
缺血-再灌注损伤在不同种属和各种组织器官均可发生,具有普遍性。
( 二 ) 缺血-再灌注损伤的原因和条件再灌注损伤取决于缺血时间、侧支循环、需氧程度以及电解质浓度。
( 三 ) 缺血-再灌注损伤的发生机制1. 自由基的作用(1) 自由基的概念、特性、类型、体内代谢和生物学意义 (熟悉和了解)(2) 缺血-再灌注时氧自由基生成增多的机制 (掌握)1) 黄嘌呤氧化酶形成增多; 2) 中性粒细胞的呼吸爆发;3) 线粒体损伤,氧分子单电子还原增多;4) 儿茶酚胺增加,自氧化增强。
(2) 自由基的损伤作用(掌握)1) 生物膜脂质过氧化增强导致①膜结构破坏──膜的液态性和流动性减弱,通透性增强;②抑制膜蛋白功能──离子泵失灵和细胞内信号传递障碍;③线粒体功能受损──ATP 生成减少。
2) 细胞内Ca2+超载源于自由基引起细胞膜通透性增强,膜上Na+-K+-ATP酶失活和线粒体功能障碍。
3) DNA 断裂和染色体畸变外面无组蛋白保护的线粒体DNA对氧化应激敏感。



再灌注损伤名词解释引言再灌注损伤是指在组织或器官缺血再灌注的过程中,由于缺血引起的损伤加上再灌注时的氧化应激反应导致的细胞和组织受损。
再灌注损伤在多种疾病和医疗操作中都可能发生,如心肌梗死、中风、器官移植等。
本文将对再灌注损伤的定义、发生机制、临床表现以及预防和治疗方法进行详细解释。
定义再灌注损伤是指在缺血再灌注的过程中,由于氧化应激反应引起的细胞和组织受损。
缺血是指某一组织或器官由于血液供应不足而导致缺氧和营养不足,再灌注是指在缺血后重新恢复血液供应。
再灌注损伤通常发生在缺血时间较长后再灌注时,血液和氧气突然重新流入组织或器官,导致细胞内外环境的剧烈变化,从而引发一系列病理生理反应。
发生机制再灌注损伤的发生机制非常复杂,涉及多个细胞和分子水平的相互作用。
以下是再灌注损伤的主要发生机制:1. 氧化应激反应再灌注时,血液和氧气重新进入组织或器官,导致氧化应激反应的增加。
氧化应激是指细胞内外的氧自由基和其他活性氧物质超过细胞抗氧化能力的情况。
氧自由基和活性氧物质可引起脂质过氧化、蛋白质氧化、DNA损伤等,导致细胞和组织的损伤。
2. 炎症反应再灌注损伤时,缺血组织或器官受到损伤后,释放出多种炎症介质,如细胞因子、白细胞黏附分子等。
这些炎症介质可引发炎症反应,进一步加重组织损伤。
3. 钙离子紊乱再灌注时,缺血组织或器官内外的钙离子浓度发生变化。
钙离子是细胞内外信号传导的关键分子,参与多种细胞功能的调节。
再灌注时,钙离子的紊乱可导致细胞内钙超载,进而引发细胞死亡和组织损伤。
4. 缺血再灌注损伤缺血再灌注损伤是再灌注损伤的基础。
缺血导致组织或器官缺氧和营养不足,细胞代谢和功能受到抑制。
再灌注时,血液和氧气重新进入组织或器官,引发一系列病理生理反应,导致细胞和组织的损伤。
临床表现再灌注损伤的临床表现因受损组织或器官的不同而有所差异。
以下是一些常见的再灌注损伤的临床表现:1. 心肌再灌注损伤心肌再灌注损伤是指心肌梗死后再灌注时引起的心肌细胞损伤。


脑缺血再灌注损伤机制与治疗现状近年来,脑缺血再灌注损伤(CIRI)成为神经科学研究领域的热点之一。
在脑缺血的情况下,脑组织会因为血流减少而缺氧,导致神经细胞死亡。
然而,当血流重新恢复时,这种损伤往往会加剧,引发脑水肿、炎症反应和氧化应激等病理变化。
因此,了解脑缺血再灌注损伤的机制和治疗现状对于防治卒中和其他脑血管疾病具有重要意义。
脑缺血再灌注损伤的机制十分复杂,主要包括以下几个方面:氧化应激:当血流重新恢复时,大量氧分子与自由基产生,导致氧化应激反应。
这些自由基可攻击细胞膜和线粒体等细胞结构,引发细胞死亡。
细胞内钙离子超载:在脑缺血期间,细胞内钙离子水平上升。
当血流恢复时,由于钠-钙交换异常,钙离子水平会进一步升高,导致细胞死亡。
炎症反应:脑缺血再灌注后,炎症细胞会被激活,释放炎性因子,引发炎症反应。
这些炎性因子可导致神经细胞死亡和血脑屏障破坏。
凋亡和坏死:脑缺血再灌注后,神经细胞可发生凋亡和坏死。
这些细胞死亡过程可导致神经功能缺损和认知障碍。
目前,针对脑缺血再灌注损伤的治疗主要包括以下几个方面:溶栓治疗:通过使用溶栓药物,如尿激酶、组织型纤溶酶原激活物等,溶解血栓,恢复血流,减轻脑缺血再灌注损伤。
神经保护剂治疗:使用神经保护剂,如钙通道拮抗剂、抗氧化剂、抗炎药物等,保护神经细胞免受氧化应激、炎症反应等的损害。
低温治疗:通过降低体温来减少脑代谢和氧化应激反应,保护神经细胞。
低温治疗已在动物实验中显示出良好的疗效,但其在临床试验中的效果尚不明确。
细胞治疗:利用干细胞、免疫细胞等修复受损的神经细胞,或通过调节免疫反应减轻炎症反应。
细胞治疗为脑缺血再灌注损伤的治疗提供了新的可能性,但尚处于研究阶段。
血管生成治疗:通过促进新血管形成,改善脑组织供血。
血管生成治疗包括血管内皮生长因子(VEGF)和其他促血管生成因子的应用。
这种治疗方法在动物实验中取得了显著成效,但仍需进一步的临床验证。
脑缺血再灌注损伤是卒中和脑血管疾病中一个重要的病理过程,其机制复杂,包括氧化应激、细胞内钙离子超载、炎症反应、凋亡和坏死等多个方面。

血管再灌注实验报告1. 引言血管再灌注(Ischemia-reperfusion, I/R) 是指血液供应阻断后再恢复供应。
血管再灌注实验常被用于研究心脏、肝脏、肾脏等器官缺血再灌注损伤的机制和治疗方法。
本实验旨在通过建立小鼠心肌缺血再灌注模型,观察心肌组织的损伤程度,探讨可能的保护措施。
2. 材料与方法2.1 实验动物雄性C57BL/6小鼠,体重22-26g,年龄8-10周。
2.2 实验组织心脏组织。
2.3 实验设计将实验动物随机分为以下组别:- 对照组(Sham):动物接受手术操作,但没有缺血再灌注处理。
- 缺血再灌注组(I/R):动物在缺血30分钟后再进行1小时的再灌注。
- 预处理组(PreC):在缺血前15分钟,给予预处理药物。
2.4 缺血再灌注模型建立1. 手术动物采用深度麻醉并固定在手术台上。
2. 通过胸骨处切口,暴露心脏。
3. 用缝线将冠状动脉结扎。
4. 结扎30分钟后,解开缝线并进行1小时的再灌注。
5. 收集心肌组织样本。
2.5 组织损伤评价方法1. 心脏组织样本定量化。
2. 彩色素沉淀法(TTC staining) 观察心脏梗死面积。
3. 光镜下观察组织结构。
2.6 统计分析采用统计学软件进行数据的描述性分析,并使用方差分析(ANOVA) 进行组间比较,p < 0.05认为差异有统计学意义。
3. 结果3.1 心脏梗死面积变化通过TTC染色观察心脏梗死面积的变化,在I/R组中心脏梗死面积显著增加(p < 0.05),而在预处理组中心脏梗死面积较小,差异有统计学意义。
3.2 组织结构观察使用光镜观察心肌组织结构变化,发现I/R组心肌细胞出现明显的坏死和水肿,而预处理组心肌细胞结构相对完整,坏死和水肿程度明显减轻。
4. 讨论本实验通过建立小鼠心肌缺血再灌注模型,观察心肌组织的损伤程度。
结果表明,缺血再灌注会导致心肌梗死面积增加和心肌组织结构损伤。
然而,在预处理组中给予药物处理后,心肌梗死面积减小,心肌组织结构保持较好。


第十三章缺血-再灌注损伤(ischemia-reperfusion injury)教学目标1. 掌握自由基、活性氧、缺血-再灌注损伤、氧反常、钙反常、pH反常、钙超载、无复流现象和呼吸爆发的概念2.掌握缺血-再灌注损伤的重要发生机制3. 熟悉缺血-再灌注损伤的原因和条件(影响因素);缺血-再灌注损伤时机体的功能和代谢变化。
4.了解防治缺血-再灌注损伤的病理生理基础。
第一节概述各种原因造成组织血液灌流量减少,可使细胞发生缺血性损伤(ischemia injury),表现为膜电位改变、细胞肿胀、细胞骨架紊乱、ATP减少、细胞酸中毒、离子泵失灵等。
近年来,临床上采用溶栓疗法、导管技术、动脉搭桥术、心肺复苏、心脏外科体外循环、断肢再植和器官移植等方法,使许多组织器官缺血后重新得到血液再灌注,把疾病治疗提高到一个新的水平。
一、概念在缺血的基础上恢复血流后,组织器官的损伤反而加重的现象称为缺血-再灌注损伤。
1.本质:再灌注具有两重性,多数情况使缺血组织和器官的功能结构得以修复,患者病情得到控制。
但是,部分患者或动物缺血后再灌注,不仅没使组织器官功能恢复,反而使缺血所致功能代谢障碍和结构破坏进一步加重。
2.具有器官普遍性。
不同种属(人、兔、大鼠、豚鼠、狗、猪等)和各种组织器官(心、肾、肝、肺、胃肠、脑、肢体和皮肤等)都可发生再灌注损伤1960年,Jennings首先提出此概念,此后出现的氧反常、钙反常和pH反常等概念,与之关系密切。
氧反常( oxygen paradox ) 是指用缺氧溶液灌流组织器官或培养细胞一定时间后,再恢复正常氧供应,组织及细胞的损伤不仅未能恢复,反而更趋严重的现象。
用无钙液灌流后再用含钙液灌流组织器官,可造成细胞和器官的代谢和功能障碍及结构破坏更趋加重,这种现象称为钙反常 ( calcium paradox )。
钙反常首先在心脏灌流时发现,也可见于其他组织器官。
缺血后再灌注时迅速纠正缺血组织的酸中毒,反而会加重缺血损伤的现象,称为pH反常( pH paradox ) ,其机制与H+-Na+交换和Na+-Ca2+交换导致细胞内钙超载有关。
《ANTs和VDAC1蛋白乳酸化修饰参与脑缺血再灌注损伤初探》篇一一、引言脑缺血再灌注损伤是缺血性脑血管病治疗过程中常见的问题,它指的是在恢复血液供应后,由于各种复杂的生物学机制导致神经细胞和组织的进一步损伤。
近年来,研究学者们不断深入探索与这一过程相关的生物标志物及信号通路,以寻求新的治疗策略。
其中,ANTs(线粒体相关膜蛋白)和VDAC1(电压依赖性阴离子通道蛋白1)作为重要的细胞内外调节蛋白,在脑缺血再灌注损伤中的乳酸化修饰及其潜在作用,成为了新的研究热点。
二、ANTs和VDAC1蛋白简介ANTs是线粒体内膜上的一个关键蛋白,它在维持线粒体正常功能方面发挥着重要作用。
而VDAC1则是一种位于线粒体外膜的通道蛋白,它在细胞内外物质交换和信号传递中起到关键作用。
这两者都与细胞能量代谢、凋亡等过程密切相关。
三、乳酸化修饰与脑缺血再灌注损伤乳酸化修饰是一种重要的蛋白质翻译后修饰过程,它涉及到蛋白质的翻译、折叠、转运等多个环节。
在脑缺血再灌注过程中,由于能量代谢的紊乱和氧化应激的增加,许多蛋白质会发生乳酸化修饰,其中ANTs和VDAC1也不例外。
这种修饰可能影响它们的结构和功能,进而影响细胞的能量代谢和凋亡过程。
四、ANTs和VDAC1的乳酸化修饰与脑缺血再灌注损伤的关系研究表明,在脑缺血再灌注过程中,ANTs和VDAC1的乳酸化修饰会显著增加。
这种修饰可能改变它们的亚细胞定位和与其它蛋白的相互作用,从而影响线粒体的功能。
具体来说,ANTs 的乳酸化可能导致其与线粒体呼吸链复合物的解离,降低线粒体的能量产生;而VDAC1的乳酸化则可能影响其作为离子通道的功能,导致细胞内外物质交换的紊乱。
这些变化都可能进一步加剧脑缺血再灌注损伤。
五、未来研究方向未来研究需要进一步明确ANTs和VDAC1乳酸化修饰的机制以及其在脑缺血再灌注损伤中的作用。
通过分子生物学、细胞生物学等手段,可以研究这两者的乳酸化修饰与其它生物标志物及信号通路的关系,探索新的治疗方法。
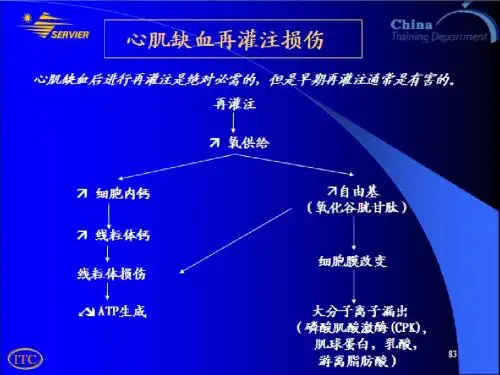
心肌缺血-再灌注-钙超载损伤的基础与临床研究孔令恒;刘哲;张建英;周京军【期刊名称】《中国体外循环杂志》【年(卷),期】2015(13)4【摘要】心肌缺血-再灌注损伤(ischemic-reperfusion in-jury,IRI)是急性心肌梗死溶栓治疗、冠状动脉成形术、心脏停跳手术过程中不可避免的伴随事件,可导致心肌顿抑、心肌梗死、心律失常,甚至因心衰致死。
研究证实,心肌缺血-再灌注过程中存在Ca2+水平的非生理性显著升高,即钙超载,它是造成心肌损伤的重要原因,这为心肌保护提供了思路;同时也指出,阐明钙超载的发生机制和损伤机理是后续工作的重要方向。
【总页数】4页(P253-256)【作者】孔令恒;刘哲;张建英;周京军【作者单位】西安,710032 第四军医大学基础部生理学教研室; 710021 西安医学院基础医学研究所;西安,710032 第四军医大学基础部生理学教研室;西安,710032 第四军医大学基础部生理学教研室;西安,710032 第四军医大学基础部生理学教研室【正文语种】中文【相关文献】1.心肌缺血后再灌注钙超载的机理 [J], 钱培刚;陈竞纬;顾仁樾2.PKC激活对离体心肌缺血再灌注自由基损伤和钙超载的影响 [J], 龚开政;张振刚;李向东;黄轶峰;吕申3.心肌缺血-再灌注中钙超载损伤机制与药物保护作用研究概况 [J], 王天楠;刘义4.钙超载和心肌缺血再灌注损伤情况及其药物治疗缺血再灌注损伤的作用研究 [J], 李会贤;王晓元;赵玉清5.控制性再灌注防治心肌缺血再灌损伤的实验及临床研究 [J], 赵文增;杨栋;徐敬;张明堪;郅兴义;赵松;乔晨晖;胡伟;孙瑞广;胡大平;白秉绪;邱全胜;汤宁因版权原因,仅展示原文概要,查看原文内容请购买。
血管性缺血再灌注损伤的基础与临床胡佳乐(综述),鲁守龙(审校)(解放军第四一一医院普外科,上海 200081) [摘要] 介绍了血管性缺血再灌注损伤的病理生理学基础、全身性炎症反应综合征及多器官功能障碍综合征的关系,并讨论了预防和治疗缺血再灌注损伤的进展。
[关键词] 缺血再灌注损伤;全身性炎症反应综合征;多器官功能障碍综合征[中图分类号] R364.1 [文献标识码] A [文章编号] 1009-0754(2003)03-0276-04 临床和实验研究发现,由于血管原因引起的缺血再灌注损伤(ischaemia reperfusion injury,IRI)能造成远隔器官(re2 mote organ)即非缺血受累区域组织器官功能的损伤。
常见的有:血管创伤或外科手术引起肢体缺血再灌注后致心、肺、血管、肝、肾、肠道、血液系统的功能遭受损伤;腹腔动脉、肠系膜上动脉、肝动脉、门静脉阻断后复流引起的肺、心血管功能损伤。
肺、心血管、肝、胃肠道是常见的受累靶器官,肺水肿、成人呼吸窘迫综合征、肝功损害和酶谱变化、肠屏障功能损害导致的“菌群易位”是IRI后常见的临床表现;心律失常、血压变化,甚至休克、肾衰、免疫功能紊乱、凝血系统障碍也不少见。
这些功能异常相互联动,严重时可发生多器官功能障碍综合征(MODS)。
因此有必要对血管性缺血再灌注损伤的基础与临床进行研究。
1 IRI的病理生理学基础 血流中断后恢复,使该血管供血区域经历缺血和再灌注二次损伤。
缺血再灌注(ischaemia reperfusion,IR)使组织黄嘌呤脱氢酶转化为黄嘌呤氧化酶,后者催化黄嘌呤氧化而产生氧自由基、羟自由基、过氧化氢等。
自由基的细胞毒性通过脂过氧化反应实现,同时能氧化还原型巯基,灭活细胞色素酶,干扰膜转运蛋白,损伤核酸以致出现突变。
IRI可造成细胞内钙浓度上升,激活磷脂酶A2,该酶能消化细胞膜产生花生四烯酸,并刺激生成血小板激活因子(PAF)。
花生四烯酸是血栓素A2(TXA2)和白三烯B4(L TB4)的前体,TXA2和L TB4可激活多型核白细胞(PMN)。
PMN的激活是IRI的重要环节。
PMN也可形成氧自由基,并释放蛋白激酶。
PMN通过化学趋化反应,可聚集、移行至组织间质,使IRI 作用扩展至远隔器官,这主要是通过加强表面粘附分子CD11/CD18和CD44的表达与内皮细胞粘附而实现的。
内皮细胞内钙浓度升高,则胞内微丝微管收缩,细胞间隙加大,有利于PMN移行游出血管。
内皮细胞在自由基和PMN的作用下增强细胞间粘附分子(ICAM)表达,加强与PMN的粘附。
内皮细胞与PMN的互动作用是IRI的一种重要方式[1~3]。
细胞因子是由细胞产生的一系列低分子功能蛋白。
这些蛋白相互作用,相互调节,对内环境所起作用迅速、多能、高效。
主要有肿瘤坏死因子(TNF)、白细胞介素(IL21,IL22,IL26,IL28,IL210)、生长因子如转化生长因子(TGF2B)、干扰素(IFN)等。
TNF由网状内皮系统细胞如单核细胞、肺巨噬细胞、肝枯否细胞(Kupffer)在受包括IR刺激时产生。
TNF 通过结合到不同细胞上的受体而产生广泛的作用。
TNF刺激骨髓释放PMN,加强其CD12、CD18和内皮细胞ICAM表达,使二者易于粘附并产生细胞毒。
TNF可促进内皮合成PAF,使单核细胞和巨噬细胞分化,产生急性反应蛋白。
IL21与TNF的作用有较多重叠,IL26,IL28作用各有其特异性,但在炎症反应中的作用与IL21类似。
IL210是有抗炎作用的细胞因子,它能抑制TNF释放、自由基生成和ICAM的表达。
外周血中单核细胞、白细胞,肺巨噬细胞、肝枯否细胞、内皮细胞在干扰素、TNF、IL21、IL22和脂质多糖(L PS)等作用下可产生一氧化氮(NO)。
NO与自由基作用时产生的过氧化氮是一种氧化能力极强的自由基,但NO在某种浓度下却可中和自由基[4]。
2 IRI引起的器官损伤及功能变化 血管性IRI主要由两种原因引起。
一是动脉阻断后再通,如血管创伤,血管栓塞后的成形手术;二是涉及血管的手术如腹主动脉、肠系膜上动脉、肝脏、胰腺、器官移植等手术。
较常累及的靶器官是肺、肝和消化道。
2.1 肺 肺有丰富的毛细血管网,自由基可使肺血管内皮的A TP水平快速下降,肺巨噬细胞产生TNF和单核细胞化学趋化蛋白(MCP)的mRNA表达加强,内皮固缩,ICAM表达增强,这些反应使肺微循环通透性增加,导致肺动脉压升高和肺间质水肿,临床上出现非心源性肺水肿。
有报道,大血管手术后这种肺水肿的发生率可高达8%~47%。
动物实验中,下肢或肠系膜上动脉的IRI模型也能导致肺水肿,而且IRI的严重程度与肺水肿的程度呈某种相关性[5,6]。
2.2 肝 在肝门阻断和门静脉、肝移植手术中可发生IRI,严重时可并发心、肺功能衰竭。
Kupffer细胞在自由基作用下产生TNF、IL21、IL26、PAF和前列环素。
Kupffer细胞本身也能释放自由基,杀伤肝细胞。
但IL26能抑制TNF,并能促进肝细胞再生。
Kupffer细胞可使IRI作用放大,产生大量的自由基和破坏性细胞因子,经肝静脉入体循环后,又使远·672·海军医学杂志2003年9月第24卷第3期 Journal of Navy Medicine2003Sept.Vol.24,No.3隔器官发生功能损害,较多表现为肺水肿、肺内白细胞聚集和肺动脉高压[7,8]。
2.3 消化道 肠粘膜对缺血敏感,再灌注时损伤更大。
肠粘膜细胞富含黄嘌呤氧化酶,肠IRI 后,可在血浆中测到黄嘌呤氧化酶活性增加,含量升高,因而肠易受IRI ,同时它又是氧自由基的重要来源。
缺血使肠粘膜上皮A TP 耗竭,胞内钙浓度升高,肠道酸化,通透性增加。
再灌注时,自由基可破坏肠上皮细胞内骨架,使之屏障功能受损,并刺激IFN 、IL 24产生。
肠缺血再灌注在临床上十分常见,如肠梗阻、肠系膜上动脉栓塞被纠正后,以及腹主动脉、肠系膜上动脉、胰腺手术后。
肠道是人体最大的免疫器官和最大的内分泌器官,肠腔内有大量的寄生菌群,局部内毒素浓度较高,如果肠上皮屏障受损,通透性增高,内毒素及炎性介质可进入体循环。
因此肠道是MODS 的“发动机”。
但有实验发现,肠道IRI 后,在颈动脉和门静脉血中可测出TNF 、IL 21、IL 26,肠间淋巴结可培养出细菌[9,10],却不能测出内毒素。
3 IRI 与SIRS 、MODS 的关系 IRI 的过程可归纳为缺血导致能量代谢障碍,毒性代谢产物蓄积,再灌注后产生自由基,使局部毒性物质随循环扩展至全身,引起全身性的炎症反应。
当局部的炎症反应不能自限而扩展至全身并产生一系列症状时,临床上称为全身性炎症反应综合征(systemic inflammatory response syndrome ,SIRS )。
SIRS 由创伤、感染或IRI 等应激反应引起,可分为2个阶段:第一阶段表现为损伤局部产生炎性细胞因子,促进损伤修复;第二阶段,细胞因子进入循环,巨噬细胞、单核细胞、内皮细胞、血小板被激活,产生保护性细胞因子,对抗、中和上述破坏性细胞因子,调控炎性介质的释放及其效应,维持内环境稳定。
如损伤程度较重或原发病使调控能力下降甚至崩溃,则可引起广泛的网状内皮系统激活,致内环境失衡,表现为全身自我攻击性的细胞死亡,远隔器官功能障碍。
临床上,发生下列2项或2项以上情况可诊断为SIRS 。
①体温高于38℃或低于36℃;②心率大于90次/min ;③呼吸频率超过20次/min ,PaCO 2低于4.3kPa ;④白细胞计数高于12×109/L 或低于4×109/L 或出现10%以上的非成熟颗粒[11~13]。
大宗病例回顾分析发现,胃肠道手术后并发症和终末器官功能障碍的发生与SIRS 发生率呈正相关,量化SIRS 可以预测术后发生并发症的可能性(见图1)。
图1 IRI 与SIRS 、MODS 的关系 MODS 是指患者的内环境在没有医学干预的情况下不能维持平衡,生命功能发生序贯性障碍。
其诱因有4个“I ”,即:injury (损伤),inflammation (炎症),IRI (缺血再灌注损伤),inadequate blood flow (缺血),其病理机制为不能自限的内源性炎性介质爆发而导致的自我破坏过程。
MODS 概念的提出,使人们重视对可能受累器官的功能保护,防止发生器官功能衰竭[14,15]。
从IRI 、SIRS 和MODS 的病理生理变化中发现炎性细胞被激活,炎性介质无自限的级联放大而造成自我破坏是三者共有的基础。
IRI 达到一定程度时,临床上就可表现为SIRS ,如果SIRS 不被尽早纠正,则MODS 终将难以避免。
因此,可以认为IRI 是MODS 的诱因之一,MODS 是IRI 的严重后果,而SIRS 则是二者的中间状态。
研究SIRS 时,人们易于重视造成病理损害的因素,事实上发生SIRS 时,另一类对抗炎性反应的细胞因子与介质也同时被激活,这种反应称为代偿性抗炎反应综合征(compensatoryantiinflammatory response syndrome ,CARS )[16]。
4 预防和治疗IRI 的方法4.1 预适应 目前研究较多的是缺血预适应、热预适应、药物预适应。
使即将缺血的部位先经历较短时间的缺血,能提高组织对缺血的耐受性。
实验表明,经缺血预适应的动物对长时间的IR 有较大的耐受性,神经肌肉功能损害较小。
使动物体温升高至40.5~41.5℃15min ,然后接受后肢IR ,发现经热预适应的动物肺水肿程度明显轻于对照组,而热休克蛋白72有较大的升高。
用热休克法预适应,能改善实验鼠肝对IRI 的耐受性。
预适应使机体产生急性反应蛋白,如热休克蛋白。
热休克蛋白能维持酶蛋白的空间结构,减少自由基对细胞膜的损害;短暂的能量缺乏可使细胞的能量储备能力提高;热刺激更能减少IRI 引起的ICAM 21表达[17,18]。
4.2 控制局部损伤 IRI 时,局部微循环中凝血因子大量聚集,血细胞聚集肿胀,微循环瘀滞。
局部细胞因子、炎症介质激活释放,又加重了组织的损伤。
因此,尽早恢复血供,降低局部组织温度,应用抗凝、祛聚类药物可以减轻IRI 的程度。
高渗、高张盐水能减轻细胞肿胀,改善局部微循环。
用7.5%盐水合并6%右旋糖酐液灌注鼠下肢,能明显改善下肢和远隔器官的功能障碍[19]。
4.3 抑制自由基 在血管手术患者中,发现术前总体抗氧化能力低的患者术后SIRS 发生率高,因此提高抗氧化能力能有效改善IRI 。
禁食1d 后,鼠肝对IRI 耐受力降低,其脂氧化加强,氧自由基增加,由此认识到营养对机体抵御氧自由基损伤的重要性。