第二节热量平衡计算
- 格式:ppt
- 大小:622.00 KB
- 文档页数:44


热学基础热传导与热平衡的分析与计算热学是物理学的一个重要分支,它研究热量传递和热平衡等热现象。
本文将对热传导和热平衡进行详细的分析和计算。
一、热传导热传导是指热量通过物质的传递,常见的方式有导热、导热和辐射等。
导热是最常见的传热方式,它依赖于物质内部的分子热运动。
导热可以通过热传导方程来描述:q = -kA∆T/∆x其中,q表示单位时间内通过物体的热量,k是热导率,A是传热面积,∆T是温度差,∆x是传热距离。
根据热传导方程,我们可以计算物体的热传导率和传热功率。
二、热平衡热平衡是指两个物体之间的温度差为0,不再存在热量传递。
当两个物体之间达到热平衡时,它们的温度相等。
热平衡的条件可以通过热平衡方程来表达:q1 = q2其中,q1和q2分别代表两个物体的热量。
热平衡方程告诉我们,当两个物体之间的热量相等时,它们达到热平衡状态。
三、热传导与热平衡的计算在实际问题中,我们常常需要计算热传导和热平衡的相关参数。
下面以一个具体的例子来说明如何进行计算。
考虑一个铜棒,长度为L,横截面积为A,温度分布随传热方向x变化。
假设铜棒的热导率为k,铜棒上端温度为T1,下端温度为T2,我们希望计算出铜棒内各点的温度分布。
首先,根据热传导方程,我们可以得到铜棒内各点的温度分布:∆T/∆x = -q/kA其中,∆T是铜棒内两个相邻点的温度差,∆x是相邻点之间的距离。
假设我们已知铜棒上下端的温度,即T1和T2,我们可以利用以上方程进行计算。
首先,选择适当的步长∆x,将铜棒分为N个小段,假设第i段的温度为Ti。
根据以上方程,我们可以得到:(Ti+1 - Ti)/∆x = -q/(kA)其中,i取值从1到N-1。
根据热平衡方程,我们有:q = -kA(T2 - T1)/L将其带入上述方程,可以得到:Ti+1 - Ti = kA(T2 - T1)/(L∆x)根据以上方程,我们可以利用迭代的方法,从上端到下端,求解各段的温度。
四、总结通过上述分析和计算,我们可以详细了解热传导和热平衡的概念、原理和计算方法。


第五章能量衡算第一节概述第二节热量衡算第三节过程的热效应第四节热量衡算举例第五节加热剂、冷却剂及其其他能量消耗的计算5.1 概述5.1.1 能量衡算的目的和意义计算过程能耗指标进行方案比较,选定先进生产工艺。
能量衡算数据是设备选型和计算的依据;是组织、管理、生产、经济核算和最优化的基础5.1.2 能量衡算的的依据及必要条件依据为能量守恒定律条件:物料衡算的数据,相关热力学物性数据。
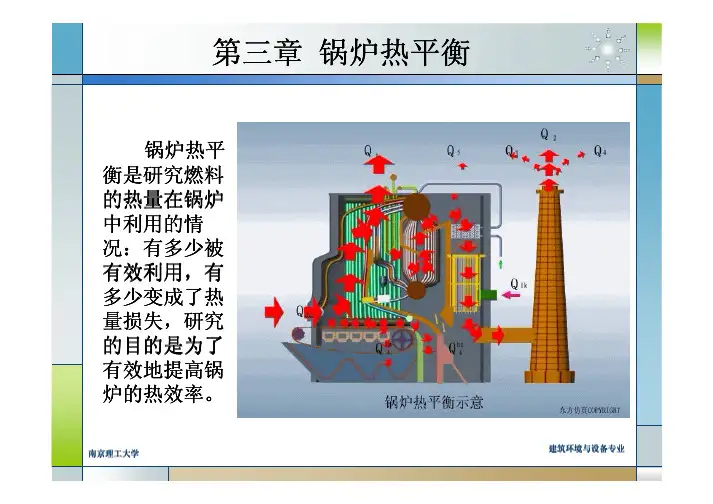
5.1.3 能量守恒的基本方程输出能量+消耗能量+积累能量=输入能量+生成能量5.1.4 能量衡算的分类单元设备的能量衡算和系统的能量衡算5.2 热量衡算5.2.1 热量平衡方程式Q —物料带入设备的热量,kJ ;Q2—加热剂或冷却剂传给设备及所处理物料的热量,kJ ;Q3 —过程的热效应,kJ;(注意符号规定)Q4—物料带出设备的热量,kJ ;Q5—加热或冷却设备所消耗的热量或冷量,kJ ;Q6 —设备向环境散失的热量,kJ。
注意各Q勺符号规定Q为设备的热负荷。
若Q为正值,需要向设备及所处理的物料提供热量; 反之,表明需要从设备及所处理的物料移走热量。
对间歇操作,按不同的时间段分别计算Q的值,并取其最大值作为设备热负荷的设计依据。
522 各项热量的计算1、计算基准一般情况下,可以0C和1.013 105Pa为计算基准有反应的过程,也常以25C和1.013 105Pa为计算基准。
2、Q或Q的计算无相变时物料的恒压热容与温度的函数关系常用多项式来表示:若知物料在所涉及温度范围内的平均恒压热容,贝心3、Q的计算过程的热效应由物理变化热Q和化学变化热Q两部分组成物理变化热是指物料的浓度或状态发生改变时所产生的热效应。
若过程为纯物理过程,无化学反应发生,如固体的溶解、硝化混酸的配制、液体混合物的精馏等,则Q C= 0 。
化学变化热是指组分之间发生化学反应时所产生的热效应,可根据物质的反应量和化学反应热计算。
4、Q的计算稳态操作过程Q 5= 0非稳态操作过程由下式求QQ=' GC (T2-T1)G-设备各部件的质量,kg;G—设备各部件材料的平均恒压热容,kJ kg-1「C-1;T1—设备各部件的初始温度,C;T2—设备各部件的最终温度,C。






第五章 能量衡算第一节 概述当物料衡算完成后,对于没有热效应的过程,可直接根据物料衡算结果以及物料的性 质、处理量和工艺要求进行设备的工艺设计,以确定设备的型式、数量和主要工艺尺寸。
而对于伴有热效应的过程,则还必须进行能量衡算,才能确定设备的主要工艺尺寸。
在药 品生产中,无论是进行物理过程的设备,还是进行化学过程的设备,大多存在一定的热效 应,因此,通常要进行能量衡算。
对于新设计的设备或装置,能量衡算的目的主要是为了确定设备或装置的热负荷。
根 据热负荷的大小以及物料的性质和工艺要求,可进一步确定传热设备的型式、数量和主要 工艺尺寸。
此外,热负荷也是确定加热剂或冷却剂用量的依据。
在实际生产中,根据需要,也可对已经投产的一台设备、一套装置、一个车间或整个 工厂进行能量衡算,以寻找能量利用的薄弱环节,为完善能源管理、制定节能措施、降低 单位能耗提供可靠的依据。
能量衡算的依据是物料衡算结果以及为能量衡算而收集的有关物料的热力学数据,如 定压比热、相变热、反应热等。
能量衡算的理论基础是热力学第一定律,即能量守恒定律。
能量有不同的表现形式, 如内能、动能、势能、热能和功等。
在药品生产中,热能是最常见的能量表现形式,多数 情况下,能量衡算可简化为热量衡算。
第二节 热量衡算一、热量平衡方程式当内能、动能、势能的变化量可以忽略且无轴功时,输入系统的热量与离开系统的热 量应平衡,由此可得出传热设备的热量平衡方程式为65 4 3 2 1 Q Q Q Q Q Q + + = + + (51)式中 Q 1——物料带入设备的热量,kJ ;Q 2——加热剂或冷却剂传给设备及所处理物料的热量,kJ ; Q 3——过程的热效应,kJ ; Q 4——物料带出设备的热量,kJ ;Q 5——加热或冷却设备所消耗的热量或冷量,kJ ; Q 6——设备向环境散失的热量,kJ 。
在应用式(51)时,应注意除Q 1 和Q 4 外,其它Q 值都有正负两种情况。
第二节 土壤热通量和土温一、影响土壤温度的因素(一)土壤表面热量的收支土温的变化首先决定于土壤表面热量的收支状况。
地面的热量收支可用地面热量平衡方程来表示。
即B =LE+P+Q S (3-3) 式中B 为净辐射;P 为感热通量;LE 为潜热通量,E 为蒸发或凝结量,L 为蒸发或凝结耗热量(蒸发或凝结潜热),约等于2.5⨯106J/kg , Q S 为土壤热通量。
将(3—3)式改写为: Q S =B-LE+P (3-4)感热通量(P ):地面和大气间,在单位时间内,沿铅直方向通过单位面积流过的热量。
单位为:W/m 2或cal/(cm 2·min)。
土壤热通量(Q S ):单位时间、单位面积上的土壤热交换量。
白天,净辐射B 为正值(日出后40-60分钟),一部热量消耗于LE 上,一部热量消耗于P 上,余下的热量进入土壤;夜间(日落前60-90分钟),净辐射B 为负值,由LE 、P 和Q S 来补偿,土壤热通量方向与白天相反,也就是地面失去热量。
Q S 值的方向和大小,决定了土壤得失热量的多少,它直接影响到土壤温度的高低和变化。
由公式Q S =B-LE-P 可见,如果LE 和P 一定时,Q S 的值由净辐射B 值所决定。
净辐射绝对值愈大,地面得热或失热愈多,土温变化可能愈大。
如果B 值一定时,土壤愈潮湿,LE 增大,Q S 值减小,土温变化可能较缓和,感热通量值减小,气温变化也较缓和;土壤愈干燥,LE 减小,Q S 值增大,土温变化可能愈大,感热通量相应增大,气温变化愈大。
(二)土壤热属性当Q S 一定时,土温的高低和变化则决定于土壤热特性,如热容量、导热率和导温率。
土壤热容量和导热率愈大,土温变化则缓和;反之,土温变化较剧烈。
因此,土温的高低和变化主要决定于土壤的热收支和土壤热属性。
所以,所有影响土壤热收支和土壤热特性的因子都会影响到土温的高低和变化。
这些因子有纬度、季节、太阳高度、天气状况、斜坡方位和坡度、海拔高度、土壤种类、颜色、质地、土壤湿度和孔隙度、地面有无植物或其他覆盖物等等。