5氧化还原反应的四大规律
- 格式:ppt
- 大小:143.00 KB
- 文档页数:3

氧化还原反应的综合考查一、氧化还原反应几组概念间的关系二、氧化还原反应的“四大规律”及其应用1.强弱律(1)氧化性:氧化剂>氧化产物常考物质氧化性强弱顺序:KMnO4>Cl2>Br2>Fe3+>Cu2+(2)还原性:还原剂>还原产物常考物质还原性强弱顺序:SO2>I->Fe2+>Br->Cl-(3)应用:比较物质氧化性或还原性强弱,判断反应能否进行2.价态律(1)氧化还原反应发生时,其价态一般先变为邻位价态(2)同种元素不同价态之间的反应,高价态的元素化合价降低,低价态的元素化合价升高,但升高与降低的化合价只接近而不交叉(3)应用:判断物质的氧化产物或还原产物3.优先律(1)同时含有几种还原剂加入氧化剂,按还原性由强到弱依次反应(如向FeI2溶液中通入少量Cl2,I-优先反应)(2)同时含有几种氧化剂加入还原剂,按氧化性由强到弱依次反应(如含Fe3+、H+的混合液中加入铁,Fe3 +优先反应)(3)应用:判断物质的稳定性及反应的先后顺序4.守恒律(1)内容:氧化剂得电子总数=还原剂失电子总数,即氧化剂降价总数=还原剂升价总数(2)应用:①直接计算参与氧化还原反应物质间的数量关系;②配平氧化还原反应方程式1(2023·浙江嘉兴·统考二模)关于反应S+2KNO3+3C=K2S+N2↑+3CO2↑,下列说法正确的是A.该反应的氧化剂是硝酸钾B.生成标准状况下2.24LN2,反应共转移1mol电子C.氧化产物与还原产物的物质的量之比为3∶1D.电负性:O>N>C>K【答案】D【详解】A.反应S+2KNO3+3C=K2S+N2↑+3CO2↑中,N和S元素化合价降低,该反应的氧化剂是S和KNO3,故A错误;B.生成标准状况下2.24LN2,物质的量为0.1mol,则生成0.3molCO2,C元素由0价上升到+4价,转移1.2mol电子,故B错误;C.反应S+2KNO3+3C=K2S+N2↑+3CO2↑中,N和S元素化合价降低,C元素化合价上升,CO2为氧化产物,K2S和N2为还原产物,则氧化产物与还原产物的物质的量之比为3∶2,故C错误;D.非金属性越强,电负性越强,所以电负性:O>N>C>K,故D正确;故选D。

氧化还原反应氧化还原反应与四大基本反应类型的关系①置换反应都是氧化还原反应;②复分解反应都不是氧化还原反应;③有单质生成的分解反应是氧化还原反应;④有单质参加的化合反应也是氧化还原反应。
从数学集合角度考虑:氧化还原反应的概念1.基本概念。
氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Z n、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力2.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物[例1]金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”.工业上以金红石为原料制取Ti的反应为:aTiO2+bCl2+cC aTiCl4+c CO ……反应①TiCl4+2Mg Ti+2MgCl2 ……反应②关于反应①、②的分析不正确的是( )①TiCl4在反应①中是还原产物,在反应②中是氧化剂;②C、Mg在反应中均为还原剂,被还原;③在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;④a=1,b=c=2;⑤每生成19.2gTi,反应①、②中共转移4。
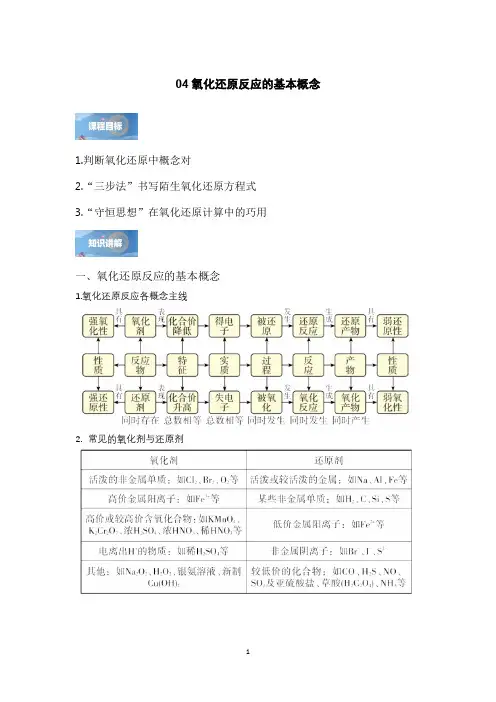
04氧化还原反应的基本概念1.判断氧化还原中概念对2.“三步法”书写陌生氧化还原方程式3.“守恒思想”在氧化还原计算中的巧用一、氧化还原反应的基本概念1.氧化还原反应各概念主线2.常见的氧化剂与还原剂高考真题演练1.(2023·浙江·高考真题)关于反应322222NH OH 4Fe N O O =4Fe 4H H ++++↑+++,下列说法正确的是A .生成21molN O ,转移4mol 电子B .2NH OH 是还原产物C .2NH OH 既是氧化剂又是还原剂D .若设计成原电池,2Fe +为负极产物2.(2022·山东·高考真题)实验室制备4KMnO 过程为:①高温下在熔融强碱性介质中用3KClO 氧化2MnO 制备24K MnO ;②水溶后冷却,调溶液pH 至弱碱性,24K MnO 歧化生成4KMnO 和2MnO ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得4KMnO 。
下列说法正确的是 A .①中用瓷坩埚作反应器 B .①中用NaOH 作强碱性介质 C .②中24K MnO 只体现氧化性D .2MnO 转化为4KMnO 的理论转化率约为66.7%3.(2022·山东·高考真题)古医典富载化学知识,下述之物见其氧化性者为A .金(Au):“虽被火亦未熟"B .石灰(CaO):“以水沃之,即热蒸而解”C .石硫黄(S):“能化……银、铜、铁,奇物”D .石钟乳(3CaCO ):“色黄,以苦酒(醋)洗刷则白”二、氧化还原反应的基本规律(1) 价态表现规律元素处于最高价态时只有氧化性,处于最低价态时只有还原性,处于中间价态时既具有氧化性又具有还原性。
(2) 价态转化规律① 含同种元素的不同价态的物质之间发生氧化还原反应时要遵循“只靠拢不交叉不重叠”的归中反应规律。
② 含同种元素的同一价态的物质发生氧化还原反应时,则遵循着从中间价态分别向高价态与低价态转化的歧化反应规律。

氧化还原反应专项练习一、氧化还原反应1、氧化还原反应与四大基本反应类型关系2、氧化还原反应的概念:氧化还原反应实质:电子的转移(得失或偏移) 氧化还原反应特征:化合价变化氧化还原反应中的概念一般是成对出现的,理清概念是解决问题的关键。
还原剂→失去电子→化合价升高→被氧化→得氧化产物氧化剂→获得电子→化合价降低→被还原→得还原产物3、氧化还原反应中电子转移方向和数目的表示方法:双线桥法4、常见的氧化剂和还原剂:氧化剂:易得电子或化合价易降低的物质。
①活泼的非金属单质:O2、Cl2、S等②高价态的金属阳离子:Fe3+、Cu2+等③其它高价态的物质:HNO3、KMnO4、浓H2SO4、KClO3等④过氧化物:H2O2、Na2O2等还原剂:易失电子或化合价易升高的物质。
①活泼的金属②不十分活泼的非金属:C、P、S、Si等③低价态的金属阳离子:Fe2+④部分阴离子:SO32–、S2–、I–、Br–等⑤低价态的物质:H2S、CO等例1、下列反应中,属于非氧化还原反应的是( )A.3CuS+8HNO3 == 3Cu(NO3)2+2NO↑+3S↓+4H2O B。
3Cl2+6KOH == 5KCl+KClO3+3H2OC。
3H2O2+2KCrO2+2KOH == 2K2CrO4+4H2O D.3CCl4+K2Cr2O7 == 2CrO2Cl2+3COCl2+2KCl常见元素的化合价可以借助化合价口诀来记忆:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。
判断下列物质中元素的化合价CuFeS2K2FeO4Li2NH LiNH2AlN Na2S2O3C2O错误!HCN CuH K2FeO4Si3N4例2、KMnO4+HBr—Br2+MnBr2+KBr+H2O 氧化剂,还原剂,氧化产物,还原产物,若消耗0。
1mol氧化剂,则被氧化的还原剂的物质的量为mol。

氧化还原反应的规律及应用教案一、学习目标1. 进一步复习巩固氧化还原反应各概念;掌握其内在联系;2. .掌握氧化还原反应五大规律:守恒律、价态律、强弱律、优先律、转化律二、重点难点重点:氧化还原反应的概念及其内在联系;难点:掌握氧化还原反应五大规律:守恒律、价态律、强弱律、优先律、转化律..三、教学设计导入:同学们已经学习过了氧化还原反应;相信大家已经对氧化还原反应有了一定的了解;那么什么是氧化还原反应呢氧化还原反应中还蕴含着怎样的规律呢今天我们来一起学习一下氧化还原反应的几个规律..首先我们来一起复习一下氧化还原反应的一些基本概念课前复习1、氧化还原反应的特征是_______________;本质是_____________..2、在氧化还原反应中;有五对既相对立又相联系的概念..它们的名称和相互关系是:氧化剂具有→所含元素化合价→电子→被→发生反应→得到产物..还原剂具有→所含元素化合价→电子→被→发生反应→得到产物..氧化剂 + 还原剂 === 氧化产物 + 还原产物3.电子转移的表示方法1双线桥:__________指向__________;__________指向__________得失相等2单线桥:__________指向__________;不计得失用两种方法表示氧化还原反应KClO 3+ 6HCl== KCl+3Cl 2+3 H 2O KClO 3+ 6HCl== KCl+3Cl 2+3 H 2O4.四大基本反应类型与氧化还原反应的关系 ⑴ 的置换反应都是氧化还原反应 ⑵ 的复分解反应都是非氧化还原反应 ⑶ 的化合反应一定是氧化还原反应 ⑷ 的分解反应一定是氧化还原反应 下面给大家5分钟的时间做一下下面的练习题.. 讲评练习题刚才我们一起复习了一下氧化还原反应的基本概念;大家掌握的都不错;那么大家想不想进一步探索氧化还原反应的规律呢 下面我们来一起学习氧化还原反应的基本规律.. 二、氧化还原反应的规律1.守恒规律a.质量守恒b.电荷守恒:对于离子反应;方程式左右两边的电荷数的______________; 例:单质铁溶于一定浓度的硝酸中反应的方程式如下:a Fe+b NO 3-+c H +==d Fe 2++f Fe 3++g NO ↑+h N 2O ↑+k H 2O 系数均为自然数 1b 、c 、d 、f 的关系式是__________________________电荷守恒 2d 、f 、g 、h 的关系式是___________________________得失电子守恒 c.得失电子守恒_______升降守恒:_______电子数=失_______电子数 计算公式:n 氧化产物×变价原子个数×化合价变化值==n 还原产物×变价原子个数×化合价变化值n 氧化剂×变价原子个数×化合价变化值==n 还原剂×变价原子个数×化合价变化值例1:已知M 2O 7x -+3S 2-+14H + 2M 3++3S ↓+7H 2O;则M 2O 7x -中的M 的化合价为 A .+2 B .+3 C .+4 D .+6练习1:在一定条件下;R03n-和氟气可发生如下反应: R03n-+F 2+20H -= R04-+2F -+H 2O..从而可知在R03n-中;元素R 的化合价是A .+4B .+5C .+6D .+7例2:硫代硫酸钠可作为脱氯剂;已知25.0mL 0.100 mol·L -1Na 2S 2O 3溶液恰好把224mL 标准状况下Cl 2完全转化为Cl -离子;则S 2O 32-将转化成A .S 2-B .SC .SO 32-D .SO 42-练习2. 24 mL 浓度为0.05 mol/L 的Na 2SO 3溶液恰好与20 mL 浓度为0.02 mol/L 的K 2Cr 2O 7溶液完全反应..已知Na 2SO 3被K 2Cr 2O 7氧化为Na 2SO 4;则元素Cr 在还原产物中的化合价为 ..A.+2 B +3C.+4D.+5例3:硫酸铵在强热条件下分解;生成NH 3、SO 2、N 2、H 2O;反应中生成的氧化产物和还原产物的物质的量之比是 ..A.1:3 B. 2:3 C. 1:1 D. 4:3练习3:在KClO 3+6HCl 浓===KCl +3Cl 2↑+3H 2O 反应中;氧化剂与还原剂的物质的量之比为 A .1∶6B .1∶5C .6∶1D .5∶1例4:在一定条件下;分别以高锰酸钾、氯酸钾和过氧化氢为原料制取氧气;当制得同温同压下相同体积的氧气时;三个反应中转移的电子数之比为 A .1∶1∶1 B .2∶2∶1 C .2∶3∶1D .4∶3∶22.价态规律:应用:判断物质氧化性.还原性及反应的可能性.1a.元素的最高价态只具有_______;如:Fe3+、H+、Al3+、浓H2SO4中S+6、HNO3中的 N+5等..b.元素的最低价态只具有_______;如:Fe 、Cu 、S2-、I -、Br -等..c.中间价态既有_______又有_______;如:S 、S+4、Fe2+、NO 等 2同种元素不同价态之间若发生反应;元素的化合价_____________________..例:KClO3+6HCl==KCl+3Cl2↑+ 3H2O 反应中; KClO3中+5的氯元素不会转化为KCl 中-1价的氯元素..3同种元素;相邻价态间_______氧化还原反应;例如浓硫酸与二氧化硫不会发生反应..4歧化律——处于中间价态的元素同时升降;例如:3Cl 2+6KOH KClO 3+5KCl+3H 2O归中律——同种元素不同价态反应时;化合价向中间靠拢;且一般符合邻位转化和互不换位规律..例5:G 、Q 、X 、Y 、Z 均为氯的含氧化合物;我们不了解它们的化学式;但知道它们在一定条件下具有如下的转换关系未配平:①G Q+NaCl②Q+H 2O X+H 2 ③Y+NaOHG+Q+H 2O④Z+NaOH Q+X+H 2O 这五种化合物中氯元素的化合价由低到高的顺序为A.QGZYXB.GYQZXC.GYZQXD.ZXGYQ3.强弱规律——强制弱应用:比较物质氧化性还原性的强弱例6:根据反应式:① 2Fe3+ + 2I - = 2Fe2+ + I2 ② Br2 + 2Fe2+ = 2Fe3+ + 2Br-可判断离子的还原性从强到弱的顺序是 A 、Br- 、Fe2+ 、Cl- B 、I- 、Fe2+ 、Br- C 、Br- 、I- 、Fe2+ D 、Fe2+ 、I- 、Br-练习:已知I -、Fe 2+、SO 2、Cl -和H 2O 2均有还原性;它们在酸性溶液中还原性的顺序为SO 2>I ->Fe 2+>H 2O 2>Cl -;则下列反应不可能发生的是 ..A .2Fe 3++SO 2+2H 2O==2Fe 2++SO 42-+4H +B .I 2+SO 2+2H 2O==H 2SO 4+2HIC .2Fe 2++I 2==2Fe 3++2I -D .H 2O 2+SO 2==H 2SO 4 4.先后规律——强者优先应用:判断物质的稳定性和反应的先后顺序1越易失电子的物质;失电子后就越难得电子; 越易得电子的物质;得电子后就越难失电子;2一种氧化剂同时和几种还原剂相遇时; ______________的优先发生反应;同理;一种还原剂遇多种氧化剂时;______________的优先发生反应..注意:难失电子的物质不一定易得电子..例如稀有气体既难得电子又难失电子..例7:在铁与铜的混和物中;加入不足量的稀硝酸;充分反应后剩余金属m 1g;再向其中加入一定量的稀硫酸;充分振荡后;剩余金属m 2g;m 1与m 2的关系是A .m 1一定大于m 2B .m 1可能等于m 2C .m 1一定等于m 2D .m 1可能大于m 2例8、在100ml 含等物质的量HBr 和H 2SO 3的溶液里通入0.01molC12;有一半Br -变为Br 2已知Br 2能氧化H 2SO 3..原溶液中HBr 和H 2SO 3的浓度都等于 A 、0.0075mol /L B 、0.0018mol /L C 、0.075mol /L D 、0.08mol/L 练习:已知Co 2O 3在酸性溶液中易被还原成Co 2+..Co 2O 3、Cl 2、FeCl 3、I 2的氧化性依次减弱..下列反应在水溶液中不可能发生的是A.3Cl 2+6FeI 2=2FeCl 3+4FeI 3B.Cl 2+FeI 2=FeCl 2+I 2C.Co 2O 3+6HCl=2CoCl 2+Cl 2+3H 2OD.2Fe 3++2I -=2Fe 2++I 2综合应用题:KClO 3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯;其变化可表述为____KClO 3+____HCl 浓=____KCl+____ClO 2↑+____Cl 2↑+____H 2O 1 请配平上述化学方程式..2 浓盐酸在反应中显示出来的性质是________填编号①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性3 产生0.1mol Cl 2;则转移的电子的物质的量为________mol..4 氧化剂是________;还原剂是________;氧化产物是________;还原产物是________..在刚才的学习中有几类特殊的氧化还原反应;大家还记得吗 我们来一起总结一下三、3种特殊的氧化还原反应 1归中反应 2歧化反应 3部分氧化例9:在反应8NH 3 + 3Cl 2 = 6NH 4Cl + N 2中;若有56克N 2生成;则发生氧化反应的物质的质量是 A 、68g B 、71g C 、102g D 、272g 被氧化的与未被氧化的的质量比为 A .3∶8 B .1∶4 C .3∶4 D .1∶3练习:一定条件下硝酸铵受热分解的化学方程式为:5NH 4NO 3=2HNO 3+4N 2+9H 2O;在反应中被氧化与被还原的氮原子数之比为 A .5∶3 B .5∶4 C .1∶1 D .3∶5课堂小结:四、板书设计:一、氧化还原反应的基本概念二、氧化还原反应的基本规律1.守恒规律a.质量守恒b.电荷守恒:c.得失电子守恒 2.价态规律:应用:判断物质氧化性.还原性及反应的可能性.1a.元素的最高价态只具有 b.元素的最低价态只具有_______; c.中间价态既有_______又有_______..2同种元素不同价态之间若发生反应;元素的化合价_____________________..3同种元素;相邻价态间_______氧化还原反应.. 3.强弱规律——强制弱应用:比较物质氧化性还原性的强弱 4.先后规律——强者优先应用:判断物质的稳定性和反应的先后顺序一种氧化剂同时和几种还原剂相遇时; ______________的优先发生反应;同理;一种还原剂遇多种氧化剂时;______________的优先发生反应.. 三、3种特殊的氧化还原反应3NH 3NH1归中反应2歧化反应3部分氧化五、课后反思:。

氧化复原反响知识点归纳一、根本概念1、定义:特征或外在表现:本质:2、5组概念①氧化剂:得电子(或电子对偏向)的物质;复原剂:失电子(或电子对偏离)的物质。
②氧化反响:元素化合价升高的反响;复原反响:元素化合价降低的反响。
③氧化性:氧化剂具有的得电子的能力;复原性:复原剂具有的失电子的能力。
④氧化产物:复原剂被氧化后的对应的生成物;复原产物:氧化剂被复原后对应的生成物。
⑤被氧化:复原剂在反响时化合价升高的过程;被复原:氧化剂在反响时化合价降低的过程。
口诀:氧化剂,降得还。
什么剂,什么性。
什么产物,什么性。
3、氧化复原反响与四大根本反响类型的关系——图示①有单质参与的反响一定是氧化复原反响。
②有单质参与的化合或分解反响一定是氧化复原反响。
③无单质参与的化合反响一定不是氧化复原反响。
④氧化剂和复原剂可以是同一种物质。
⑤氧化产物和复原产物可以是同一种物质。
4、常见氧化剂①非金属性较强的单质:F2、Cl2、Br2、I2、O3、O2等②变价元素中高价态化合物:KClO3、KMnO4、Fe3+盐、K2Cr2O7、浓H2SO4、HNO3、K2FeO4、Ag+、Cu2+等③其它HClO、MnO2、Na2O2、H2O2、NO2、CO2、银氨溶液、新制氢氧化铜等5、常见复原剂①金属性较强的单质K、Na、Mg、Al、Fe、Zn②某些非金属单质:H2、C、Si等③变价元素中某些低价态化合物:H2S、HBr、HI、Fe2+及碱和盐、CO、SO2、Na2SO3、Na2S2O3等二、单双线桥1、在氧化复原反响中,表示同一元素反响前后电子转移情况时,分别将氧化剂与其产物、复原剂与其产物中相应的变价元素用直线连接起来,箭头从反响物指向产物,线上标出得失电子总数,称为“双线桥法〞。
2、表示氧化剂和复原剂之间元素的电子转移情况时,将氧化剂中降价元素与复原剂中升价元素用直线连接起来,箭头从复原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法〞。



i r氧化还原反应氧化还原反应与四大基本反应类型的关系①置换反应都是氧化还原反应;②复分解反应都不是氧化还原反应;③有单质生成的分解反应是氧化还原反应;④有单质参加的化合反应也是氧化还原反应。
从数学集合角度考虑:氧化还原反应的概念1.基本概念.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物还原产物通过发生还原反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS 2+11O 2=2Fe 2O 3+8SO 2中,Fe 2O 3和SO 2均既为氧化产物,又为还原产物。
氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X 2)、O 2、S 等(2)高价金属阳离子;如Fe 3+、Cu 2+等(3)高价或较高价含氧化合物;如MnO 2、浓H 2SO 4、HNO 3、KMnO 4等(4)过氧化物;如Na 2O 2、H 2O 2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K 、Na 、Z n 、Fe 等②一些非金属单质;如H 2、C 、Si 等③较低态的化合物;CO 、SO 2、H 2S 、Na 2SO 3、FeSO 4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力2.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物[例1]金属钛(Ti )性能优越,被称为继铁、铝制后的“第三金属”。
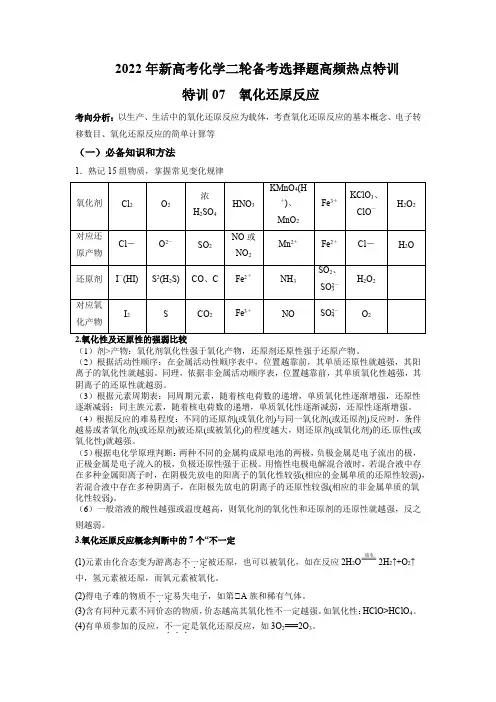
2022年新高考化学二轮备考选择题高频热点特训特训07 氧化还原反应考向分析:以生产、生活中的氧化还原反应为载体,考查氧化还原反应的基本概念、电子转移数目、氧化还原反应的简单计算等(一)必备知识和方法1.熟记15组物质,掌握常见变化规律氧化剂Cl2O2浓H2SO4HNO3KMnO4(H+)、MnO2Fe3+KClO3、ClO-H2O2对应还原产物Cl-O2-SO2NO或NO2Mn2+Fe2+Cl-H2O还原剂I-(HI)S2(H2S)CO、C Fe2+NH3SO2、SO2-3H2O2对应氧化产物I2S CO2Fe3+NO SO2-4O2(1)剂>产物:氧化剂氧化性强于氧化产物,还原剂还原性强于还原产物。
(2)根据活动性顺序:在金属活动性顺序表中,位置越靠前,其单质还原性就越强,其阳离子的氧化性就越弱。
同理,依据非金属活动顺序表,位置越靠前,其单质氧化性越强,其阴离子的还原性就越弱。
(3)根据元素周期表:同周期元素,随着核电荷数的递增,单质氧化性逐渐增强,还原性逐渐减弱;同主族元素,随着核电荷数的递增,单质氧化性逐渐减弱,还原性逐渐增强。
(4)根据反应的难易程度:不同的还原剂(或氧化剂)与同一氧化剂(或还原剂)反应时,条件越易或者氧化剂(或还原剂)被还原(或被氧化)的程度越大,则还原剂(或氧化剂)的还原性(或氧化性)就越强。
(5)根据电化学原理判断:两种不同的金属构成原电池的两极,负极金属是电子流出的极,正极金属是电子流入的极,负极还原性强于正极。
用惰性电极电解混合液时,若混合液中存在多种金属阳离子时,在阴极先放电的阳离子的氧化性较强(相应的金属单质的还原性较弱),若混合液中存在多种阴离子,在阳极先放电的阴离子的还原性较强(相应的非金属单质的氧化性较弱)。
(6)一般溶液的酸性越强或温度越高,则氧化剂的氧化性和还原剂的还原性就越强,反之则越弱。
3.氧化还原反应概念判断中的7个“不一定(1)元素由化合态变为游离态不一定...被还原,也可以被氧化,如在反应2H2O2H2↑+O2↑中,氢元素被还原,而氧元素被氧化。
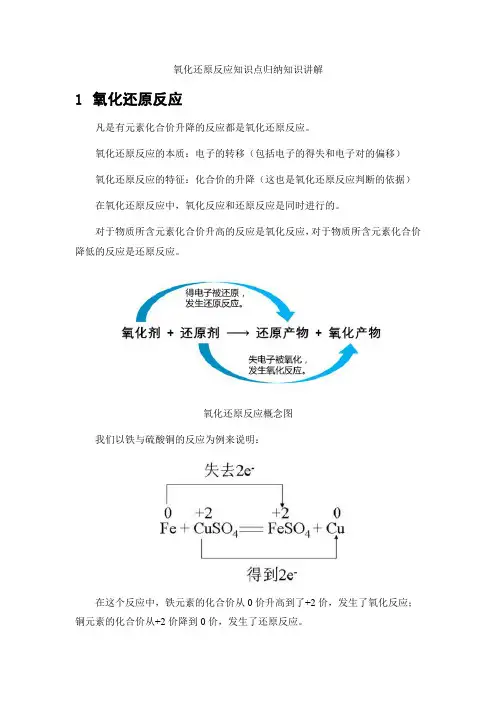
氧化还原反应知识点归纳知识讲解1氧化还原反应凡是有元素化合价升降的反应都是氧化还原反应。
氧化还原反应的本质:电子的转移(包括电子的得失和电子对的偏移)氧化还原反应的特征:化合价的升降(这也是氧化还原反应判断的依据)在氧化还原反应中,氧化反应和还原反应是同时进行的。
对于物质所含元素化合价升高的反应是氧化反应,对于物质所含元素化合价降低的反应是还原反应。
氧化还原反应概念图我们以铁与硫酸铜的反应为例来说明:在这个反应中,铁元素的化合价从0价升高到了+2价,发生了氧化反应;铜元素的化合价从+2价降到0价,发生了还原反应。
2氧化剂与还原剂氧化剂:得到电子(或电子对偏向)的物质。
氧化剂具有氧化性,在反应中化合价降低,被还原,发生还原反应,得到的产物是还原产物。
还原剂:失去电子(或电子对偏移)的物质。
还原剂具有还原性,在反应中化合价升高,被氧化,发生氧化反应,得到的产物是氧化产物。
我们还以铁与硫酸铜的反应为例来说明。
3氧化还原反应的五条基本规律(1)电子得失守恒规律:氧化剂得到电子总数=还原剂失去电子总数;(2)“以强制弱”规律:氧化剂+还原剂=较弱氧化剂+较弱还原剂;这是氧化还原反应发生的条件。
(3)价态归中规律:同一元素不同价态间发生的氧化还原反应,化合价的变化规律遵循:高价+低价→中间价态,中间价态可相同、可不同,但只能靠近不能相互交叉(即价态向中看齐)。
KClO3+6HCl=KCl+3Cl2+3H2O而不是KClO3+6HCl=KCl+3Cl2+3H2O(4)歧化反应规律:发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。
其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2十2NaOH=NaCl十NaClO十H20(5)优先反应原理:在溶液中如果存在多种氧化剂(还原剂),当向溶液中加入一种还原剂(或氧化剂)时,还原剂(或氧化剂)先把氧化性(或还原性)强的氧化剂(或还原剂)还原(或氧化)。
高一化学必修一知识点:氧化还原反应(人教版)【导语】以下是作者为大家推荐的有关高一化学必修一知识点:氧化还原反应(人教版),如果觉得很不错,欢迎分享~感谢你的浏览与支持!一、概念判定:1、氧化还原反应的实质:有电子的转移(得失)2、氧化还原反应的特点:有化合价的升降(判定是否氧化还原反应)3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,产生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,产生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化(由阳离子变单质),也可能被还原(由阴离子变单质)。
8、元素价态有氧化性,但不一定有强氧化性;元素态有还原性,但不一定有强还原性;阳离子不一定只有氧化性(不一定是价态,,如:Fe2+),阴离子不一定只有还原性(不一定是态,如:SO32-)。
9、常见的氧化剂和还原剂:10、氧化还原反应与四大反应类型的关系:【同步练习题】1.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。
S2O32-和Cl2反应的产物之一为SO42-。
下列说法不正确的是()A.该反应中还原剂是S2O32-B.H2O参与该反应,且作氧化剂C.根据该反应可判定氧化性:Cl2>SO42-D.上述反应中,每生成lmolSO42-,可脱去2molCl2答案:B点拨:该反应方程式为:S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+,该反应中氧化剂是Cl2,还原剂是S2O32-,H2O参与反应,但既不是氧化剂也不是还原剂,故选B。
2.(2011•河南开封高三一模)分析以下残缺的反应:RO3-+________+6H+===3R2↑+3H2O。
下列叙述正确的是()A.R一定是周期表中的第ⅤA族元素B.R的原子半径在同周期元素原子中最小C.上式中缺项所填物质在反应中作氧化剂D.RO3-中的R元素在所有的反应中只能被还原答案:B点拨:RO3-中R为+5价,周期表中ⅤA、ⅦA元素均可形成RO3-离子,A毛病;据元素守恒,反应中只有R、H、O三种元素,则缺项一定为R-,且配平方程式为RO3-+5R-+6H+===3R2↑+3H2O,据此可得R为ⅦA元素,B正确;R-中R处于态,只能作还原剂,C毛病;RO3-中R元素处于中间价态,在反应中既可被氧化又可被还原,D项错。
氧化还原反应氧化还原反应与四大基本反应类型的关系①置换反应都是氧化还原反应;②复分解反应都不是氧化还原反应;③有单质生成的分解反应是氧化还原反应;④有单质参加的化合反应也是氧化还原反应。
从数学集合角度考虑:氧化还原反应的概念1.基本概念.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物2.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物[例1]金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。
工业上以xx为原料制取Ti的反应为:aTiO2+bCl2+cCaTiCl4+cCO ……反应①TiCl4+2MgTi+2MgCl2……反应②关于反应①、②的分析不正确的是()①TiCl4在反应①中是还原产物,在反应②中是氧化剂;②C、Mg在反应中均为还原剂,被还原;③在反应①、②xxMg的还原性大于C,C的还原性大于TiCl4;④a=1,b=c=2;⑤每生成19.2gTi,反应①、②中共转移4.8mol e-。
A.①②④B.②③④C.③④D.②⑤标电子转移的方向和数目(双线桥法、单线桥法)①单线桥法。
从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。
例:2e-MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O②双线桥法。
得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。
例:得2e-——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O失2e-——两类特殊的化学反应①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
例:得5×e3Cl2+6KOHKClO3+5KCl+3H2O失5e②归中反应。
不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。
氧化还原反应的四大规律
一、反应中氧化物收缩,还原物扩大:
当一种物质发生氧化反应,以及它所能释放出来的氧化物,就会减少,而它可以接受到的还原物就会增加。
例如,当硫化锌和氯气发生反应,硫化锌氧化为硫酸铜,其中硫化锌就会减少,而氯气则会增加。
二、反应总是把氧元素运送到还原物质:
当一种物质发生氧化反应时,它可以放出氧元素。
然而,这些氧元素的最终目的总是被运送到另一种还原物质,以完成还原反应。
例如,当硫酸铜和过氧化钠发生反应时,硫酸铜将氧化为硫化铜,而过氧化钠可以接受这些氧元素,从而发生还原反应。
三、反应通常会产生微量的碱性或酸性物质:
反应的发生是由于物质的微量碱性或酸性物质而影响的。
例如,当一种氧化物和一种还原物发生反应时,反应的本质就是碱性或酸性物质的作用。
四、氧化还原反应是水的重要部分:
水中的氧化还原反应也可以做一些很有趣的事情。
例如,氧化还原反应能够帮助鱼从水中获取有氧气,还有些藻类也可以利用氧化还原反应进行光合作用来获取能量。
虽然水中反应的含量不多,但是它们可以维持水体中的氧化还原平衡,使得水能满足生物的需要。
它们也清除了陆地中的各种有害物质,使陆地生态系统能够得到保护。