生物化学-生化知识点_酶促反应动力学 (9章)
- 格式:pdf
- 大小:144.92 KB
- 文档页数:5


第九章酶促反应动力学提要酶促反应动力学是研究酶促反应的速率以及影响此速率各种因素的科学。
它是以化学动力学为基础讨论底物浓度、抑制剂、pH、温度及激活剂等因素对酶反应速率的影响。
化学动力学中在研究化学反应速率与反应无浓度的关系时,常分为一级反应、二级反应及零级反应。
研究证明,酶催化过正的第一步是生成酶-底物中间产物,Michaelis-Menten该呢举中间产物学说的理论推导出酶反应动力学方程式,即Km、Vmax、kcat、kcat/Km。
Km是酶的一个特征常数,以浓度为单位,Km有多种用途,通过直线作图法可以得到Km及Vmax。
Kcat称为催化常数,又叫做转换数(TN值),它的单位为s-1,kcat值越大,表示酶的催化速率越高。
kcat/Km常用来比较酶催化效率的参数。
酶促反应除了单底物反应外,最常见的为双底物反应,按其动力学机制分为序列反应和乒乓反应,用动力学直线作图法可以区分。
酶促反应速率常受抑制剂影响,根据抑制剂与酶的作用方式及抑制作用是否可逆,将抑制作用分为可逆抑制作用及不可逆抑制作用。
根据可逆抑制剂与底物的关系分为竞争性抑制、非竞争性抑制及反竞争性抑制3类,可以分别推导出抑制作用的动力学方程。
竞争性抑制可以通过增加底物浓度而解除,其动力学常数Kˊm变大,Vmax不变;非竞争性抑制Km不变,Vˊmax变小;反竞争性抑制Kˊm及Vˊmax均变小。
通过动力学作图可以区分这3种类型的可逆抑制作用。
可逆抑制剂中最重要的是竞争性抑制,过度态底物类似物为强有力的竞争性抑制剂。
不可逆抑制剂中,最有意义的为专一性Ks型及kcat型不可逆抑制剂。
研究酶的抑制作用是研究酶的结构与功能、酶的催化机制、阐明代谢途径以及设计新药物的重要手段。
温度、pH及激活剂都会对酶促反应速率产生重要影响,酶反应有最适温度及最适pH,要选择合适的激活剂。
在研究酶促反应速率及测定酶的活力时,都应选择酶的最适反应条件。
习题1.当一酶促反应进行的速率为Vmax的80%时,在Km和[S]之间有何关系?[Km=0.25[S]]解:根据米氏方程:V=Vmax[S]/(Km+[S])得:0.8Vmax=Vmax[S]/(Km+[S])Km=0.25[S]2.过氧化氢酶的Km值为2.5×10-2 mol/L,当底物过氧化氢浓度为100mol/L时,求在此浓度下,过氧化氢酶被底物所饱和的百分数。
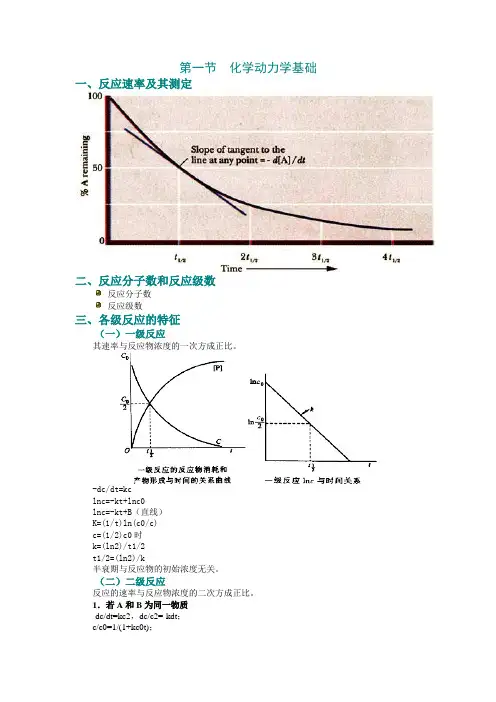
第一节化学动力学基础一、反应速率及其测定二、反应分子数和反应级数反应分子数反应级数三、各级反应的特征(一)一级反应其速率与反应物浓度的一次方成正比。
-dc/dt=kclnc=-kt+lnc0lnc=-kt+B(直线)K=(1/t)ln(c0/c)c=(1/2)c0时k=(ln2)/t1/2t1/2=(ln2)/k半衰期与反应物的初始浓度无关。
(二)二级反应反应的速率与反应物浓度的二次方成正比。
1.若A和B为同一物质-dc/dt=kc2,dc/c2=-kdt;c/c0=1/(1+kc0t);c/c0=1/2时,k=1/c0t1/2。
2.A和B的初始浓度相同k=(1/t){x/[a(a−x)] }3.A和B的初始浓度不同k=[1/t(a−b)]/ln{[b(a−x)]/[a(b−x)]}a:反应物A的初始浓度。
b:反应物B的初始浓度。
(a-x):反应时间为t时A的浓度。
(b-x):反应时间为t时B的浓度。
(三)零级反应反应速率与反应物的浓度无关。
-dc/dt=k,或dx/dt=k。
X=kt,或k=x/t。
第二节底物浓度对酶反应速率的影响一、中间产物学说中间产物学说的实验依据:(1)核酸和酶的复合物可直接用电镜观察;(2)下图;(3)复合物的溶解度和稳定性有所变化;(4)有些复合物可直接分离得到。
酶催化的反应中各成份的变化:酶反应的速度在不停地变,实验上只有初速度的测定才有意义。
酶反应的初速度与底物浓度之间的关系:二、酶促反应的动力学方程式(一)米氏方程的推导Briggs & Haldane 推导k1([Eo]-[ES])[S]=k2[ES]+k3[ES]Km=(k2+k3)/k1,[ES]=[Eo][S]/(Km+[S]) 因为v=k3[ES],而Vmax=k3[Eo] 因此v=Vmax[S]/(Km+[S])米氏方程v=Vmax[S]/(Km+[S])符合v-[S]曲线。
若Km>>[S],v=(Vmax/Km)[S]; 若[S]>>Km ,v=Vmax ;由v=Vmax[S]/(Km+[S]),得Km=[S][(Vmax/v)-1],为典型的双曲线方程。







第九章酶促反应动力学提要酶促反应动力学是研究酶促反应的速率以及影响此速率各种因素的科学。
它是以化学动力学为基础讨论底物浓度、抑制剂、pH、温度及激活剂等因素对酶反应速率的影响。
化学动力学中在研究化学反应速率与反应无浓度的关系时,常分为一级反应、二级反应及零级反应。
研究证明,酶催化过正的第一步是生成酶-底物中间产物,Michaelis-Menten该呢举中间产物学说的理论推导出酶反应动力学方程式,即Km、Vmax、kcat、kcat/Km。
Km是酶的一个特征常数,以浓度为单位,Km有多种用途,通过直线作图法可以得到Km及Vmax。
Kcat称为催化常数,又叫做转换数(TN值),它的单位为s-1,kcat值越大,表示酶的催化速率越高。
kcat/Km常用来比较酶催化效率的参数。
酶促反应除了单底物反应外,最常见的为双底物反应,按其动力学机制分为序列反应和乒乓反应,用动力学直线作图法可以区分。
酶促反应速率常受抑制剂影响,根据抑制剂与酶的作用方式及抑制作用是否可逆,将抑制作用分为可逆抑制作用及不可逆抑制作用。
根据可逆抑制剂与底物的关系分为竞争性抑制、非竞争性抑制及反竞争性抑制3类,可以分别推导出抑制作用的动力学方程。
竞争性抑制可以通过增加底物浓度而解除,其动力学常数Kˊm变大,Vmax不变;非竞争性抑制Km不变,Vˊmax变小;反竞争性抑制Kˊm及Vˊmax均变小。
通过动力学作图可以区分这3种类型的可逆抑制作用。
可逆抑制剂中最重要的是竞争性抑制,过度态底物类似物为强有力的竞争性抑制剂。
不可逆抑制剂中,最有意义的为专一性Ks型及kcat型不可逆抑制剂。
研究酶的抑制作用是研究酶的结构与功能、酶的催化机制、阐明代谢途径以及设计新药物的重要手段。
温度、pH及激活剂都会对酶促反应速率产生重要影响,酶反应有最适温度及最适pH,要选择合适的激活剂。
在研究酶促反应速率及测定酶的活力时,都应选择酶的最适反应条件。
习题1.当一酶促反应进行的速率为Vmax的80%时,在Km和[S]之间有何关系?[Km=0.25[S]]解:根据米氏方程:V=Vmax[S]/(Km+[S])得:0.8Vmax=Vmax[S]/(Km+[S])Km=0.25[S]2.过氧化氢酶的Km值为2.5×10-2 mol/L,当底物过氧化氢浓度为100mol/L时,求在此浓度下,过氧化氢酶被底物所饱和的百分数。
§2.8 酶促反应动力学(9章 P351)
一一一底物浓度对酶反应速率的影响
用反应初速度v对底物浓度[S]作图得P355 图9-6。
曲线分以下几段:
一1一OA段:反应底物浓度较低时v与[S]成正比,表现为一级反应, v = k[S]。
根据酶底物中间络合物学说,酶催化反应时,首先和底物结合生成中间
复合物ES,然后再生成产物P,并释放出E。
E + S = ES → P + E
OA段上,底物浓度小,酶未被底物饱和,有剩余酶,反应速率取决于ES浓
度,与[S]呈线性关系,v正比于[S]。
一2一AB段:反应速度不再按正比升高,表现为混合级反应。
此时酶渐渐为底物饱和,[E S]慢慢增加,v也慢慢增加,为分数级反应。
一3一BC段:反应速度趋于V max,为零级反应,酶促反应表现出饱和现象。
此时底物过量[S]>[E],
[E]已全部转为[E S]而恒定,因此反应速率也恒定,为最大反应速率,V m
为[E]所决定。
ax
非催化反应无此饱和现象。
酶与底物形成中间复合物已得到实验证实。
一一一酶促反应力学方程式
一1一米氏方程推导
1913年Michaelis和Menten提出并推导出表示[S]与v之间定量关系的米氏方程
V max[S]
V =
K m + [S]
Km:米氏常数,物理意义为反应速率为最大速率V max一半时底物的浓度,
单位与底物浓度同。
推导:酶促反应分两步进行。
k1 k3
E + S ES → P + E
k2
v = k3 [ES]
一般k3为限速步骤 v = k3 [ES] … ①
1.[ES] 生成速率:
d[ES]/dt = k1([E] - [ES]) [S]
2.[E S]分解速率:
-d[ES] / dt = k2 [ES] + k3 [ES] = (k2 + k3) [ES]
3.稳态下[ES]不变,ES生成速率和分解速率相等:
k1 ([E]- [ES]) [S] = (k2+k3) [ES]
4.引入K m:令K m = k2+k3 / k1
代入K m = ([E]- [ES]) [S] / [ES] ,
K m [ES] = [E] [S]- [S] [ES], [ES] (K m + S) = [E] [S],
[ES] = [E] [S] / K m+[S],
5.代入①式:v = k3 [ES] = k3 [E] [S] / K m + [S] … ②
6.引入V max:为所有酶都被底物饱和时的反应速率,即此时[E]= [ES]
V max = k3 [ES] = k3 [E]
代入②式:v = V max [S] / K m + [S]
米氏方程表示K m及V max已知时,v~[S]的定量关系。
一2一米氏常数的意义
1.K m是酶的一个特性常数,K m大小只与酶性质有关,而与酶浓度无
关。
当底物确定,反应温度,p H及离子强度一定时,K m值为常数,可用来
鉴别酶。
P359 表9-1 列出一些酶的K m值。
一般K m在1×10-6~10-1mol/L之间。
不同的酶K m值不同,测定K m要在相同测定条件(pH、温度、离子强度)下进行。
2.K m值可用于判断酶的专一性和天然产物,若一个酶有几种底物就
有几个K m值,其中K m值最小的底物称为该酶的最适底物,又称天然底物。
3. 1 / K m可近似表示酶与底物亲和力的大小。
真正表示酶与底物亲和力为K s=k2 / k1 ,(注 K m= k2+k3 / k1)。
4.已知K m可由[S]计算v,或由v计算[S]。
5.K m可帮助推断某一代谢反应的方向和途径。
K m小的为主要催化方向(正、逆两方向反应K m不同)。
一3一V max和k3(k cat)的意义:
酶浓度[E]一定,则对特定底物V max为一常数。
催化常数 k cat 又称酶的转化数,数值上与k3同,为酶被底物饱和时,每秒钟每个酶分子
转换底物的分子数。
大多数酶的k cat为1~104/sec,见P322 表8-
2,为每秒钟酶促反应每微摩尔酶分子转换底物的微摩尔数。
k cat越大,酶
催化效率越高。
一4一k cat / K m的意义:
生理条件下S << K m,V max = k cat [E]
代入米氏方程 v = k cat [E] [S] / K m + [S] = k cat [E] [S] / K m
得出:v = k cat / K m[E][S]
k cat / K m为[E]和[S]反应形成产物的表观二级速度常数,单位:L/mol s。
可以比较不同酶或同一种酶催化不同底物的催化效率,见P362 表9-4。
k cat / K m大小可以比较不同酶或同一种酶催化不同底物的催化效率。
一一一米氏常数求法:
一1一双倒数法:
1 / v = K m / V max×1 /[S] + 1 / V max
以1 / v ~ 1 / [S]作图,见P363 图9-10
纵轴截距:1 / V max;横轴截距:-1 / K m;斜率:K m / V max。
(2)v ~ v / [S]法(Eadic-Hofstee):
v = -K m×v / [S] +V max以v ~ v / [S]作图,见P363 图9-11。
斜率:-K m;纵轴截距:V max;横轴截距:V max / K m。
(3)[S] / v ~ [S]法(Hanes-Woolf):
[S] / v = K m / V max + 1 / V max×[S]
以[S] / v ~ [S]作图,见P363 图9-12
斜率:1 / V max;纵轴截距:K m / V max;横轴截距:-K m。
§2.9 酶的抑制作用
失活作用:使酶蛋白变性而引起酶活力丧失。
抑制作用:酶的必需基团的化学性质改变而引起酶活力降低或丧失,但不引起酶蛋白变性。
引起抑制作用的物质称为抑制剂。
研究酶的抑制剂,可以研究酶的结构与功能、酶催化机制,进行药物、农药的设计与筛选。
一一一抑制作用的类型:
一1一不可逆抑制作用:
抑制剂与酶必需基团以共价键结合而引起酶活力丧失,不能用透析、超过滤等物理方法除去抑制剂而使酶复活,酶被化学修饰。
一2一可逆抑制作用:
抑制剂与酶以非共价键结合而使酶活力降低或丧失,能用物理方法除去抑制剂而使酶复活。
可逆抑制又分为三种类型,如P369 图9-17所示。
1.竞争性抑制:抑制剂(I)和底物(S)竞争酶的结合部位,从而影响了
底物与酶的正常结合。
抑制剂结构大多与底物类似,许多底物过渡态类似物为抑制剂。
抑制剂与酶活性部位结合形成EI复合物,抑制酶与底物的结合。
竞争性抑制可以通过增加底物浓度而解除,如丙二酸或戊二酸对琥珀酸脱氢酶的抑制。
2.非竞争性抑制:底物和抑制剂同时和酶结合,两者无竞争作用。
I与
S结构无共同之处,酶活性降低或被抑制,不能用增加底物浓度来解除抑制,如Leu是精氨酸酶非竞争性抑制剂。
3.反竞争性抑制:酶只有与底物结合后才能与抑制剂结合。
常见于多
底物反应中,如肼类化合物抑制胃蛋白酶。
一一一可逆抑制作用和不可逆抑制作用动力学鉴别
加入一定量抑制剂,以v与酶浓度[E]作图,见P370 图9-8。
加不可逆抑制剂使直线原点右移,斜率不变,加入酶使浓度大于不可逆抑制剂,才表现酶活力;加可逆抑制剂,直线原点不动,斜率变小。
一一一可逆抑制作用动力学
一1一竞争性抑制:1 /v ~ 1 /[S]作图见P371 图9-20,V max不变,K m变大。
纵轴截距:1
/V max不变,V max不变,底物浓度足够高,可克服抑制作用;横轴截距:1
/K m变小,K m变大;斜率:K m / V max变大。
一2一非竞争性抑制:1 /v ~ 1 /[S]作图见P372 图9-21,V max变小,K m不变。