物理化学第二版第九章电化学基础知识
- 格式:ppt
- 大小:2.25 MB
- 文档页数:15




电化学基础知识电化学是一门研究电子在化学变化中作用的科学。
它主要研究电化学反应的机理、热力学和动力学等。
电化学可以用来研究电解质溶液的性质、金属腐蚀的原理、电池的工作原理、电镀的原理以及电化学分析等。
一、电化学反应一个化学反应发生,需要有电子的转移。
电化学反应也是如此,它需要电子的转移。
一个完整的电化学反应分两个半反应式,分别称为氧化半反应和还原半反应。
氧化半反应式: A → A+ + e-还原半反应式: B+ + e- → B这两个半反应式通过电子转移而产生化学反应。
氧化半反应式是电子被剥离的一方,称为还原剂,还原半反应式是电子参与化学反应的一方,称为氧化剂。
还原剂和氧化剂组成氧化还原对。
电子是一种基本的负电荷物质,具有负电荷。
二、电化学反应热力学电化学反应的热力学包括了内能、熵、焓、自由能等概念。
自由能是化学反应是否能够自发进行的重要标准,它可以通过以下公式求出:∆G=∆H-T∆S式中:∆G是自由能变化;∆H是焓变化;∆S是熵变化;T是温度。
当∆G<0时,化学反应可以自发进行;当∆G=0时,反应处于平衡状态;当∆G>0时,反应不能自发进行。
三、电化学反应动力学电化学反应动力学主要研究电化学过程中的反应速率和化学动力学规律。
在电化学反应中,主要的影响因素有电极表面的物理化学状态、电化学反应的温度、电化学反应的电位等。
电极表面的物理化学状态是影响电化学反应速率的主要因素。
它可以通过电极的面积、形状、表面不纯物质的存在与否等因素来影响电化学反应速率。
温度对电化学反应速率也有较大的影响。
当温度升高时,电化学反应速率会增加;当温度降低时,反应速率会减慢。
因此,电化学反应的温度是要进行控制的。
电化学反应的电位对电化学反应速率也有较大的影响。
电位是电化学反应中实际电位和标准电位之间的差值。
当实际电位高于标准电位时,电化学反应速率会加快;当实际电位低于标准电位时,反应速率则会减慢。
四、电化学分析电化学分析是依靠电化学原理进行的分析和检测。

电化学基础知识点总结电化学是研究电流在电解液中的运动规律以及电化学反应的学科。
以下是电化学的基础知识点总结:1.电池:电池是电化学能转化为电能的装置。
常见的电池包括原电池和干电池。
原电池是由两种不同金属和电解质构成的,可以产生电流。
干电池是一种闭合系统,可以将化学能转化为电能,并提供给外部电路使用。
2.电解质:电解质是指在溶液中能够形成离子的化合物。
电解质可以是无机物如盐和酸,也可以是有机物如醇和酸。
电解质的溶解度和电导率与温度有关,通常在较高温度下更容易溶解和导电。
3.电极:电极是电化学反应发生的地方,分为阳极和阴极。
阳极是电子流从电池内部进入电解质的地方,阴极则是电流离开电解质进入电池的地方。
电极的选择取决于具体电化学反应的需求。
4.电势:电势是电极与标准氢电极之间的电压差,用来表示电化学系统的电力水平。
标准氢电极被定义为电势为0。
电势的单位是伏特(V)。
5.动力学:动力学研究电化学过程的速率和机理。
一个重要的概念是过电势,它是电极电位与平衡电位之间的差异。
过电势与反应速率成正比。
6.法拉第定律:法拉第定律描述了电解过程中的电荷传递与物质转化之间的关系。
根据法拉第定律,电流的大小与产生的产物的数量之间存在一定的关系。
7.电解:电解是指通过外加电压将离子溶解在电解液中进行电荷转移的过程。
阳极上的离子发生氧化反应,阴极上的离子发生还原反应。
8.电容:电容是指储存电荷的能力。
它是一个由两个导体之间的电介质隔开的装置。
电容的单位是法拉(F)。
9.电化学平衡:当电化学反应的正向和反向反应速率相等时,电化学平衡就达到了。
在电化学平衡时,没有电流通过电解池。
10.腐蚀:腐蚀是一种电化学过程,金属在与环境中的反应中失去电子。
腐蚀可以通过涂层和阴极保护等方法进行控制。
11.电解池:电解池是研究电化学过程的实验装置。
它由两个电极和一个电解液组成,电流在其中流动。
12.远离平衡条件:当电解电池的电流大于理论上的最大电流时,系统就远离了平衡条件。

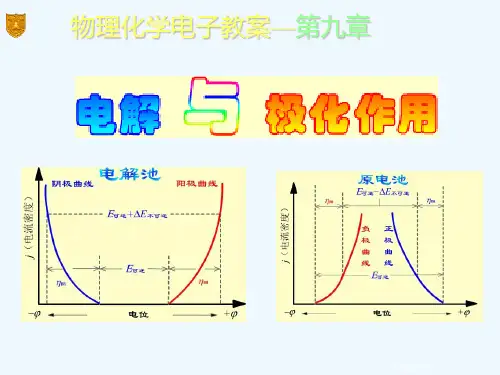
第九章 可逆电池本章用化学热力学的观点讨论电极反应的可逆行为。
原电池是将化学能转变为电能的装置,两个电极和电解质溶液是电池最重要的组成部分。
电极电势是本章主要概念之一,它是相对于标准氢电极而言的电势,是一种相对值,即把一个电极与标准氢电极组成一个已消除了液接电势的原电池,其电动势就是给定电极的标准电极电势。
对于一个可逆化学电池,电极两极间的电势差称电池的电动势,可用电池反应的能斯特方程计算。
因为电池电动势与热力学量之间密切相关,所以本章内容是围绕电动势而展开。
一、基本内容(一) m r G ∆=-zFE式中m r G ∆为电池反应的摩尔吉布斯自由能变;z 是电池反应的电子的物质的量;E 为电池的电动势。
此式运用于等温等压的可逆过程,所以E 为可逆电池的电动势。
此式表明,在可逆电池中,化学反应的化学能(m r G ∆)全部转变成了电能z FE 。
该式将化学反应的性质与电池的性质联系起来,是电化学的基本公式之一。
若参与电池反应的所有物质均处于各自的标准态,则上式成为θm r G ∆=-zFE $其中E $称为电池的标准电动势,对于指定的电池,E $只是温度的函数。
(二) 电池反应的能斯特公式若电池反应为 aA+bB =gG+hHE=E $-zF RT ㏑b Ba A h Hg G a a a a ⋅⋅ 此式表明,电池的电动势取决于参加反应的各物质的状态,它对如何改变电池电动势具有指导的意义,计算时首先要正确写出电池反应式。
(三) 电极反应的能斯特公式p m r TzFT zFE H )E(∂∂+-=∆若电极反应为 aA+bB+ze -=gG+hHE=E $-zF RT ㏑b Ba A hHg G a a a a ⋅⋅ 式中E 和E $分别为该电极的电极电势和标准电极电势。
此式表明,一个电极的电势取决于参与电极还原的各物质的状态。
计算的关键是要正确写出电极上的还原反应。
(四) E =负正E E -,E $=θθ负正E E -式中E 和E $分别为可逆电池的电动势和标准电动势;正E (θ正E )和负E (θ负E )分别为正极和负极的电极电势(标准电极电势)。



电化学基础知识总结电化学是研究电子和化学反应之间相互关系的学科领域。
它涉及到电解质溶液和电解质电池,以及与之相关的电化学反应和过程。
在电化学中,电子和离子在电极之间进行迁移,以产生电流和电势差。
以下是电化学的一些基础知识总结。
电解质是指在溶液中能够电离成离子的物质。
电解质溶液中的离子可以通过电迁移来产生电流。
电解质溶液中的阳离子和阴离子可以在电场的作用下相互移动,并沿着电场的方向迁移。
这个迁移过程被称为电动力学迁移。
电解质溶液中的离子迁移速度取决于离子的电荷和溶液中的电导率。
当两个电极与电解质溶液接触时,会形成一个电池。
电池中的两个电极分别被称为阳极和阴极。
阳极是电解质溶液中离子的氧化位置,而阴极是离子的还原位置。
当电流通过电池时,阴极会吸引阳离子,并将其还原为原子或分子形式。
同时,阳极会释放电子,促使阳离子氧化为正离子。
电极电势差是电极与标准电极(通常是氢电极)之间的电势差。
它提供了电池的能量转换情况的信息。
当电极电势差为正时,说明电化学反应是自发进行的,反之则需要外加能量才能进行反应。
电极反应是指在电极表面发生的化学反应。
在阳极上,氧化反应发生,而在阴极上,还原反应发生。
电化学反应可以通过电势差和滴定法来确定反应的进行方向和速率。
电解是指通过外加电势差将化学反应逆向进行。
通过电解,可以将阳极的物质还原为阴极的物质。
电解在工业生产中起着重要作用,例如金属电解精炼和水电解制氢。
电容是电池存储电荷的能力。
电荷在电容器中存储和释放,其大小取决于电容器的大小和材料的性质。
电容器的单位是法拉(F)。
电化学可以应用于多个领域,包括环境科学、材料科学、催化反应和电池技术。
例如,电化学还可用于清洁能源的转化和储存,如电池和燃料电池。
此外,电化学还可应用于传感器和电镀等技术中。
总之,电化学是一门研究电子和化学反应之间相互关系的学科。
它涉及电解质溶液中离子的迁移和电池中的电化学反应。
电化学在多个领域中有广泛的应用,包括能源转化和储存。

电化学知识点总结电化学是研究电能转化为化学能,或者化学能转化为电能的科学与技术。
它是电学和化学的交叉学科,广泛应用于电池、蓄电池、电解槽、电解质溶液、腐蚀等领域。
下面将介绍电化学的几个重要知识点。
第一个知识点是电化学电池。
电化学电池是电化学系统的核心。
电池分为两个电极,一个是阳极,一个是阴极。
在电化学电池中,阳极是发生氧化反应的电极,阴极是发生还原反应的电极。
当两个电极通过导电介质连接后,阳极上发生氧化反应,产生电子,并且在阴极上发生还原反应,消耗电子。
这样就形成了电池中的电流。
常见的电化学电池包括原电池、库仑电池、氢燃料电池等。
第二个知识点是电化学反应动力学。
电化学反应动力学是研究电化学反应速率的科学。
在电化学反应中,有两个重要的动力学参数,一个是电极电势,一个是交换电流密度。
电极电势是指电极与溶液之间的电势差,是衡量反应进行方向和程度的重要指标。
交换电流密度是指电极界面上电子从电极向溶液传输的电流密度,是反应速率的决定因素之一。
电化学反应动力学的研究对于揭示反应机制、优化反应条件具有重要意义。
第三个知识点是电化学电容器。
电化学电容器是利用电荷在电介质中的吸附和解吸附现象储存电能的装置。
常见的电化学电容器包括超级电容器和电化学锂离子电容器。
超级电容器具有高能量储存密度和高电荷-放电速率的特点,被广泛应用于电动车、电池管理系统等领域。
电化学锂离子电容器则利用锂离子在电极材料中的嵌入和脱嵌过程储存电能,具有高能量密度和长循环寿命的优点。
第四个知识点是电化学腐蚀。
电化学腐蚀是指金属在电解质溶液中遭受的腐蚀现象。
在电化学腐蚀中,金属表面存在阳极和阴极两个区域,阳极区发生氧化反应,金属离散为阳离子并且溶解入电解质溶液中,而阴极区发生还原反应,电子从电解质溶液传输到金属表面。
这样就形成了电流,产生腐蚀作用。
电化学腐蚀是金属材料破坏的主要原因之一,研究电化学腐蚀对于预防腐蚀具有重要意义。
以上就是电化学知识的一些重要点的简要总结。
电化学知识点思维导图高一电化学是物理化学的一个重要分支,主要研究电荷的流动和化学反应的关系。
在高一的学习中,电化学是一个必修的内容。
下面我们来探讨一下电化学这一知识点,并通过思维导图的形式,对电化学的基本概念、电化学反应、电化学电池等内容进行归纳总结。
一、电化学的基本概念电化学研究电荷的流动和化学反应的关系。
其中,电荷是指电子或离子。
电化学的基本概念包括电荷、电流、电势差、电解质和溶剂。
1. 电荷:电荷是物质所具有的一种物理特性,分为正电荷和负电荷。
正电荷的载体是离子,负电荷的载体是电子。
2. 电流:电流是电荷在单位时间内通过导体的数量,用I表示。
电流的单位是安培(A)。
3. 电势差:电势差是单位正电荷所具有的电势能差,用V表示。
电势差的单位是伏特(V)。
4. 电解质:电解质是在溶液中能够产生离子的化合物。
分为强电解质和弱电解质。
5. 溶剂:溶剂是用来溶解其他物质的介质。
在电化学中,常用水作为溶剂。
二、电化学反应电化学反应是指在电解质溶液中,通过外加电势差使电荷在电解质中自由移动,从而引发化学反应。
根据电解质溶液中氧化还原反应的特点,电化学反应分为两类:氧化反应和还原反应。
1. 氧化反应:氧化反应是指物质失去电子的反应,称为氧化剂。
氧化剂的特点是能接受电子,使物质的价态或氧化数增加。
2. 还原反应:还原反应是指物质获得电子的反应,称为还原剂。
还原剂的特点是能够捐赠电子,使物质的价态或氧化数减少。
三、电化学电池电化学电池是利用电化学反应的产生和流动的电荷来进行能量转化和储存的装置。
根据电池的工作原理和性质,电化学电池分为两类:原电池和电解池。
1. 原电池:原电池是利用化学反应直接产生电能的装置。
原电池包括电解质溶液、阳极和阴极。
著名的原电池有锌铜电池和铅酸电池等。
2. 电解池:电解池是利用电能来引发化学反应的装置。
电解池也包括电解质溶液、阳极和阴极。
在电解过程中,电荷从阳极流向阴极,引发物质的氧化还原反应。
电化学基础教程(第二版)版权页•内容提要•前言•第一版前言•第1章绪论•1.1 电化学简介•1.2 电化学的历史•1.3 电化学研究领域的发展•1.4 本书结构与学习方法•复习题•第2章导体和电化学体系•2.1 电学基础知识•2.2 两类导体的导电机理•2.3 电化学体系•2.4 法拉第定律•2.5 实际电化学装置的设计•复习题•第3章液态电解质与固态电解质•3.1 电解质溶液与离子水化•3.2 电解质溶液的活度•3.3 电解质溶液的电迁移•3.4 电解质溶液的扩散•3.5 电解质溶液的离子氛理论•3.6 无机固体电解质•3.7 聚合物电解质•3.8 熔盐电解质•复习题•第4章电化学热力学•4.1 相间电势与可逆电池•4.2 电极电势•4.3 液体接界电势•4.4 离子选择性电极•复习题•第5章双电层•5.1 双电层简介•5.2 双电层结构的研究方法•5.3 双电层结构模型的发展•5.4 有机活性物质在电极表面的吸附•复习题•第6章电化学动力学概论•6.1 电极的极化•6.2 不可逆电化学装置•6.3 电极过程与电极反应•6.4 电极过程的速率控制步骤•复习题•第7章电化学极化•7.1 电化学动力学理论基础•7.2 电极动力学的Butler-Volmer模型•7.3 单电子反应的电化学极化•7.4 多电子反应的电极动力学•7.5 电极反应机理的研究•7.6 分散层对电极反应速率的影响——ψ1效应•7.7 平衡电势与稳定电势•复习题•第8章浓度极化•8.1 液相传质•8.2 扩散与扩散层•8.3 稳态扩散传质规律•8.4 可逆电极反应的稳态浓度极化•8.5 电化学极化与浓度极化共存时的稳态动力学规律•8.6 流体动力学方法简介•8.7 电迁移对扩散层中液相传质的影响•8.8 表面转化步骤对电极过程的影响•复习题•第9章基本暂态测量方法与极谱法•9.1 电势阶跃法•9.2 电流阶跃法•9.3 循环伏安法•9.4 电化学阻抗谱•9.5 滴汞电极与极谱法•复习题•第10章实际电极过程•10.1 电催化概述•10.2 氢电极过程•10.3 氧电极过程•10.4 金属阴极过程•10.5 金属阳极过程•复习题•附录标准电极电势表(298.15K,101.325kPa)•习题答案•参考文献•符号表。