九年级化学物质转化关系图
- 格式:doc
- 大小:68.00 KB
- 文档页数:2

初中化学三角转化关系
化学三角转化是指将两种物质间的量之间的关系转换成另外一种物质间的量之间的关系。
常见的化学三角转化关系包括:1. 质量转摩尔:将物质的质量转换为摩尔数,使用的转换因子是物质的摩尔质量(单位为 g/mol)。
2. 摩尔转质量:将物质的摩尔数转换为质量,使用的转换因子是物质的摩尔质量。
3. 体积转摩尔:将气体的体积转换为摩尔数,使用的转换因子是标准摩尔体积。
4. 摩尔转体积:将气体的摩尔数转换为体积,使用的转换因子是标准摩尔体积。
5. 物质间的摩尔比:对于反应中的不同物质,可以通过化学方程式中的摩尔系数来确定它们之间的摩尔比关系。
通过掌握这些化学三角转化关系,可以在不同的计算中进行转换,便于进行化学反应的计算和分析。
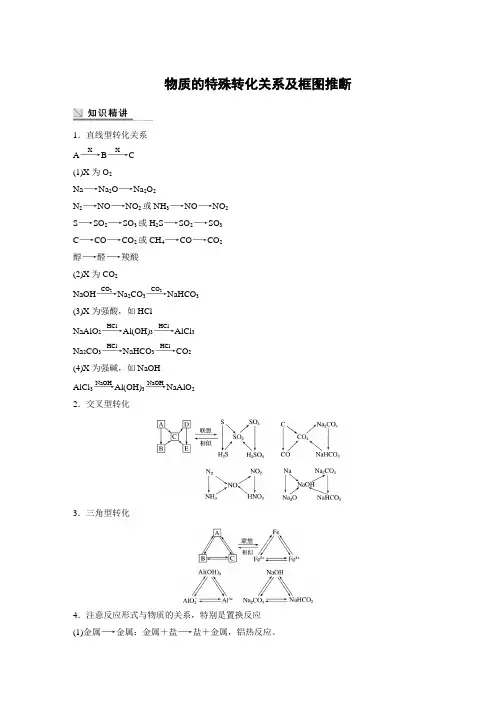
物质的特殊转化关系及框图推断1.直线型转化关系 A ――→XB ――→XC (1)X 为O 2Na ―→Na 2O ―→Na 2O 2N 2―→NO ―→NO 2或NH 3―→NO ―→NO 2 S ―→SO 2―→SO 3或H 2S ―→SO 2―→SO 3 C ―→CO ―→CO 2或CH 4―→CO ―→CO 2 醇―→醛―→羧酸 (2)X 为CO 2NaOH ――→CO 2Na 2CO 3――→CO 2NaHCO 3 (3)X 为强酸,如HClNaAlO 2――→HClAl(OH)3――→HClAlCl 3 Na 2CO 3――→HClNaHCO 3――→HClCO 2 (4)X 为强碱,如NaOH AlCl 3――→NaOHAl(OH)3――→NaOHNaAlO 2 2.交叉型转化3.三角型转化4.注意反应形式与物质的关系,特别是置换反应 (1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H 2O(或H +)―→H 2,2Mg +CO 2=====点燃2MgO +C 。
(3)非金属―→非金属:2F 2+2H 2O===4HF +O 2,2C +SiO 2=====高温Si +2CO ↑,C +H 2O(g)=====高温CO +H 2,X 2+H 2S===2HX +S ↓。
(4)非金属―→金属,用H 2、C 冶炼金属。
通过反应形式梳理化学反应,培养归纳、整理的能力。
5.抓住化学反应与反应条件的关系多数化学反应需要一定条件,条件不同化学反应也不同。
(1)“催化剂”,无机化学反应需要的催化剂不同,但是根据“催化剂”这一条件,可将氯酸钾分解、双氧水分解、工业合成氨、SO 2催化氧化、氨催化氧化联系起来,形成知识链。
(2)“通电”或“电解”,可以锁定在电解水、氯化钠、氯化镁、氯化铜、硫酸铜、硝酸盐等溶液,熔融氯化钠和氧化铝范围内。
(3)“高温”,常见的有碳酸钙分解、SiO 2和C 的置换反应、制造普通玻璃的反应、铝热反应等。
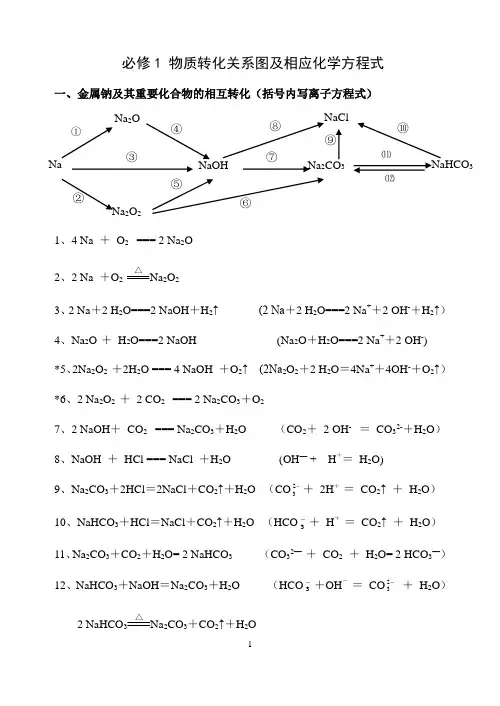
必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 23Na 2O 2 ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2点燃2HCl 2、2Na + Cl 2 点燃2NaCl3、Cu + Cl 2 点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。


一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡1 / 32 /3 ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻CaCO3Na2CO3CO2CO2NaOHNa2CO3CO2O2H2ONaOH NH4ClNH3⑼⑽⑾⑿3 / 3。


饱和溶液和不饱和溶液的概念①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液判断一种溶液是否是饱和溶液要注意:①在一定温度下。
②在一定量的溶剂里。
因为温度改变或溶剂量改变都会把饱和溶液变成不饱和溶液,也就是说饱和溶液与不饱和溶液在一定条件下可以互相转化,③被溶解的物质,即溶质能否继续溶解,若能继续溶解则为不饱和溶液,若不能继续溶解则为饱和溶液。
④某一种物质的饱和溶液是对该物质而言,但对其他物质则不是饱和溶液。
如20℃时,NaCl的饱和溶液不能再溶解NaCl了,但还能继续溶解KNO3,即此溶液对于NaCl来说是饱和溶液,但对KNO3来说则是不饱和溶液。
饱和溶液与不饱和溶液的相互转化方法:(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大饱和溶液不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少饱和石灰水不饱和石灰水概念的理解:(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。
因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。
如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:①饱和溶液不饱和溶液(或不饱和溶液饱和溶液。
不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小判断溶液是否饱和的方法:①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。

初中化学物质间的相互转化关系总结
一、物质分类
1、合成反应
合成反应是将两种或以上的原料物质或物质组合成一种新物质的化学反应。
如,饱和的氯气与水混合反应,会形成氯化氢:
Cl2+H2O→HCl+HClO。
2、分解反应
分解反应是将一种物质分解成两种或以上的物质,它的原料也是一种物质。
如,水解硫酸铵,会分解成硫酸和氨气:NH4HSO4→NH3+H2SO4
3、变性反应
变性反应在原料不变的情况下,对物质进行一系列的变化。
如,氧化反应是通过氧化剂对另一种物质进行氧化,从而产生一种新的物质。
如铁粉(氧化剂)+柠檬汁(被氧化物)→柠檬汁(氧化后)+Fe2O3
二、物质间的相互转化关系
1、氧、氢和水之间的相互转化
氧气与氢气的反应能够产生水,即2H2+O2=2H2O。
水可以通过电解反应分解成水分子的氢原子和氧原子,即2H2O=2H2+O2
2、碳和氧的相互转化
碳(C)与氧(O2)可以通过燃烧反应产生二氧化碳(CO2):
C+O2=CO2、二氧化碳能够通过光合作用被转化为有机物质,如糖:
CO2+H2O→C6H12O6+O2
3、硫化物和酸的相互转化
硫化物与酸可以通过熔融硫酸盐反应产生硫酸,如:
2Na2S+H2SO4→Na2SO4+2H2S。
硫酸可以由含硫的碱性物质中通过水解反应分解成硫化物,如:2NaHSO4→Na2S+H2SO4。

《酸、碱、盐、氧化物之间的相互转化》教案湛江市龙头中学陆智海2017.4.20一、教学目标:考纲解读:1.考点概况:酸、碱、盐、氧化物之间的相互转化2.命题把握:能力要求:能够利用复分解反应的发生条件判断酸、碱、盐、氧化物之间的反应。
命题角度:综合考查。
3.指点迷津:1).比较盐酸、硫酸的化学性质,归纳出.酸的通性。
2).比较氢氧化钠、氢氧化钙的化学性质,归纳出碱的通性。
3).比较碳酸钠、硫酸铜的性质,归纳出盐的化学性质。
4).通过比较,找出其组成与性质的不同,进一步加深理解,巩固和记忆所学的知识并学会运用知识的能力。
二、教学重点:1. .酸、碱的通性、盐的化学性质。
2. 复分解反应的发生条件。
3.酸、碱、盐、氧化物之间相互转化。
三、教学难点:酸、碱、盐、氧化物之间相互转化四、教学方法:讨论-归纳法自主合作探究法五、教学过程:(一)、自主学习:1.酸的通性:酸具有相似化学性质的原因是:由于不同的酸的水溶液里都含有相同的氢离子(H+)(1):酸与指示剂作用:使紫色石蕊试液变,无色酚酞试液 _ __色。
(2):酸溶液跟某些活泼的金属的反应,通常生成盐和氢气。
例:金属活动性顺序(要背熟)K 、Ca 、Na 、Mg 、Al 、Zn 、Fe 、Sn 、Pb 、(H)、Cu 、Hg 、Ag 、Pt 、Au 只有排在氢前面的金属,才能 (3):酸能跟某些金属氧化物(碱性氧化物)起反应,生成盐和水。
例: (4):酸能跟某些盐起反应,生成另一种酸和另一种盐 例: (5):酸能跟碱起中和反应反应,生成盐和水。
例:2.碱的通性:碱有相似化学性质原因: (1)碱溶液能使紫色石蕊试液变成 色,无色酚酞试液变成 色。
(2)碱和非金属氧化物(酸性氧化物)反应,生成Ca(OH)2+CO 2- 2NaOH+CO 2-2NaOH+SO 2-(3)碱和酸发生中和反应,生成 2NaOH+H 2SO 4- Ca(OH)2+2HNO 3-(4)碱与某些盐反应,生成注意:两种反应物必须是溶液,生成物必须要有一种是难溶的 如:2NaOH+CuSO 4- 3NaOH+FeCl 3- Ca(OH)2+Na 2CO 3- 3.盐的化学性质(1)盐和金属反应,一般生成 Zn +CuSO 4- Cu +Hg(NO 3)2- Cu +ZnSO 4-(不反应)反应条件:在金属活动性顺序表里,只有排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(补充说明:K Ca Na 等非常活泼金属除外)(强调:与H 的位置无关、铁的置换规律) 通式:金属+盐(溶液) 新金属+新盐(置换反应) [练习]:a :判断下列反应能否进行,若能,写出化学方程式,若不能,说明理由 Zn +AgNO 3- Ag +CuSO 4- Fe +CuCl 2- Fe +AgCl - Mg +ZnSO 4- Mg +ZnCO 3-b :A 、B 能与稀硫酸反应生成氢气,C 、D 不能,C 不能把D 从其溶液中置换出来,又知A +BCl 2=B +ACl 2,则ABCD 四种金属的活动性顺序为 (2):.盐和酸反应,一般生成 [练习]:书写化学方程式BaCl 2+H 2SO 4- AgCl +HCl —(不反应) MgCO 3+HCl - Na 2CO 3+H 2SO 4- CaCO 3+HNO 3- ZnCO 3+HNO 3-AgCl +HNO 3- (不反应) BaSO 4+HCl -(不反应) 通式:酸+盐 新酸+新盐(复分解反应)(3).盐和碱反应,一般生成 Na 2CO 3+Ca(OH)2= (湿法制碱)CuSO 4+2NaOH = (有蓝色沉淀生成) 通式:碱+盐 新碱+新盐(复分解反应)注意条件:反应物均可溶 生成物至少一种不溶[练习]:K 2CO 3+Ba(OH)2- Cu(OH)2+FeCl 3- Mg(NO 3)2+KOH - ZnCO 3+NaOH -(4).盐和另一种盐反应,一般生成2AgNO 3+BaCl 2- Na 2SO 4+BaCl 2-Na 2CO 3+CaCl 2- KNO 3+NaCl -(不反应) 通式:盐a +盐b 新盐c +新盐d (复分解反应) 条件:反应物均可溶,生成物至少一种不溶。
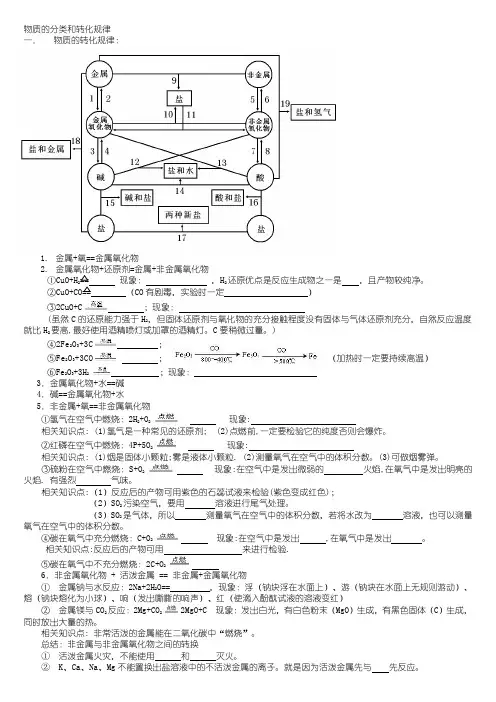
物质的分类和转化规律一.物质的转化规律:1.金属+氧==金属氧化物2.金属氧化物+还原剂=金属+非金属氧化物①CuO+H2== 现象:,H2还原优点是反应生成物之一是,且产物较纯净。
②CuO+CO== (CO有剧毒,实验时一定)③2CuO+C;现象:(虽然C的还原能力强于H2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H2要高,最好使用酒精喷灯或加罩的酒精灯。
C要稍微过量。
)④2Fe2O3+3C;⑤Fe2O3+3CO;(加热时一定要持续高温)⑥Fe2O3+3H2 ;现象:3.金属氧化物+水==碱4.碱==金属氧化物+水5.非金属+氧==非金属氧化物①氢气在空气中燃烧:2H2+O2现象:相关知识点: (1)氢气是一种常见的还原剂; (2)点燃前,一定要检验它的纯度否则会爆炸。
②红磷在空气中燃烧:4P+5O2现象:相关知识点: (1)烟是固体小颗粒;雾是液体小颗粒. (2)测量氧气在空气中的体积分数。
(3)可做烟雾弹。
③硫粉在空气中燃烧: S+O2现象:在空气中是发出微弱的火焰,在氧气中是发出明亮的火焰. 有强烈气味。
相关知识点:(1)反应后的产物可用紫色的石蕊试液来检验(紫色变成红色);(2)SO2污染空气,要用溶液进行尾气处理。
(3)SO2是气体,所以测量氧气在空气中的体积分数,若将水改为溶液,也可以测量氧气在空气中的体积分数。
④碳在氧气中充分燃烧:C+O2现象:在空气中是发出 ,在氧气中是发出。
相关知识点:反应后的产物可用来进行检验.⑤碳在氧气中不充分燃烧:2C+O26.非金属氧化物 + 活泼金属 == 非金属+金属氧化物①金属钠与水反应:2Na+2H2O== ,现象:浮(钠块浮在水面上)、游(钠块在水面上无规则游动)、熔(钠块熔化为小球)、响(发出嘶嘶的响声)、红(使滴入酚酞试液的溶液变红)②金属镁与CO2反应:2Mg+CO22MgO+C 现象:发出白光,有白色粉末(MgO)生成,有黑色固体(C)生成,同时放出大量的热。
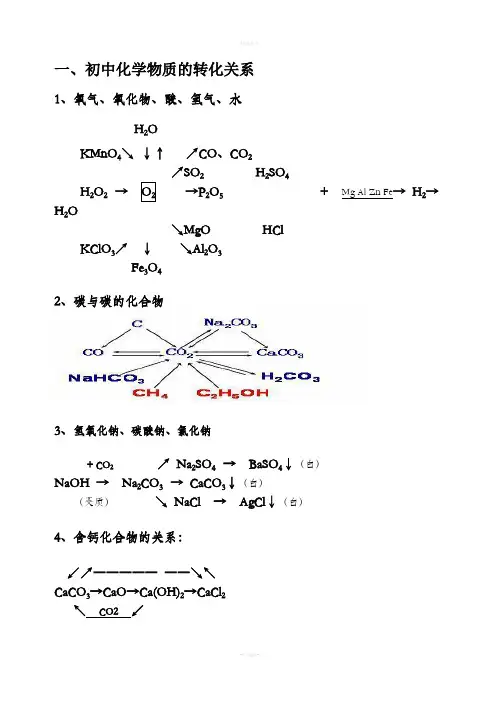
[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系盐和金属金属非金属碱性氧化物酸性氧化物碱酸盐盐盐(无氧酸盐)盐(含氧酸盐)盐和水碱和盐酸和盐两种新盐盐和氢气+酸+碱(16)(1)+O2(7)(17)+O2(4)(17)(8)(2)+H2O-H2O(3)(11)(12)(5)+H2O-H2O(6)(15)(9)(14)(13)(10)物、酸、碱、盐五大类,但对于书写化学方程式来说,将物质分为七类更好:金属、非金属、碱性氧化物、酸性氧化物、酸、碱、盐。
一般把它叫做“八圈图”(如上图)。
物质间的相互关系也是物质间的反应规律,必须牢牢掌握!2.发掘“八圈图”的内涵。
⑴表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;⑵表示15个基本反应规律(9条连线和6个箭头);⑶表示物质的性质(除了跟指示剂反应这一性质在图中无法表示外,图中酸没有打箭头的4根线表示的是酸的性质,其余类推!);⑷表示物质(特别是盐)的制法;15个反应中至少有10个与盐有关,俗称“十大成盐”规律!3.使用“八圈图”的注意事项。
⑴各类物质的相互关系图并非无所不含,有以下一些规律未能体现:H2、C、CO还原CuO或Fe2O3;CuSO4转化为胆矾晶体;碳酸(氢)盐的分解;酸式盐与正盐的转换规律等。
⑵复分解反应规律的条件:可溶的反应物,能生成沉淀、气体或水。
⑶置换反应规律的条件:金属活动顺序强换弱。
判断金属与酸反应时:金属必须排在H前面;酸不可用硝酸、浓硫酸。
判断金属与盐反应时:必须同时满足“排在前面的金属;可溶性盐”。
例题:小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了下图所示的知识网络图。
铜及其化合物在工业上有重要的应用。
借助网络图回答:(1)写出用酸和碱生产硫酸铜的化学方程式:。
(2)请你把图中①②处补充完整,要求不能与图中已有信息重复。
中考知识点(四)——物质间的转化与推断一、初中化学物质间转化网络关系图1.以碳、氧元素为中心的各物质的转化C CH4CuOFe3O4(1) (2) (5) H2CO3 (23) (21) (20)(22)(6) (7)2(8) (9) (17)(10) (11) Na2CO3 (14) (15) (16)(18)CaCO3 H2O2 CO物质之间转化关系的化学方程式:(1)2C + O2点燃 2CO(2)C + O2点燃 CO2 C + 2CuO 高温 2Cu + CO2↑ 3C+2Fe2O高温4Fe+3CO2↑(3)2CO + O2点燃 2CO2 3CO+Fe2O高温2Fe+3CO2 CO + CuO △ Cu + CO2(4)CO2 + C 高温 2CO(5)CH4+ 2O2点燃 CO2+ 2H2O(6)CO2 + H2O = H2CO3(7)H2CO3 = H2O + CO2↑(8)CO2 + 2NaOH = Na2CO₃ + H2O(9)Na2CO3 + H2SO4 = Na2SO4 + H₂O + CO₂↑ Na2CO3 + 2HCl = 2NaCl + H₂O + CO₂↑(10)CaCO3 + 2HCl = CaCl₂ + H₂O + CO₂↑ CaCO3 高温CaO + CO2↑(11)CO2 + Ca(OH)2 = CaCO3↓+ 2H2O(12)2H2O通电2H2↑+ O2↑(13)2H2 + O2点燃 2H2O 3H2 + Fe2O3高温 2Fe + 3H2O H2 + CuO 加热 Cu + H2O(14)2H2O2 MnO2 2H2O + O2↑(15)2H2O2 MnO2 2H2O + O2↑(16)O2 + 2C 点燃 2CO(17)CO 2 + C 高温 2CO(18)2CO + O 2 点燃 2CO 2(19)O 2 + C 点燃 CO 2(20)2O 2 + 3Fe 点燃 Fe 3O 4(21)O 2 + 2Cu △ 2CuO(22)Fe 2O 3 + 3CO 高温 2Fe + 3CO 2(23)CuO + H 2 加热 Cu + H 2O CuO + H 2SO 4 = CuSO 4 + H 2O2.以钙、铁元素为中心的各物质的转化CaCO 3 FeCl 3 Fe 3O 4(1) (2) (3) (14) (13) (12) (7) CaCl ₂ (6) CaO Fe(OH)FeCl 2(5) (4) (15) (16) (11) (9) Ca(OH)2 FeSO 4物质之间转化关系的化学方程式:(1)CaCO 3 + 2HCl = CaCl ₂ + H ₂O + CO ₂↑(2)CaCl 2 + Na 2CO 3 = CaCO 3↓+ 2NaCl CaCl 2 + K 2CO 3 = CaCO 3↓+ 2KCl(3)CaCO 3 高温CaO + CO 2↑(4)CaO + H 2O = Ca(OH)2(5)Ca(OH)2 + 2HCl = CaCl 2 + 2H 2O Ca(OH)2 + MgCl 2 = Mg(OH)2↓+ CaCl 2(6)Ca(OH)2 +CO 2=CaCO ₃↓+ 2H 2O Ca(OH)2 + Na 2CO 3 = CaCO 3↓+ 2NaOH Ca(OH)2 + K 2CO 3= CaCO 3↓+ 2KOH(7)3Fe + 2O 2 点燃 Fe 3O 4(8)Fe + 2HCl = FeCl 2 + H 2↑ Fe + CuCl 2 = FeCl 2 + Cu(9)Fe + H 2SO 4 = FeSO 4 + H 2↑ Fe + CuSO 4 = FeSO 4 + Cu(10)Fe 2O 3 + 3CO 高温 2Fe + 3CO 2 Fe 2O 3 + 3H 2 高温 2Fe + 3H 2O(11)Fe 2O 3 + 3H 2SO 4 = Fe 2(SO 4)3 + 3H 2O(12)Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O(13)Fe(OH)3 + 3HCl = FeCl 3 + 3H 2O(14)FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl 2FeCl 3 + 3Ca(OH)2 = 2Fe(OH)3↓+ 3CaCl 2(15)2Fe(OH)3 + 3H 2SO 4 = Fe 2(SO 4)3 + 6H 2O(16)Fe 2(SO 4)3 + 6NaOH = 2Fe(OH)3↓+ 3Na 2SO 4 Fe 2(SO 4)3 + 3Ca(OH)2 = 2Fe(OH)3↓+3CaSO 43.以酸和碱为中心的知识网络酸碱指示剂CO2(2) (3) (4) (6) (7)Fe2O3 NaOH Na2CO3 H2SO4物质之间反应的化学方程式:(1)Fe + 2HCl = FeCl2 + H2↑(2)Fe2O3 + 6HCl = 2FeCl3 + 3H2O(3)HCl + NaOH = NaCl + H₂O(4)2HCl + Na2CO3 = 2NaCl + H₂O + CO₂↑(5)2HCl + Ca(OH)2 = CaCl2 + 2H2O(6)Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH(7)H2SO4 + Ca(OH)2 = CaSO4+ 2H2O(8)Ca(OH)2 + CO2 = CaCO3↓ + 2H2O4.以几种盐为中心的各物质的转化4 FeSO4物质之间转化关系的化学方程式:(1)CaCO3 + 2HCl = CaCl₂ + H₂O + CO₂↑ CaCO3 高温CaO + CO2↑(2)Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH (3)Na2CO3 + 2HCl= 2NaCl + H₂O + CO₂↑ Na2CO3 + H2SO4 = Na2SO4 + H₂O + CO₂↑(4)Na2CO3 + 2HCl= 2NaCl + H₂O + CO₂↑ Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl(5)NaCl+ AgNO3 = AgCl↓ + NaNO3(6)AgNO3 + NaCl = AgCl↓ + NaNO3 AgNO3 + HCl = AgCl↓ + HNO3(7)BaCl2+ 2AgNO3 = 2AgCl↓ + Ba(NO3)2(8)BaCl2 + H2SO4 = BaSO4↓ + 2HCl BaCl2 + Na2SO4 =BaSO4↓ + 2NaCl(9)CuSO4 + Ba(OH)2 = Cu(OH)2↓+ BaSO4↓ CuSO4 + BaCl2 = CuCl2 + BaSO4↓(10)CuSO4 + Fe = FeSO4 + Cu(11)CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4 CuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4二、推断突破口1.物质的颜色(1)固体物质的颜色白色固体:无水CuSO4、Mg0、P2O5、Ca0、Ca(OH)2、NaOH、 NaCl、Na2CO3等红色固体:Cu、Fe2O3等暗红色固体:红磷等绿色固体:Cu2(OH)2C03等淡黄色固体:S等黑色固体:C(木炭粉)、Cu0、MnO2、Fe3O4、Fe(粉)等紫黑色固体:KMnO4等(2)沉淀的颜色(七种常见沉淀)白色:BaSO4、AgCl、CaCO3、BaCO3、Mg(OH)2蓝色:Cu(OH)2红褐色:Fe(OH)3(3)溶液的颜色蓝色溶液:含Cu2+的溶液,如CuSO4溶液黄色溶液:含Fe3+的溶液,如FeCl3溶液浅绿色溶液:含Fe2+的溶液,如FeSO4溶液紫色溶液:KMnO4溶液、紫色石蕊试液(4)火焰的颜色淡蓝色火焰:CH4、H2、S在空气中燃烧发出淡蓝色火焰蓝色火焰:C0在空气中燃烧发出蓝色火焰蓝紫色火焰:S在纯氧中燃烧发出蓝紫色火焰2.物质的气味(1)有刺激性气味的气体:HCl、SO2、NH3等(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)3.特殊反应条件(1)点燃:一般有O2参加反应(2)高温:主要有4个化学反应3CO+Fe2O高温2Fe+3CO2 CaCO3 高温CaO+CO2↑ CO2+C 高温 2CO C+2CuO高温2Cu+CO2↑(3)通电:主要有3个化学反应2H2O通电2H2↑+O2↑ 2Al2O通电4Al+3O2↑(4)催化剂:主要有2个反应2KCl + 3O2↑2H2O2 MnO22H2O+O2↑ 2KClO3MnO₂∆4.化学之最(1)地壳中含量最多的金属元素——铝(2)地壳中含量最多的非金属元素——氧(3)空气中含量最多的物质——氮气(4)最简单的有机物——CH4(5)相对分子质量最小的氧化物——水(6)相同条件下密度最小的气体——氢气(7)相对原子质量最小的原子——氢(8)组成化合物种类最多的元素——碳(9)日常生活中应用最广泛的金属——铁(10)最早使用的金属——铜5.反应的特征现象化学反应的特征现象有:“带火星的木条复燃”、“火星四射”、“澄清石灰水变浑浊”、“物质溶于水温度升高或降低”、“无水硫酸铜变蓝”等模拟预测1. A、B、C是三种初中阶段常见的三种物质,它们之间的反应及转化关系如图所示,(箭头表示转化,横线表示反应),已知B与另外两种物质的元素种类均不相同。
专题3 八圈图及物质的转化1一、单质、氧化物、酸、碱、盐的相互反应1、金属+氧气→碱性氧化物如:2、碱性氧化物+水→可溶性碱(不溶性碱除外)如:3、不容性碱→碱性氧化物(可溶性碱除外)+水如:4、酸+盐→盐+水5、非金属+ O2→酸性氧化物(H2燃烧、C不完全燃烧等除外)如:6、酸性氧化物+水→含氧酸(二氧化硅除外)如:7、含氧酸→酸性氧化物+水如:8、金属+非金属(除O2、H2外)→无氧酸盐如:9、碱性氧化物+酸性氧化物→含氧酸盐如:10、不容性盐→碱性氧化物+酸性氧化物如:11、盐1+盐2→盐3+盐412、碱性氧化物+酸→盐+水13、酸性氧化物+碱→盐+水14、酸+盐→新酸+新盐15、碱+盐→新碱+新盐16、金属+酸→盐+ H217、金属+盐溶液→新金属+新盐溶液1、一定条件下,下列物质的转化均可一步实现的是()A.CaCl2→CaCO3→Ca(OH)2 B. AgNO3→Fe(NO3)2→Zn(NO3)2C. NaNO3→NaOH→Na2CO3D. Fe2O3→FeSO4→Fe(OH)32、下列物质间的转化,在一定条件下均能一步实现的是①C→CO→CO2 ②Cu→CuO→CuSO4 ③Na2CO3→NaCl→NaNO3 ④CaCO3→CaO→Ca(OH)2 A.①②③B.①③④C.①②④ D.①②③④3、下列物之间的转化,能通过一步反应实现的是( )①C2H5OH→CO2②CaO→Ca(OH)2③H2O2→H2O④HNO3→HCl⑤Fe3O4→Fe A.①②③④ B.①②③⑤ C.①③④⑤ D.②③④⑤4、下列物质间的每一转化不能..都通过一步反应实现的是()A.CuO→Cu→CuO B.NaOH→H2O→NaOH C.O2→Fe3O4→O2D.Fe→FeCl2→Fe5、下列物质间的每一转化不能都通过一步反应实现的是()A.Ca→CaO→CaCl2B.NaOH→Na2CO3→NaClC.O2→CuO→Cu(OH)2D.C→CO2→Na2CO36、下列转化能一步完成的()① CH4→CO2 ②HNO3→HCl ③CaO→Ca(OH)2 ④Ba(OH)2→NaOH ⑤C→CuA.①③④⑤ B.②③④⑤ C.①②④⑤ D.①②③④7、下列转化能一步完成的是()①CaCO3→CO2②HCl→NaCl③CaO→Ca(OH)2④Ca(OH)2→NaOH⑤CuO→Cu.A.①②③④⑤B.②③④⑤C.①②④⑤D.①②③④8、下列转化能一步完成的是()①Ba(OH)2→NaOH②CuO→Cu(OH)2 ③HNO3→HCl④SO2→Na2SO3.A.①④ B.②③ C.③④ D.只有④9、下列物质之间的转化能够实现的是()10、下列物质间的转化关系正确的是()A.①②B.②③ C.①③ D.①②③【类型2】1、现有Fe、CuO、MgCl2、Ca(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.7个B.6个C.5个D.4个2、现有氧化铁、稀硫酸、氢氧化钠溶液、氯化钡溶液和碳酸钾溶液五种物质,在常温下它们两两相互发生的化学反应有()A.4个B.5个C.6个D.7个3、现有Zn、Fe2O3、MgCl2、Cu(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.3个B.4个C.5个D.6个4、对于化学反应X + Na2CO3 == 2Y+ CaCO3↓的分析错误的是()A.该反应属于复分解反应B.Y中一定含有钠元素C.X一定是熟石灰D.X中阴离子化合价是—1价5、对于复分解反应:X+2NaOH2Y+Cu(OH)2↓,下列分析中正确的是()A.X一定是CuCl2B.相对分子质量大小:X>Y C.Y可能是H2O D.Y可能是Na2SO4【类型3】1、下列各组变化中,每一转化在一定条件下均能一步实现的是()A.①和② B.②和③ C.①和③ D.①②③2、下列各组物质间通过一步反应就能实现如图所示的转化,则甲、乙、丙可能分别是()A.NaOH、NaCl、NaNO3B.CO、CO2、H2 CO3C.CaO、Ca(OH)2、CaCO3D.H2O2、H2O、O23、(2013•徐州一模)下列各组中物质间的转化不都是通过一步反应实现的是()4、下列各组物质间通过一步反应就能实现如右图转化,则甲、乙、丙可能是()A.KOH KCl KNO3B.CuO CuCl2Cu(OH)2C.C CO2COD.H2O2H2O O25、(2014·宿迁)下列物质的三角转化关系中都能按箭头方向一步实现的是( )A.① B.①② C.①②③ D.②③6、下列各组转化中,一定条件下均能一步实现的组合是()A.①②B.②③C.①③D.①②③专题3 八圈图及物质的转化2【类型3】7、下列有关说法正确的是( ) A .实现CO CO 2的相互转化,都只有一种途径B .Al 可以实现单质氧化物碱C .实现C CO 的转化,都利用了碳的可燃性D .实现H 2OO 2相互转化,化学反应的基本类型不同8、比较归纳是化学学习中常用的一种方法.以下是C 、CH 4、CO 三种物质转化为CO 2的转化关系,即:①C→CO 2②CH 4→CO 2③CO→CO 2,对它们的比较归纳正确的是( )A .三种转化发生的都是化合反应B .三种物质都只能跟氧气反应转化为二氧化碳C .三种物质都可以在点燃条件下转化为二氧化碳D .三种转化所有的生成物在常温下都是气体 9、(2014黄冈市)已知甲、乙、丙、丁是初中化学中的四种常见物质,丁是甲与乙、乙与丙反应的生成物之一(反应条件均已略去),转化关系如图:(1)常温下,若乙为红色粉末,甲为黑色粉末,则丙的化学式是______,甲与乙反应的化学方程式为______。
一、初中化学物质的转化关系
1、氧气、氧化物、酸、氢气、水
H2O
KMnO
4
↘↓↑↗CO、CO
2
↗SO
2
H
2
SO
4
H
2
O
2
→O2→P2O5 + Mg Al Zn Fe→ H2→H2O
↘MgO HCl
KClO
3
↗↓↘Al
2
O
3
Fe
3
O
4
2、碳与碳的化合物
3、氢氧化钠、碳酸钠、氯化钠
+ CO2↗ Na2SO4 → BaSO4↓(白)
NaOH → Na2CO3 → CaCO3↓(白)
(变质)↘ NaCl → AgCl↓(白)
4、含钙化合物的关系:
↙↗―――――――↘↖
CaCO3→CaO→Ca(OH)2→CaCl2
↖CO2↙
5、氧化钡、氢氧化钡与硫酸钡
↗BaCl2→ BaSO4↓(白)
BaO → Ba(OH)2↗
↘ + CuS O4
↘Cu(OH)2↓(蓝)
6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵
__________________________________________________
__________________________________________________
CuO ↗ CO 2
↙ ↘ Ca(HCO 3)2 → CaCO 3→CaO
CuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O
↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O
NaHCO 3 →CO 2 NH 4HCO 3 → H 2O
↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 3
7、铝、镁、锌、铁、铜及其化合物
↗ZnSO 4↖ ↗ AlCl 3↖
Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙
Fe Al
↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖
Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al
↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4
Fe(OH)3 Fe 2O 3 ←――――→ Fe ↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2
8、常见物质的相互转化关系(即注明必要的反应物、反应条件)
CO 2 CO C 或O 2 O 2 H 2O H 2O 2
Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2 CaCO 3 ⑸ ⑹ ⑺ ⑻ CaCO 3 Na 2CO 3 CO 2 CO 2 NaOH Na 2CO 3 CO 2 O 2 H 2O NaOH NH 4Cl
NH 3 ⑼ ⑽ ⑾ ⑿。