细胞培养工艺放大探讨
- 格式:pdf
- 大小:2.08 MB
- 文档页数:31

悬浮细胞培养生物反应器逐级放大工艺是在生物制药和细胞培养领域中常用的方法,用于将细胞培养从实验室规模逐步放大到工业规模。
这个过程涉及到从小规模培养转移到大规模培养,确保细胞的生长和产物的产量都能得到有效控制。
以下是悬浮细胞培养生物反应器逐级放大工艺的一般步骤:1.实验室规模培养:在实验室中进行小规模的悬浮细胞培养,通常使用培养皿、培养瓶或小型生物反应器。
这一阶段用于研究细胞的生长特性、代谢产物的积累情况等。
2.初级放大阶段:在初级放大阶段,将实验室规模的细胞培养扩大到中等规模。
通常使用一些中型生物反应器或小型的生产级反应器。
在这个阶段,需要验证细胞培养的可行性和控制策略的有效性。
3.中级放大阶段:在中级放大阶段,将初级放大的细胞培养再次扩大。
通常使用大型生产级反应器,以更接近实际的生产条件。
在这个阶段,需要进一步优化培养条件,确保细胞的生长和产物的产量稳定和可控。
4.工业规模培养:在工业规模培养阶段,将中级放大的细胞培养再次扩大,以满足大规模产量的需求。
通常使用大型生产反应器,可能需要更加严格的生产控制和监测。
在这个阶段,需要确保细胞培养的一致性和稳定性。
在整个逐级放大的过程中,需要注意以下关键点:1.培养条件优化:在每个阶段,需要优化培养条件,包括温度、pH、氧气供应、营养物质等,以确保细胞的最佳生长和产物的产量。
2.工艺验证:在放大过程中,需要进行工艺验证,确保从小规模到大规模的转移不会影响细胞的生长性能和产物的质量。
3.监测和控制:在大规模培养中,需要建立有效的监测和控制策略,以保持培养的稳定性和一致性。
悬浮细胞培养生物反应器逐级放大工艺是一个复杂的过程,需要综合考虑多个因素,以确保细胞培养的成功和产物的高产。

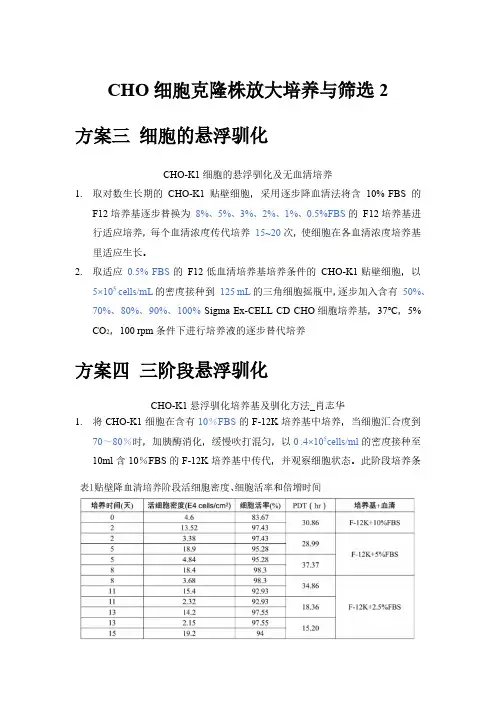
CHO细胞克隆株放大培养与筛选2方案三细胞的悬浮驯化CHO-K1细胞的悬浮驯化及无血清培养1.取对数生长期的CHO-K1贴壁细胞,采用逐步降血清法将含10% FBS的F12培养基逐步替换为8%、5%、3%、2%、1%、0.5%FBS的F12培养基进行适应培养,每个血清浓度传代培养15~20次,使细胞在各血清浓度培养基里适应生长。
2.取适应0.5% FBS的F12低血清培养基培养条件的CHO-K1贴壁细胞,以5×105 cells/mL的密度接种到125 mL的三角细胞摇瓶中,逐步加入含有50%、70%、80%、90%、100% Sigma Ex-CELL CD CHO细胞培养基,37℃,5% CO2,100 rpm条件下进行培养液的逐步替代培养方案四三阶段悬浮驯化CHO-K1悬浮驯化培养基及驯化方法_肖志华1.将CHO-K1细胞在含有10%FBS的F-12K培养基中培养,当细胞汇合度到70~80%时,加胰酶消化,缓慢吹打混匀,以0 .4×105cells/ml的密度接种至10ml含10%FBS的F-12K培养基中传代,并观察细胞状态。
此阶段培养条件为37℃,体积分数为8%CO2培养箱,静止培养。
当细胞汇合度到70~80%,加胰酶消化并以同样的密度接种至10ml含5%FBS的F-12K培养基中。
培养两代后,用同样的方法将血清逐步降低至2.5%,培养3代,随着血清含量降低,起初细胞生长变慢,待细胞轮廓清晰、伸展状态良好之后,开始下一步降血清处理,通常细胞适应2-3代后,在血清降至2.5%之前,细胞都可以很快地扩增。
(阶段Ⅰ)2.条件培养基(Condition Medium,CM)制备:细胞在含有2 .5%FBS的F-12K培养基2-3天后,收集培养上清200g离心5分钟后,用0 .22μm的无菌滤膜过滤后待用。
3.细胞在含有2 .5%FBS的F-12K培养基中培养3代,细胞汇合度到70~80%时,用PBS洗两遍,加入胰酶消化,消化30秒后弃去胰酶,待细胞消化变圆以后,加入完全培养基(含血清)终止消化。

生物工艺放大解决方案手册全文共四篇示例,供读者参考第一篇示例:生物工艺放大是一种利用生物体系和技术来生产和加工产品的方法,它可以将生物体系中的微生物、酶、细胞等生物元素应用于工业生产领域,以实现高效、环保、可持续发展的生产方式。
在实践过程中,生物工艺放大可能会遇到一些挑战和问题,需要一份全面的解决方案手册来指导实践者如何解决这些问题。
本文将详细介绍生物工艺放大解决方案手册的制作内容和使用方法,希望能够帮助广大科研工作者更好地应用生物工艺放大技术。
一、生物工艺放大概述生物工艺放大是一种将实验室规模的生物反应器或工艺放大到工业规模的方法。
它可以应用于环境保护、食品加工、医药生产等领域,具有重要的应用价值。
生物工艺放大的主要过程包括微生物的培养、酶的提取、细胞的分离等,这些步骤都需要严格控制条件和参数,以确保生产过程的稳定性和高效性。
二、生物工艺放大的挑战与问题在实践中,生物工艺放大可能会遇到一些挑战和问题,主要包括以下几个方面:1. 微生物的选择和培养:不同的微生物对培养条件有不同的要求,需要根据具体情况选择适合的微生物,并优化培养条件,确保微生物的生长和代谢功能。
2. 酶的提取和纯化:酶的提取和纯化是生物工艺放大中的关键步骤,但这一过程复杂且易受污染,需要严密监控每一个环节,确保酶的活性和纯度。
3. 细胞的分离和培养:在细胞工程领域,细胞的分离和培养是一个关键问题,需要开发高效的分离和培养技术,以满足不同应用领域对细胞的要求。
4. 生产工艺的优化:生产工艺的优化是生物工艺放大中的关键问题,需要通过试验设计和数据分析,找到最优的生产条件,提高产品的产量和质量。
5. 安全环保:生物工艺放大涉及生物体系,存在一定的安全隐患,需要加强安全管理和环境保护,确保生产过程的安全和可持续发展。
三、生物工艺放大解决方案手册的制作内容为了帮助实践者更好地应用生物工艺放大技术,制作一份全面的解决方案手册是必不可少的。
生物工艺放大解决方案手册的制作内容主要包括以下几个方面:1. 生物工艺放大基础知识:手册应包括生物工艺放大的基础知识,包括微生物的培养、酶的提取、细胞的分离等基本概念和原理,帮助读者更好地理解生物工艺放大的工作原理。


生物制药技术中的细胞培养与放大工艺优化策略细胞培养与放大是生物制药技术中至关重要的工艺环节,它涉及到细胞的生长、繁殖和产物的积累。
研究并优化细胞培养与放大工艺对于提高生物制药产品的质量和产量具有重要意义。
本文将探讨细胞培养与放大工艺中常见的优化策略,并介绍一些有效的方法和技术。
1. 细胞株的选择和改进细胞株的选择是优化细胞培养与放大工艺的关键步骤。
在生物制药中,常用的细胞株包括哺乳动物细胞、细菌和真菌等。
选择适合生产目的的细胞株是至关重要的,因为不同细胞株对培养条件的要求不同。
同时,通过基因工程技术改良细胞株,可以提高产物的表达水平和稳定性。
2. 培养基的优化培养基是支持细胞生长和产物积累的基础。
优化培养基中的营养物质、气体成分和pH值等因素,可以提高细胞生长速度和产物的质量。
此外,添加生长因子、激素或其他辅助物质,也可以促进细胞的增殖和产物的积累。
3. 培养条件的控制培养条件的控制对于细胞培养与放大的成功至关重要。
包括温度、湿度、气体浓度和混合速度等因素都会影响细胞的生长和产物的质量。
因此,通过精确控制这些参数,可以调节细胞的代谢活性和产物的积累,从而提高生物制药产品的质量和产量。
4. 搅拌和通气策略搅拌和通气是细胞培养过程中重要的工艺步骤。
适当的搅拌可以保持培养基的均匀性,防止细胞沉降和产物沉积。
而充足的通气则可以提供细胞所需的氧气和二氧化碳的排出。
通过优化搅拌和通气策略,可以提高细胞的生长速度和产物的积累。
5. 反式激活剂和代谢物调控生物制药产品的产物主要来源于细胞内的代谢途径。
通过添加适当的反式激活剂或调节代谢物的浓度,可以调控细胞的代谢途径和产物的积累。
这对于提高产品的纯度和产量非常重要。
6. 细胞的生长激素和应激蛋白调控细胞的生长激素和应激蛋白是调控细胞生长和代谢的重要因素。
通过添加适当的生长激素或应激蛋白,可以促进细胞的生长和产物的积累。
这些调节因子可以通过基因工程技术来引入细胞中,从而提高细胞的生长速度和产物的表达水平。


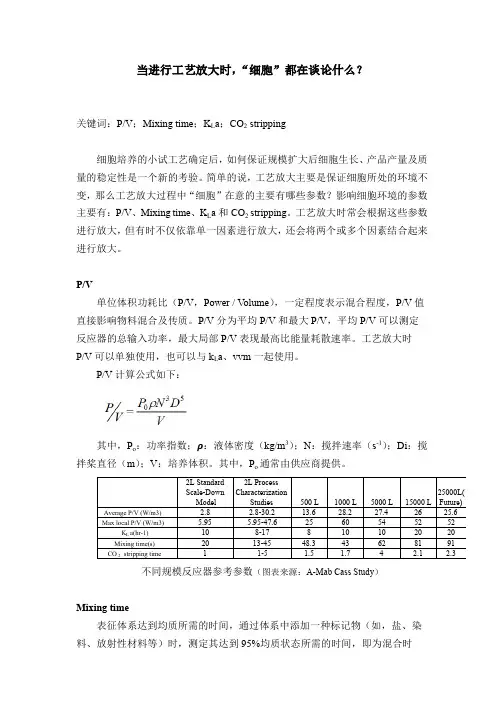
当进行工艺放大时,“细胞”都在谈论什么?关键词:P/V;Mixing time;K L a;CO2 stripping细胞培养的小试工艺确定后,如何保证规模扩大后细胞生长、产品产量及质量的稳定性是一个新的考验。
简单的说,工艺放大主要是保证细胞所处的环境不变,那么工艺放大过程中“细胞”在意的主要有哪些参数?影响细胞环境的参数主要有:P/V、Mixing time、K L a和CO2 stripping。
工艺放大时常会根据这些参数进行放大,但有时不仅依靠单一因素进行放大,还会将两个或多个因素结合起来进行放大。
P/V单位体积功耗比(P/V,Power / V olume),一定程度表示混合程度,P/V值直接影响物料混合及传质。
P/V分为平均P/V和最大P/V,平均P/V可以测定反应器的总输入功率,最大局部P/V表现最高比能量耗散速率。
工艺放大时P/V可以单独使用,也可以与k L a、vvm一起使用。
P/V计算公式如下:其中,P o:功率指数;ρ:液体密度(kg/m3);N:搅拌速率(s-1);Di:搅不同规模反应器参考参数(图表来源:A-Mab Cass Study)Mixing time表征体系达到均质所需的时间,通过体系中添加一种标记物(如,盐、染料、放射性材料等)时,测定其达到95%均质状态所需的时间,即为混合时间。
为使测量模型更适应于细胞培养环境,推荐使用NaOH作为标记物,测量过程中采用两个pH电极测两个不同点的pH值,pH安装及NaOH添加位置如下图。
电极安装及NaOH添加位置(图表来源:Scale-Up Analysis for a CHO Cell CultureProcessin Large-Scale Bioreactors)下面图A表示标记物NaOH添加后,通过pH(上面和下面的探头)的变化表示体系从均质变为非均质,再变为均质的过程。
图B为混合时间的计算方法,t=(t1+t2)/2。

基于多尺度参数相关分析的细胞培养过程优化与放大庄英萍;田锡炜;张嗣良【摘要】细胞大规模培养过程是活体细胞代谢的过程,因此存在着基因、细胞、反应器多尺度相关关系.通过对生物反应过程中生理代谢特性参数检测,并分析参数的理化相关和生物相关,可以实现多尺度观察与调控.主要介绍了在生物过程优化与放大研究中,整合分析与细胞生理代谢特性相关的参数变化信息以及反应器流场特性参数变化信息,从而实现微观与宏观相结合的过程优化方法以及细胞生理和反应器流场特性相结合的过程放大策略.【期刊名称】《生物产业技术》【年(卷),期】2018(000)001【总页数】7页(P49-55)【关键词】多尺度;参数相关分析;微观与宏观代谢;生理与流场特性;优化与放大【作者】庄英萍;田锡炜;张嗣良【作者单位】华东理工大学生物反应器工程国家重点实验室,上海 200237;华东理工大学生物反应器工程国家重点实验室,上海 200237;华东理工大学生物反应器工程国家重点实验室,上海 200237【正文语种】中文大规模细胞培养过程的对象,可以是微生物、动物、植物等各种细胞的培养过程,而通过细胞大规模培养过程可以得到细胞菌体、酶、初级或次级代谢产物、蛋白表达产物等产品,可以生产出人们所需要的医药、食品、化工、农业、能源等领域的各类用品,满足国民经济的发展需求。
尤其是在石油和煤炭资源即将耗竭之际,社会经济的主体将会从碳氢化合物(石油和煤炭)经济转变为碳水化合物(各类糖作为基础原料)经济,因此高效利用可再生资源,并解析细胞大规模培养过程中复杂生命代谢的主体——细胞生理代谢机理,最终实现细胞大规模培养过程的优化与放大、生产出低成本的各类产品已成为生物制造领域的主要研究内涵之一。
1 生物过程多尺度理论与装备细胞大规模培养的生物反应过程中,细胞生命代谢过程是一个复杂的系统过程:首先微生物菌种的基因决定了该代谢过程的基本特性,如顶头孢霉菌(Cephalosporium Acremonium)主要代谢产物是头孢菌素C,这就是基因尺度决定细胞代谢的基本特性;然而反应器的设计与操作条件差异又有可能改变细胞代谢的特性,同样是上述菌种的代谢过程,代谢调控策略(培养基配方、补料策略等)的变化,会引起最终目标产物产量的差异,这表明,细胞代谢特性除了受基因信息影响外,还会受到操作条件的影响;而反应器的不同结构会对物质传递造成很大的差异,最终也会导致代谢产物产量的差异。

CHO细胞克隆株放大培养与筛选3方案五悬浮细胞株的驯化方法悬浮细胞株及其驯化方法1.将对数生长期的细胞消化处理后,接种含有无血清培养基和含10%血清的完全培养基的第一混合液的T25方瓶中,第一混合液中的血清含量为 4.5%-5.5%,于温度37±0.5℃、湿度100%及5%CO2的条件下,传代培养1-3次。
在该步骤中,优选地,接种密度为1-5×10个/m1,接种体积为5±0.5m1,每两天传代1次,使细胞密度达1.2×106个/ml以上。
2.该步骤可以使待驯化的贴壁型细胞适应血清含量较低的无血清培养环境,以利于后续的摇瓶驯化培养过程。
3.将步骤(1)获得的细胞转移至含有无血清培养基和含10%血清的完全培养基的第二混合液的摇瓶中悬浮驯化培养,第二混合液中的血清含量为 3.0%-3.6%,于温度37±0.5℃、湿度100%及5%C02的条件下,采用半量换液的方法传代1-3次。
4.将步骤(3)获得的细胞转移至含有无血清培养基和含10%血清的完全培养基的第三混合液的摇瓶中悬浮驯化培养,第三混合液中的血清含量为 1.8%-2.2%,于温度37±0.5℃、湿度100%及5%CO2的条件下,采用半量换液的方法传代1-3次。
5.将步骤(4)获得的细胞转移至含有无血清培养基和含10%血清的完全培养基的第四混合液的摇瓶中悬浮驯化培养,第四混合液中的血清含量为0.8-1.2%,于温度37±0.5℃、湿度100%及5%CO2的条件下,采用半量换液的方法传代1-3次。
6.将步骤(5)获得的细胞转移至无血清培养基的摇瓶中悬浮驯化培养,于温度37±0.5℃、湿度100%及5%CO2的条件下,采用半量换液的方法传代1-3次,即得悬浮细胞株。
7.在本实施方式中,优选地,在步骤(3)至(6)中,传代培养的细胞的接种密度为3-10×105个/ml,培养体积为20±1.0ml,转速为110-140rpm,每两天传代1次。
细胞培养工艺的放大及规模缩小模型的建立作者:李晨奕来源:《健康前沿》2017年第10期摘要:本文以表达单克隆抗体的CHO细胞为研究对象,采用产物表达和产品质量均有一定保证的细胞流加培养工艺在2 L反应器和200 L反应器进行了放大和缩小的实施,建立了放大和缩小模型及策略,为稳定、可靠的生产单克隆抗体药物提供数据支持。
关键词:细胞培养;放大和缩小引言:抗体药物的大规模生产都是在大规模反应器上进行的,当前国内的反应器规模一般为200 L、500 L的中试规模,1000 L和5000 L的生产规模,而国外大规模生产的反应器达到了15000 L规模。
培养工艺的反应器放大,一直以来都是工业界具有挑战性的工作。
一方面,如何从小反应器放大至大型反应器在当今工业界仍是较为复杂和困难的。
据文献报道,大型反应器由于混合和传质效果下降会引起二氧化碳排除变差[1-3]、混合时间变长等现象[4],进而导致小规模反应器建立的培养工艺放大至生产规模时会出现细胞密度降低[5]、培养周期缩短、产量大幅下降[3]或者产物质量难以控制等一系列问题[6]。
对反应器工艺的放大提出了较大的挑战。
另一方面,近年来随着质量源于设计(Quality by Design,QbD)的理念[7]在生物制药领域的推广和应用[8],越来越多的企业开始在工艺的开发阶段应用QbD的理念。
因此如何稳定可靠的进行大规模生产,这就使得需要建立合适的规模缩小模型,并在规模缩小模型上对过程工艺参数进行研究,确定参数对CQA的影响,从而明确工艺参数的控制范围,对于大型反应器的稳定可靠的生产有着十分重要的意义。
1流加培养工艺的规模放大与缩小1.1操作参数的放大与缩小细胞培养过程参数可以分为两类:与体积相关的参数和与体积无关的参数。
其中pH、DO 和温度不随反应器尺寸发生变化,因此这些参数的在放大和缩小过程中保持一致即可。
而通气速率和攪拌转速则在放大过程中会发生变化。
随着反应器体积的变大,通气速率也一般呈直线上升的趋势。
细胞培养工艺表征的意义
细胞培养工艺表征的意义主要包括以下几个方面:
1. 优化培养条件:通过对细胞培养工艺的表征,可以确定关键参数,如培养基成分、培养温度、CO2 浓度等,从而优化培养条件,提高细胞生长和产物表达效率。
2. 确保产品质量一致性:对细胞培养工艺进行表征可以帮助建立过程控制策略,确保不同批次之间的产品质量一致性。
3. 提高生产效率:通过了解细胞培养过程中的关键因素,可以针对性地采取措施,提高生产效率,降低生产成本。
4. 满足法规要求:在生物制药等领域,详细的细胞培养工艺表征是法规要求的一部分,有助于确保产品的安全性和有效性。
5. 支持工艺放大和转移:表征细胞培养工艺有助于将实验室规模的培养条件转化为大规模生产的条件,并确保在不同场地之间进行工艺转移时的一致性。
6. 新工艺开发:细胞培养工艺表征可以为新工艺的开发提供基础数据,加速新产品的研发过程。
工艺放大策略及其在生物制药中的应用研究生物制药是利用生物技术制备的药品,具有较为明显的优势,例如高效、低副作用等。
生物制药的生产依赖于细胞培养技术和分离纯化技术。
在生物制药的规模化生产过程中,工艺放大是一个非常关键的步骤。
本文将介绍生物制药工艺放大策略的意义和方法,以及其在生物制药中的应用研究进展。
一、工艺放大策略的意义和方法工艺放大是将实验室规模的生产工艺放大到生产规模的过程。
工艺放大的目的是确定最佳的生产策略、制定合理的生产方案和判断工业化生产的可行性。
具体而言,可以通过工艺放大策略确定以下方面:1.最佳生长条件:通过评估培养细胞的生长性能,可以确定最佳的生长条件,例如培养基成分、麦角胺浓度等,以获得最好的细胞生长状态;2.合理的工艺参数:生产规模比实验室小很多,例如生产设备和培养罐的大小,因此需要确定最合理的工艺参数,例如通气量、培养罐搅拌速度等;3.最佳产量:生产规模是工艺放大的目标,因此需要确定最佳的产量和生产时间,以获得最高的产量和產品质量;4.分离纯化方法:最后需要确定最适合该產品的分离纯化方法,以保证产品的纯度和质量。
工業規模下的工藝放大通常需要改良原有的製程,也需要开发新的製程。
常用的方法包括利用统计学优化实验设计方法、响应面法和遗传算法等,这些技术可以最大限度地减少实验次数,并简化工艺放大过程。
二、工艺放大策略在生物制药中的应用研究生物制药是生物技术行业的一个重要部门,其产业化规模和水平越来越高,工艺放大策略在此领域中也越来越被重视。
在生物制药中,工艺放大的目的是将实验室生产培养方法和检测方法转化为产业化规模的生产和质量控制方法。
1.培养技术的工艺放大细胞培养技术是生物制药过程的关键步骤之一。
在细胞培养过程中,细胞的生长和分化状态受到众多参数的影响,例如培养温度、气体组成、培养基成分等。
科学合理地选择和控制这些参数,是成功实现细胞培养的关键。
因此,工艺放大通常是实现规模化细胞培养的关键步骤之一。
生物医学工程中的细胞培养技术与生产工艺优化生物医学工程是一门综合性学科,旨在将生物学、医学和工程学的原理与方法相结合,应用于生物医学领域的研究与应用中。
在生物医学工程中,细胞培养技术与生产工艺优化是非常重要的内容之一。
本文将就细胞培养技术与生产工艺优化展开讨论。
细胞培养技术是生物医学工程中的关键技术之一。
通过细胞培养技术,可以将不同类型的细胞在体外进行培养和增殖,以便进行疾病研究、新药研发和组织工程等方面的研究。
细胞培养技术的核心是培养基的调配和培养条件的控制。
合理的培养基配方和优化的培养条件可以促进细胞的生长和增殖,并确保其具有正常的形态和功能。
在细胞培养技术中,培养基的调配是一个关键的步骤。
培养基是提供细胞生长和增殖所需的营养物质和环境条件的培养液。
合理的培养基配方能够提供细胞所需的营养物质,并为其提供适宜的生长环境。
通常,培养基的配方包括基础培养基、生长因子、激素和其他辅助物质等。
根据不同类型的细胞,培养基的配方也会有所不同。
在实际操作中,需要根据所培养的细胞类型和需求进行调配和优化,以确保细胞可以稳定地生长和增殖。
除了培养基的调配外,培养条件的控制也是细胞培养技术中的重要环节。
细胞的生长和增殖需要适宜的培养条件,包括温度、湿度、气体组成和pH值等。
这些因素对细胞的形态和功能都具有重要影响。
为了获得较好的培养效果,需要在培养箱中设置适宜的温度和湿度,并定期更换和补充培养液。
同时,需要保持培养箱内的气体组成和pH值稳定,以维持细胞的正常生长和增殖。
在生物医学工程中,细胞培养技术的优化是提高生产效率和质量的重要手段之一。
通过合理优化细胞培养的生产工艺,可以获得更多的细胞产量,并提高产品的纯度和质量。
常见的优化手段包括细胞密度的控制、培养时间的调整和培养条件的优化等。
通过调控培养基中的营养物质浓度和补充周期,可以有效控制细胞密度和培养时间,从而提高细胞的产量。
另外,通过优化培养条件,如调控温度、湿度和气体组成等,可以改善细胞的生长环境,促进细胞的生长和增殖。
“工艺放大核心:上游细胞培养技术”Angelo DePalma博士 (节选)工艺放大趋势紧跟大型的生物制药生产技术的发展。
GE Healthcare Life Sciences细胞培养项目经理Christian Kaisermayer博士说,”工艺灵活性”和”完整解决方案”是最为显著的两个推动力。
这两个趋势的根本原因在于过去十年中细胞培养抗体表达量的提高和一次性生物生产技术。
一次性产品在工艺放大中发挥了显著的作用,即对于较小的一次性细胞培养容器的形状系数(例如GE Healthcare的WaveBioreactor™系统)可以与生产规模的设备相同,从而有利于scale-down的试验。
GE提供Wave系统可以配合四隔段培养袋用于细胞培养平行实验或筛选,每个小袋子隔段的工作体积范围从50到250 mL,每个小袋子隔段中的温度和顶部气体成分精密控制。
“几年前曾经发生的关于上游容量问题的激烈讨论将不会再发生” Kaisermayer博士说。
“相应的,当今开发的大多数产品几乎将永远不会看到10,000到20,000升的生物反应器。
因此灵活性成为工艺过程关注的焦点。
此外,在一次性和不锈钢反应器之间实现过渡的培养规模已经超过1,000升。
”今天的产品工程师们在从实验台到中试和生产规模的工艺设计的每个水平几乎都会考虑一次性生产技术。
与一次性生物生产技术有关的更快速的安装和更少的清洗和相关验证提高了设备的利用率-不仅对于最终的生产规模,而且也包括前期研发阶段。
“操作人员现在可以集中精力于他们的实验和工艺开发,而不是花时间在清洗和灭菌上,” Kaisermayer 博士解释说。
在整合和“完整解决方案”的主题上,GE Healthcare的ReadyToProcess™一次性产品系列覆盖了从培养基配制和细胞培养到蛋白质层析纯化以及下游膜过滤等单元操作。
客户可以从GE获得独立的或完整的一次性技术用于整体的无缝整合的工艺,甚至可以和GE的Enterprice Solution企业解决方案团队来合作进行工艺和厂房的设计、开发和执行整个即插即用的一次性生物生产设备方案。