高中化学备课参考 硅和二氧化硅的性质及用途
- 格式:docx
- 大小:43.48 KB
- 文档页数:3

考点13 硅和二氧化硅【考点定位】本考点考查硅和二氧化硅的性质与应用,明确二氧化硅是酸性氧化物,但能溶于HF酸的特殊性、硅的半导体性质及二氧化硅作光导纤维的应用。
【精确解读】1.硅的物理性质和化学性质:(1)物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体,它的结构类似金刚石,具有较高的沸点和熔点,硬度也很大,它的导电性介于导体和绝缘体之间,是良好的半导体材料.(2)化学性质:化学性质不活泼①常温下,除与氟气、氢氟酸及强碱溶液反应外,与其他物质不反应Si+2F2═SiF4、Si+4HF═SiF4↑+2H2↑、Si+2NaOH+H2O═Na2SiO3+2H2↑;②在加热条件下,能与氧气、氯气等少数非金属单质化合Si+O2△SiO2、Si+2Cl2△4;(4)制备:在电炉里用碳还原二氧化硅先制得粗硅SiO2+2C 高温Si+2CO↑,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅.有关的反应为:Si+2Cl2△SiCl4,SiCl4+2H2高温Si+4HCl;2.硅的用途:高纯硅可作半导体材料,制造集成电路、晶体管、硅整流器等半导体器件,还可以制造太阳能电池.硅的合金用途也很广,如含硅4%的钢具有良好的导磁性,可用来制造变压器的铁芯;含硅15%左右的钢具有良好的耐酸性,可用来制造耐酸设备.3.二氧化硅的物理性质和化学性质:(1)物理性质:无色透明或白色粉末,原子晶体,熔沸点都很高,坚硬难熔,不溶于水,天然的二氧化硅俗称硅石,是构成岩石的成分之一.(2)化学性质:常温下性质不活泼;①不与水反应,不能跟酸(氢氟酸除外)发生反应.SiO2+4HF═SiF4↑+2H2O(氢氟酸不能盛放在玻璃容器中);②具有酸性氧化物的性质,能跟碱性氧化物或强碱反应,SiO2+2NaOH═Na2SiO3+H2O (实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)CaO+SiO 2高温CaSiO 3、Na 2CO 3+SiO 2高温Na 2SiO 3+CO 2↑(制玻璃)③具有弱氧化性 SiO 2+2C高温Si+2CO↑、SiO 2+2Mg高温Si+2MgO↑,SiO 2+3C高温SiC(金刚砂)+2CO↑;(3)二氧化硅的用途:①光导纤维的主要原料;②石英的主要成分是SiO 2,纯净的石英可用来制造石英玻璃;③玛瑙石含有有色杂质的石英晶体,可用于制造精密仪器轴承,耐磨器皿和装饰品。

二氧化硅和硅主备:王胜菊学习目标:了解二氧化硅和硅的主要性质认识二氧化硅在生产、信息技术、材料科学等领域的应用1.二氧化硅的性质(1)物理性质:(2)化学性质:①具有弱氧化性:②具有酸性氧化物的通性:SiO2是一种,是H2SiO3的酸酐。
CaO+SiO2CaSiO3(炼铁中除炉渣)SiO2+2NaOH Na2SiO3+H2O(盛放碱性溶液的试剂瓶不能用玻璃塞,常用橡皮塞)③与某些盐的反应:Na2CO3+SiO2CaCO3+SiO2④特性:SiO2+4HF SiF4↑+2H2O(腐蚀玻璃)。
(3)SiO2和CO2的性质比较(4)二氧化硅的用途①SiO2是制造光导纤维的主要原料。
②石英制作石英玻璃、石英电子表、石英钟等。
③水晶常用来制造电子工业的重要部件、光学仪器、工艺品等。
④石英砂常用作制玻璃和建筑材料。
4、硅的工业制法及性质(1)工业制法:工业上用炭自在高温下还原二氧化硅的方法,制得含有少量杂质的粗硅。
将粗硅在高温下跟氯气气反应生成四氯化硅,四氯化硅经提纯后,再用氢气还原,就可以得到高纯度的硅。
操作流程:二氧化硅→粗硅→四氯化硅→精硅(2)物理性质:(3)化学性质:很稳定①常温下不与等反应。
②加热或高温时有强还原性:③常温下能与氟气(F2)、氢氟酸(HF)反应:。
达标检测:一.选择题(每小题有一个正确答案)1.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有()A.①②⑥B.全部C.①③④⑤D.②③⑥2.能贮存在具有玻璃塞的磨口试剂瓶里的试剂是()A.HF溶液B.KOH溶液C.盐酸D.水玻璃3.熔化烧碱应选用的坩埚是()A.铁坩埚B.玻璃坩埚C.石英坩埚D.陶瓷坩埚4.下列物质属于纯净物的是()A. 玻璃B.水玻璃C. 二氧化硅D. 大理石。

硅和二氧化硅一、硅硅元素在地壳中的含量占第二位,全部以化合态存在。
1、物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体,是半导体,具有较高的硬度和熔点。
2、化学性质硅的化学性质不活泼,在化学反应中主要表现还原性。
在常温下,只能与氟气、氢氟酸及强碱溶液反应;在加热条件下,能与氧气、氯气等少数非金属单质化合;在高温下才能跟氢气反应,表现弱氧化性,一般硅的氢化物只能用间接方法制得。
Si+O2SiO23、硅的制备⑴制粗硅粗硅是在电炉里用碳还原二氧化硅而制得SiO2+2C Si+2CO↑⑵制高纯硅将上面反应制出的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。
有关的反应方程式为;Si+2Cl2SiCl4SiCl4+2H2Si+4HCl4、硅的用途:硅可用来制作合金;高纯硅可作半导体材料。
二、二氧化硅1、物理性质:二氧化硅是一种坚硬难熔的固体,硬度、熔点都很高。
2、化学性质:二氧化硅的化学性质很稳定,不能跟水及酸(氢氟酸除外)发生反应。
由于它是一种酸性氧化物,所以能跟碱性氧化物或强碱反应。
SiO2+4HF=SiF4+2H2O(氢氟酸不能盛放在玻璃容器中)SiO2+CaO CaSiO3SiO2+2NaOH=Na2SiO3+H2O(碱溶液不能盛在使用磨口玻璃塞的试剂瓶中)3、特性:二氧化硅是一种特殊的酸性氧化物。
a.酸性氧化物大都能直接跟水化合生成酸,但二氧化硅却不能直接跟水化合,它的对应水化物(硅酸)只能用相应的可溶性硅酸盐跟酸作用制得。
b.酸性氧化物一般不跟酸作用,但二氧化硅却能跟氢氟酸起反应。
三、硅酸硅酸(H2SiO3)是不溶于水的弱酸,它的酸性比碳酸还弱。
四、硅酸盐1、硅酸盐的书写硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用氧化物的形式表示。
一般从左到右依次为:活泼金属的氧化物活泼非金属的氧化物水,各氧化物之间用小点“·”相连。
例如:硅酸钠Na2SiO3(Na2O·SiO2);镁橄榄石Mg2SiO4(2MgO·SiO2);高岭石A12(Si2O5)(OH)4(A12O3·2SiO2·2H2O)2、硅酸钠的水溶液俗称水玻璃,是一种矿物胶,可作粘合剂、防腐剂。

硅与二氧化硅教学设计实验一、实验目的本实验旨在通过对硅及其氧化物二氧化硅的研究,深入了解硅的性质、结构与应用。
通过实验,学生将能够掌握硅与二氧化硅的基本性质,了解其在工业生产与科学研究中的重要应用。
二、实验原理1. 硅的性质硅是一种化学元素,属于非金属元素,其化学符号为Si。
硅具有类似于碳的属性,是地壳中含量较多的元素之一。
硅的原子结构稳定,具有四个价电子,可以形成稳定的共价键。
2. 二氧化硅的产生与性质二氧化硅是硅的氧化物,化学式为SiO2。
二氧化硅可以通过将硅与氧气反应而生成,也可以从硅矿石中提取。
二氧化硅具有高熔点、低热导率和化学稳定性等特点,因此在高温、高压等条件下具有广泛的应用。
三、实验步骤1. 准备实验器材和保护用具,包括试管、试剂瓶、燃烧器、安全眼镜、手套等。
2. 将一定量的硅片加入试管中,用燃烧器对硅片进行加热。
3. 观察硅片的变化,记录其颜色、形状、质地等性质变化。
4. 将加热后的试管中产生的气体通入蒸馏水中,观察气泡并收集生成的气体。
5. 将得到的气体与酸性溶液反应,观察化学反应现象并记录。
6. 将产生的气体通入石灰水中,观察气泡并记录。
四、实验结果与分析1. 硅片经过加热后会发生明显的变化,颜色由淡红色逐渐转变为灰白色,形状由片状变成颗粒状。
2. 管中产生的气体为二氧化硅(SiO2),通过通入酸性溶液的反应可进一步证明其为二氧化硅。
五、实验讨论通过本实验,我们可以看到硅在高温条件下发生氧化反应,生成二氧化硅。
这一实验结果可以进一步验证硅的性质和化学反应。
二氧化硅是一种重要的无机材料,在工业生产和科学研究中具有广泛的应用。
例如,在玻璃制造过程中,二氧化硅是不可或缺的原料。
此外,二氧化硅还可用于制备高纯度硅材料、光学材料和电子器件等。
因此,通过对硅与二氧化硅的实验研究,可以深入了解其性质及应用。
六、实验总结通过本次实验,我们对硅与二氧化硅有了更深入的了解。
硅是一种非金属元素,具有类似于碳的属性。

第七章碳族元素无机非金属材料第二节硅和二氧化硅知识目标:1、熟练掌握硅和二氧化硅的化学性质;2、了解硅和二氧化硅的特性及用途。
能力目标:培养学生的思考、判断能力。
美育目标:插图以及书前彩图的运用,新科技知识的介绍,激发学生热爱科学,运用科学为人类创造美的渴望。
教学重点:硅和二氧化硅的化学性质。
教学难点:1、如何调动学生对较简单枯燥的元素及化合物知识的学习的兴趣。
2、根据所学碳以及元素周期律的知识,归纳出一些硅的化学性质。
师生活动设计:1、阅读教材第146页,并根据碳单质和二氧化硅的性质,归纳出硅及二氧化硅的性质,找出特殊性。
2、阅读教材第146-147页内容归纳硅、二氧化硅的用途,硅酸盐用氧化物形式书写的方法。
3、练习巩固。
〖引言〗上节课我们系统地介绍了碳族元素的结构特点及性质递变规律,本节课我们重点学习碳族元素中硅及其化合物二氧化硅的有关知识。
〖板书〗一、硅〖引导〗阅读P145的第一、二自然段,总结出硅的存在形态、结构特点、物性等方面内容,完成相应内容。
引1:硅在地壳中含量仅次于氧,居第二位。
在自然界中,只有以化合态存在的硅。
这些化合态的硅广泛存在于地壳的各种矿物和岩石里。
硅有晶体硅和无定形硅两种同素异形体。
晶体硅是灰黑色、有金属光泽、硬而脆的固体,熔点和沸点都很高,硬度也很大。
它的导电性介于导体和绝缘体之间,是良好的半导体材料。
〖板书〗1、分布与存在:只以化合态存在,分布广泛含量仅次于氧。
2、物理性质:熔沸点高,硬度大,半导体。
引2根据所学的碳以及元素周期律的知识,归纳出一些硅的化学性质。
完成相应内容。
硅的许多化学性质跟碳相似。
在常温下,硅的化学性质不活泼,只与氟气、氢氟酸和强碱起反应。
在加热条件下,硅能跟一些非金属反应。
Si+ F2 = Si+ HF =Si+ NaOH= Si+O2〖讲解〗硅元素原子的最外电子层的电子数目与碳元素原子的最外电子层中的电子数目相同,都有4个电子,所以,硅的许多化学性质跟碳相似。


硅和二氧化硅的性质及用途一、硅的性质及用途1.硅的物理性质和用途硅在地壳中含量居第二位,硅的存在只有化合态,无游离态.(1)单质硅包括晶体硅和无定形硅两种同素异形体.(2)晶体硅是灰黑色、有金属光泽、硬而脆的固体,其结构类似于金刚石,熔点和沸点都很高,硬度也很大,是良好的半导体材料.2.硅的化学性质(1)与非金属反应Si+O 2SiO 2242Si H SiH ∆+=(2)与强碱反应Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑实质:Si 为还原剂,且是Si 先H 2O 反应,然后生成的硅酸再与NaOH 反应,即氧化剂为H 2O.(3)与氢氟酸反应Si+4HF =SiF 4↑+2H 2↑Si 不与硫酸、硝酸反应.3.硅的工业制法制粗硅:SiO 2 + 2CSi + 2CO 制纯硅:Si + 2Cl 2 SiCl 4(液态),SiCl 4 + 2H 2 Si + 4HCl. 二、SiO 2的性质及用途1.物理性质二氧化硅广泛存在于自然界中,沙子、石英、水晶、硅藻土等的主要成分都是二氧化硅,二氧化硅熔沸点很高,硬度很大,不溶于水.2.化学性质(1)酸性氧化物SiO 2是酸性氧化物,是H 2SiO 3的酸酐,但不溶于水.SiO 2+CaO =高温CaSiO 3 高温 高温高温SiO 2+2NaOH = Na 2SiO 3 + H 2OSiO 2 + 4HF === SiF 4 + 2H 2O(2)弱氧化性SiO 2+2C =高温 Si + 2CO(3)与碱反应SiO 2+2NaOH =Na 2SiO 3+H 2ONa 2SiO 3是一中矿物胶,其水溶液俗名水玻璃,可用于制是一中矿物胶,其水溶液俗名水玻璃,可用于制H 2SiO 3Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓(3)与氢氟酸反应SiO 2+4HF =SiF 4↑+2H 2O (用于雕刻玻璃)(4)与碳酸盐反应SiO 2+CaCO 3 =高温CaSiO 3+CO 2↑3. 二氧化硅的用途(1)SiO 2是制造光导纤维的主要原料.(2)石英制作石英玻璃、石英电子表、石英钟等.(3)水晶常用来制造电子工业的重要部件、光学仪器、工艺品等.(4)石英砂常用作制玻璃和建筑材料.例1. 下列说法正确的是( )(A)硅材料广泛应用于光纤通讯(B)工艺师利用盐酸刻蚀石英制作艺术品(C)水晶项链和餐桌上的瓷盘都是硅酸盐制品(D)粗硅制备单晶硅不涉及氧化还原反应答案A解析:水晶即SiO2,不是硅酸盐.。

硅和二氧化硅是一种常见的无机化合物,具有广泛的应用领域。
下面将分别介绍硅和二氧化硅的应用。
一、硅的应用
半导体材料:硅是半导体材料的主要成分,广泛应用于电子工业中,如制造集成电路、太阳能电池等。
玻璃制造:硅是玻璃制造的主要原料之一,可以制造各种类型的玻璃,如平板玻璃、光纤等。
陶瓷材料:硅可以用于制造陶瓷材料,如高温陶瓷、电子陶瓷等。
化妆品:硅可以用于制造化妆品,如粉底、口红等,具有良好的润滑性和光泽度。
食品添加剂:硅可以用作食品添加剂,如防结剂、流动剂等,可以提高食品的质量和口感。
二、二氧化硅的应用
硅橡胶:二氧化硅可以用于制造硅橡胶,具有良好的耐高温性能和耐化学性能。
涂料:二氧化硅可以用于制造涂料,可以提高涂料的耐候性和耐磨性。
医药工业:二氧化硅可以用于制造药品,如制造胶囊、药片等,可以提高药品的稳定性和吸收性。
食品工业:二氧化硅可以用作食品添加剂,如防结剂、流动剂等,可以提高食品的质量和口感。
环保工业:二氧化硅可以用于净化废气和废水,可以去除有害物质和污染物。
总之,硅和二氧化硅是一种常见的无机化合物,具有广泛的应用领域。
硅可以用于制造半导体材料、玻璃、陶瓷材料、化妆品、食品添加剂等;二氧化硅可以用于制造硅橡胶、涂料、药品、食品添加剂、环保工业等。

高中化学二氧化硅和硅的用途
1、二氧化硅:
(1)它是常见的芯片制造材料,它可以用于制成集成电路和三极管;(2)二氧化硅也常用到电子元器件的制作,比如电阻元件的快速制造;(3)它也可以用来制作光学组件和激光器;
(4)还可以用来制作具有良好抗老化性能的防火材料、乳胶涂料和涂
层材料;
(5)它可以用于制作各种分子过滤器及其他生物技术设备;
(6)二氧化硅可以应用到安全装备的制造中,包括玻璃、复合材料等;(7)此外,它还可以用于制造电池、磁体等。
2、硅:
(1)硅常用于制造过滤器、电力设备,还可以制作像晶体管、滤波器
之类的电子器件;
(2)它可以用于航空航天领域,它是火箭发动机、导弹和衛星的绝缘
材料;
(3)硅还可以用于制造金属电池,铅酸蓄电池等;
(4)它可以用于陶瓷制造,陶瓷制品的着色、形成膜层等;
(5)硅也用于冥具的加工,医疗器械的制造;
(6)硅还有较高的耐热稳定性,它可以用来制作许多抗高温材料,比
如烤炉和热交换器;
(7)此外,硅还可用来制作植入物、芦苇椅等。

二氧化硅的用途:
自然界中存在的二氧化硅统称为硅石,有晶体和无定形两大类,石英晶体是结晶的二氧化硅,其中纯净透明的石英称为水晶,根据所含微量杂质不同而呈现不同的颜色,如紫色的紫水晶、褐色的烟水晶等,玛瑙和碧玉也都是含有杂质的石英,通常见到的沙子是含杂质比较多的石英:硅藻土是无定形的二氧化硅。
二氧化硅的用途比较多,常用于电子工业的重要部件、光学仪器和工艺品(水晶、玛瑙等),制作光导纤维(光缆),制作石英玻璃,石英砂常用于制作玻璃和建筑材料,硅藻土作催化剂载体和吸附剂。
硅的用途:
硅在地壳中的含量居第二位(仅次于氧),在自然界中无游离态的硅,它全部以化合态的形式(如二氧化硅、硅酸盐)广泛存在于地壳的各种矿物和岩石中。
硅的用途,高纯硅是良好的半导体材料,常用于制造集成电路、晶体管、太阳能电池等。
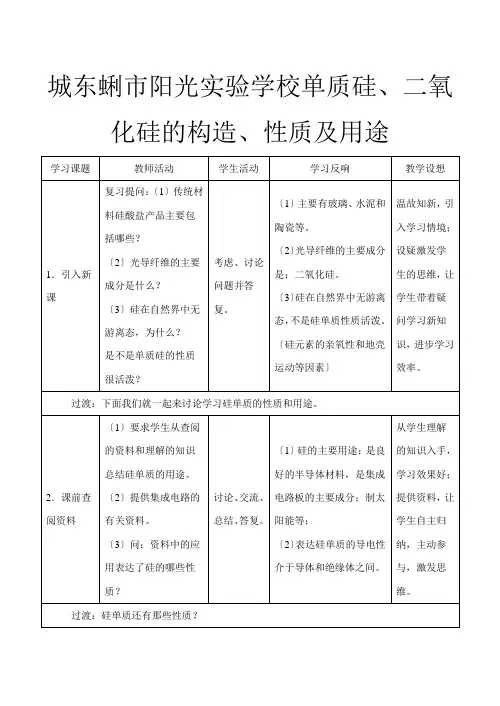
城东蜊市阳光实验学校单质硅、二氧化硅的构造、性质及用途
本课总结:这节课我们主要学习了硅单质和二氧化硅的构造和性质及用途,通过学习,我们理解到硅及
其化合物在社会开展和人类文明进步历程中充当了一个非常重要的角色,可以说目前全球信息的流通、电子工业的开展都离不开硅的;我们也相信随着科技的开展,它们还会为人类文明的进步发挥更多的作用,创造更多的奇迹。
希望同学们努力学习,掌握更多的科学知识,开发、研究硅这古老而又年轻的元素在更多方面的应用。
第16讲硅及其重要化合物【考纲要求】1、了解Si的特性及工业制法2、掌握SiO2的酸性氧化物的性质。
3、了解Na2SiO3弱酸盐的性质。
Si、SiO2、硅酸盐的用途。
【课前预习区】1.硅:(1)存在:在地壳里,硅的含量在所有元素中居第位,仅次于,全部以存在。
(2)物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体,它的结构类似于,熔沸点较高,是良好的材料。
2.二氧化硅(1)物理性质:二氧化硅是一种坚硬难熔的固体,硬度、熔点都很高。
天然的二氧化硅也叫。
石英、水晶、沙子主要成分是。
【课堂互动区】一、Si的性质和用途[问题组一]:1、根据硅元素在周期表中的位置,联系非金属的通性,思考硅单质有哪些化学性质?2、怎样制备粗硅?晶体硅有哪些用途?[归纳总结]1、化学性质:(1)非金属单质的通性(2)特性2、硅的制备:制粗硅:,3、硅的用途:硅可用来制作合金,如硅钢可制造变压器铁芯;高纯硅可作材料,广泛用于计算机的芯片、大规模集成电路;还可用于制造太阳能电池等。
[练习一]:1、常温下不能和单质硅反应的试剂是( )A. 氢氟酸B. 浓硝酸C. 氢氧化钾溶液D. 氟气2、某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )A.在自然界中只以化合态的形式存在B.单质常用作半导体材料和光导纤维C.最高价氧化物不与酸反应D.气态氢化物比甲烷稳定二、SiO2的性质和用途[问题组二]1、酸性氧化物有哪些通性?SiO2同样具有吗?2、从元素化合价角度SiO2还有哪些性质?3、用HF酸雕刻玻璃,其原理是什么?4、一般非金属氧化物与SiO2形成的晶体类型有何区别?[归纳总结]:1、化学性质:(1)酸性氧化物①SiO2+ H2O =②SiO2 + NaOH =③SiO2 + CaO =(2)氧化性SiO2 +C =(3)特性SiO2 +HF= SiO2 +Na2CO3 =2、二氧化硅的用途:二氧化硅是制造的主要原料,用于通讯、能量传输、信息处理、医疗器械等方面;石英用于制石英玻璃、石英电子表、石英钟等。
硅和二氧化硅的反应方式【原创实用版】目录1.硅和二氧化硅的化学性质2.硅和二氧化硅的反应条件3.硅和二氧化硅的反应过程4.硅和二氧化硅反应的产物5.硅和二氧化硅反应在实际应用中的意义正文硅和二氧化硅的反应方式硅和二氧化硅是两种重要的化学物质,它们在自然界中广泛存在,并在许多工业过程中发挥着重要作用。
然而,硅和二氧化硅之间的反应方式却并不为人所熟知。
本文将从硅和二氧化硅的化学性质、反应条件、反应过程以及反应产物等方面,详细地介绍硅和二氧化硅的反应方式。
首先,让我们来看一下硅和二氧化硅的化学性质。
硅是一种非金属元素,它在自然界中主要以化合物的形式存在,其中最常见的就是二氧化硅。
二氧化硅是一种无机化合物,它由硅和氧两种元素组成,化学式为 SiO2。
在自然界中,二氧化硅广泛存在于岩石、砂砾和土壤中,是地球上最常见的物质之一。
接下来,我们来看一下硅和二氧化硅的反应条件。
硅和二氧化硅在自然条件下是不反应的,因为硅的化学价为 0,而二氧化硅中硅的化学价为4,它们之间没有合适的反应条件。
然而,在特定的条件下,硅和二氧化硅是可以发生反应的。
例如,在高温下,硅和二氧化硅可以反应生成单质硅。
然后,我们来看一下硅和二氧化硅的反应过程。
在高温下,硅和二氧化硅反应生成单质硅的化学方程式为:SiO2 + 2C → Si + 2CO。
在这个反应过程中,木炭作为还原剂,将二氧化硅中的硅还原成单质硅。
最后,我们来看一下硅和二氧化硅反应的产物。
在硅和二氧化硅的反应中,主要的产物是单质硅。
单质硅是一种灰黑色的金属,它具有许多重要的化学性质,例如,它可以与氧气反应生成二氧化硅,也可以与碱反应生成硅酸盐。
总之,硅和二氧化硅的反应方式是通过高温下的还原反应实现的,主要产物是单质硅。
硅的用途和二氧化硅的用途高中化学
硅是一种非金属元素,化学符号为Si。
硅是地壳中第二丰富的元素,它广泛用于各种实际应用中。
以下是硅的一些主要用途:
-制造半导体器件:硅是制造半导体器件的重要原材料,如晶体管、太阳能电池等。
-制造玻璃:二氧化硅是制造玻璃的主要成分之一,硅酸盐制品也广泛应用于建筑、餐具等领域。
-制造陶瓷:硅质陶瓷具有良好的耐热、耐磨损性能,广泛应用于工业、建筑等领域。
-制造防火材料:硅酸盐材料具有很好的耐火性能,常被用于建筑、消防等领域。
-制造光纤:硅是制造光纤的重要原材料。
二氧化硅是硅的一种氧化物,化学式为SiO2,它也有着广泛的应用,以下是二氧化硅的一些主要用途:
-制造玻璃:二氧化硅是制造玻璃的主要成分之一。
-制造水泥:二氧化硅是水泥制造中的重要原材料之一。
-制造防腐剂:二氧化硅可以用于制造防腐剂,如木材防腐剂等。
-制造涂料:二氧化硅可以用于制造各种涂料,如颜料、油漆等。
-制造医用材料:二氧化硅可以用于制造医用材料,如人造骨、缝合
线等。
总之,硅和二氧化硅在工业、建筑、医疗等领域都有着广泛的应用,是人们生产和生活中不可或缺的重要原材料。
硅和二氧化硅的性质及用途
一、硅的性质及用途
1.硅的物理性质和用途
硅在地壳中含量居第二位,硅的存在只有化合态,无游离态.
(1)单质硅包括晶体硅和无定形硅两种同素异形体.
(2)晶体硅是灰黑色、有金属光泽、硬而脆的固体,其结构类似于金刚石,熔点和沸点都很高,硬度也很大,是良好的半导体材料.
2.硅的化学性质
(1)与非金属反应
Si+O 2SiO 2
242Si H SiH ∆+=
(2)与强碱反应
Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑
实质:Si 为还原剂,且是Si 先H 2O 反应,然后生成的硅酸再与NaOH 反应,即氧化剂为H 2O.
(3)与氢氟酸反应
Si+4HF =SiF 4↑+2H 2↑
Si 不与硫酸、硝酸反应.
3.硅的工业制法
制粗硅:SiO 2 + 2C
Si + 2CO 制纯硅:
Si + 2Cl 2 SiCl 4(液态),
SiCl 4 + 2H 2 Si + 4HCl. 二、SiO 2的性质及用途
1.物理性质
二氧化硅广泛存在于自然界中,沙子、石英、水晶、硅藻土等的主要成分都是二氧化硅,二氧化硅熔沸点很高,硬度很大,不溶于水.
2.化学性质
(1)酸性氧化物
SiO 2是酸性氧化物,是H 2SiO 3的酸酐,但不溶于水.
SiO 2+CaO =高温
CaSiO 3 高温 高温
高温
SiO 2+2NaOH = Na 2SiO 3 + H 2O
SiO 2 + 4HF === SiF 4 + 2H 2O
(2)弱氧化性
SiO 2+2C =高温 Si + 2CO
(3)与碱反应
SiO 2+2NaOH =Na 2SiO 3+H 2O
Na 2SiO 3是一中矿物胶,其水溶液俗名水玻璃,可用于制是一中矿物胶,其水溶液俗名水玻璃,可用于制H 2SiO 3
Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓
(3)与氢氟酸反应
SiO 2+4HF =SiF 4↑+2H 2O (用于雕刻玻璃)
(4)与碳酸盐反应
SiO 2+CaCO 3 =高温CaSiO 3+CO 2↑
3. 二氧化硅的用途
(1)SiO 2是制造光导纤维的主要原料.
(2)石英制作石英玻璃、石英电子表、石英钟等.
(3)水晶常用来制造电子工业的重要部件、光学仪器、工艺品等.
(4)石英砂常用作制玻璃和建筑材料.
例1. 下列说法正确的是( )
(A)硅材料广泛应用于光纤通讯
(B)工艺师利用盐酸刻蚀石英制作艺术品
(C)水晶项链和餐桌上的瓷盘都是硅酸盐制品
(D)粗硅制备单晶硅不涉及氧化还原反应
答案A
解析:水晶即SiO2,不是硅酸盐.。