氧族元素复习
- 格式:ppt
- 大小:5.00 MB
- 文档页数:21


2H 2O 2===2H 2O+O 2 ↑MnO 2氧族元素专题复习【知识点一】氧族元素一、氧族元素的原子结构及性质的递变规律二、臭氧和过氧化氢臭氧和氧气是氧的同素异形体,大气中臭氧层是人类的保护伞过氧化氢不稳定分解,可作氧化剂、漂白剂。
【知识点二】硫及其化合物一、硫 俗称硫磺。
1、硫的物理性质:淡黄色固体,难溶于水,可溶于酒精,易溶于CS 2 ,熔沸点都很低。
存在形式:游离态:火山口附近或地壳的岩石 用何种方法除去沾在试管上的硫单质? (用CS 2 洗涤,加热升华法)硫比较活泼的非金属单质,常见化合价为-2,0,+4,+6,其代表物有物质类别FeS、Na2S、HgS、H2SS SO2、H2SO3、Na2SO3、NaHSO3SO3、H2SO4、NaHSO4、Na2SO4硫单质的处于硫元素的中间价态,那么硫会有哪些化学性质呢?硫既有氧化性又有还原性二、二氧化硫的物理性质无色、有刺激性气味的有毒气体;密度比空气大;易溶于水(1∶40);(可用于进行喷泉实验,如SO2、HCl、NH3)易液化(-10℃)三、二氧化硫的化学性质1、酸性氧化物能和碱反应生成盐和水:SO2+2NaOH===Na2SO3+H2O能与水反应生成相应的酸:SO2+H2O===H2SO3(二氧化硫的水溶液使紫色石蕊试液变红)二氧化硫溶于水形成的亚硫酸只能存在于溶液中,它很不稳定,容易分解成水和二氧化硫,故二氧化硫溶于水的反应是可逆反应。
SO2+H2O H2SO3SO2与CO2性质的比较名称CO2 SO2与H2O反应CO2+H2O H2CO3 SO2+H2O H2SO3与碱反应CO2+2NaOH===Na2CO3+H2OCO2+NaOH===NaHCO3CO2+Ca(OH)2===CaCO3↓+H2OSO2+2NaOH===Na2SO3+H2OSO2+NaOH===NaHSO3SO2+Ca(OH)2===CaSO3↓+H2O与盐反应CO2+CaCO3+H2O===Ca(HCO3)2 CaSO3+SO2+H2O===Ca(HSO3)2 2、氧化性:SO2气体通过氢硫酸,溶液变浑浊,有淡黄色不溶物出现。

氧族元素知识复习总结相同点:最低化合价为-2价,正价为+4、+6价(氧元素除外)。
不同点:随着原子序数的递增元素原子获得电子的能力在减弱,非金属性依次减弱,金属性依次增强。
都能与多数金属反应。
(2)单质性质的异同:相同点:单质均可作氧化剂,每个原子可获得2个电子。
均有同素异形体。
不同点:单质颜色不同,密度依次增大,熔、沸点依次升高。
单质与2H 化合依次变难;单质氧化性依次减弱,还原性依次增强。
(3)氧化物有两种,3624O R O R ++和,其对应的水化物为含氧酸,均有酸的通性。
气态氢化物H 22R -;H 2S 、H 2Se 、H 2Te 其水溶液都显酸性,除H 2O外,氢化物都具有恶臭,有毒,溶于水形成无氧酸,具有还原性。
2.递变规律随着元素核电荷数的增加,电子层数依次增多,原子半径逐渐增大,核对外层电子的引力逐渐减弱,使原子得电子的能力逐渐减弱,而失电子的能力逐渐增强。
表现在性质上的递变规律是:单质的颜色由无色、淡黄、浅灰至呈银白色。
状态由气态到固态,熔、沸点也依次升高。
元素非金属性逐渐减弱,金属性逐渐增强。
单质的氧化性依次减弱。
含氧酸的酸性依次减弱,H 24R +O3、612R H ++O 4顺序氧化性增强。
气态氢化物的稳定性逐渐减弱,还原性增强。
二、臭氧1.结构:含有非极性键的极性分子,V 型结构2.物理性质:常温、常压下,O 3是一种有特殊臭味的淡蓝色气体,密度比氧气大,也比氧气易溶于水,液态呈深蓝色,沸点的-112.4℃,固态为紫黑色,熔点为-251℃3.化学性质:①不稳定性:常温下分解较慢,在受热、光照和MnO2等作用下迅速分解。
2O3 == 3O2②强氧化性:就氧化能力而言,它介于氧原子和氧分子之间。
能氧化在空气中不能氧化的金属。
臭氧分子与其它物质反应时,常产生氧气。
2Ag + 2O3 =Ag2O2 + 2O2 (常温下反应)O3 + 2KI + H2O = 2KOH + I2注:臭氧能使湿润的KI淀粉试纸变蓝,利用此性质可测定微量O3的含量,也可检验O3。


祝学长学业有成,取得好成绩MnO 2专题十*氧族元素一.考点梳理 1.氧族元素(1)位置:第VIA 族。
包括氧(O )、硫(S )、硒(Se)、碲(Te )、钋(Po )五种元素。
(2)原子结构和性质2.硫及其化合物之间转化关系写出下列反应的方程式,要注明反应条件。
①S+H 2:______________________________ ②S+Cu:______________________________ ③S+Fe :______________________________ ④S+O 2:______________________________ ⑤SO 2+O 2:____________________________ ⑥Cu+H 2SO 4(浓):______________________ ⑦BaCl 2+H 2SO 4:_______________________ ⑧H 2SO 3+O 2:__________________________ 3.臭氧 (1)物理性质具有特殊臭味的淡蓝色气体。
(2)化学性质和用途具有强氧化性和不稳定性(2O 3 = 3O 2);放电时氧气能少量转化成臭氧(3O 2 放电 2O 3),主要用途是脱色剂和消毒剂。
能吸收太阳紫外线,因此要保护大气的臭氧层,防止臭氧层破坏。
4.过氧化氢(1)它的水溶液俗称双氧水,具有弱酸性、不稳定性、强氧化性,也可表现还原性。
①不稳定性,如:2H 2O 2 2H 2O+O 2↑ ②氧化性,如:2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O ③还原性,如:2MnO 4–+5H 2O 2+6H +=2Mn 2++5O 2↑+8H 2O(2)用途:漂白剂、消毒剂、脱氯剂,火箭燃料(作氧化剂)。
5.二氧化硫对环境的污染二氧化硫是污染大气的主要物质之一。
空气中硫的氧化物和氮的氧化物随雨水降下形成酸雨,正常的雨水的pH 为5。
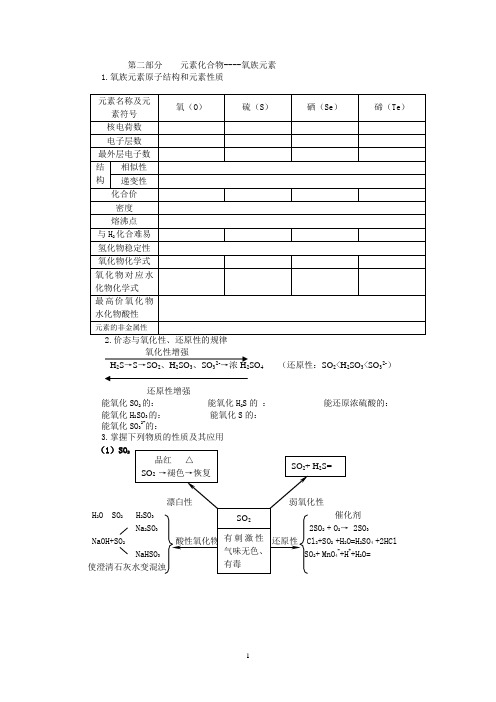
第二部分元素化合物----氧族元素1.氧族元素原子结构和元素性质氧化性增强H2S→S→SO2、H2SO3、SO32-→浓2SO4 (还原性:SO2<H2SO3<SO32-)还原性增强能氧化SO2的:能氧化H2S的:能还原浓硫酸的:能氧化H2SO3的:能氧化S的:能氧化SO32-的:3.掌握下列物质的性质及其应用(1)SO2H2O SO2Na2SO3NaOH+SO2SO4 +2HCl NaHSO++H2O=(2)硫(3)硫化氢(4)氢硫酸(5)亚硫酸(6)浓硫酸常见消毒剂无机:臭氧、双氧水、高锰酸钾、氯气和次氯酸有机:酒精、甲醛、苯酚5、硫及其化合物化学性质的“反常”(1)一般而言,硫和金属反应不比氧气和金属反应容易,但硫和银、汞都可以在常温下反应,而氧不能。
2Ag+S Ag2S Hg+S HgS故实验室里若将水银不慎洒落在地面上,应先尽量回收,残余部分可覆盖硫粉处理。
(2)H2S的水溶液比H2S气体更易被氧化:2H2S(g)+O22S+2H2O(不完全燃烧) 2H2S(溶液)+O22S↓+2H2O(3)SO2的水溶液比SO2气体更具还原性:而2H2SO3+O22H2SO4(4)两种酸之间一般不发生反应,但H2S与酸却能反应。
2H2S+H2SO33S↓+3H2O H2S+H2SO4(浓冷)S↓+SO2↑+2H2O(5)硫化物对酸的溶解性与一般弱酸盐不同。
一般不溶于水的弱酸盐可溶于强酸,如Ag3PO4为黄色沉淀可溶于硝酸,BaCO3为白色沉淀可溶于盐酸,而硫化物对酸的溶解性各具特点,如FeS和CuS均为黑色且不溶于水,FeS可溶于稀强酸(如 H2SO4、HCl),而CuS则不溶,故向CuSO4溶液通入H2S气体有黑色沉淀生成。
H2S+CuSO4CuS↓+H2SO4(6)酸和盐一般发生复分解反应,但是H2S和FeCl3却发生氧化还原反应。
H2S+2FeCl3=2FeCl2+S↓+2HCl(7)NaHSO4溶液相当于一元强酸溶液:故与NaHCO3相遇会产生CO2气体:从某种意义上NaHSO4可看成一元不挥发性酸,所以NaHSO4与NaCl固体混合共热可产生HCl气体:NaHSO4+NaCl Na2SO4+HCl↑6、氧族元素与卤素之间相关知识点“纵横编”(一)卤素单质与S(-2)化合物间的置换反应据原子结构知识和实验事实可知,卤素单质、硫的氧化性强弱顺序是:Cl2>Br2>I2>S,故卤素单质能从负2价硫的化合物中将硫置换出来。
氧族元素复习(命题人:孙亮)一.氧族元素:1.氧族元素递变规律2.相关元素化合物及其反应:①硫(黄色固体)H2 + S H2SFe + S FeS2Fe + 3Cl22FeCl3氧化性:Cl2 > S②臭氧(淡蓝色气体)2O3 = 3O2用途:强氧化剂、漂白剂、消毒剂、臭氧层③过氧化氢(双氧水,无色粘稠液体,弱酸性)MnO22H2O2 ==== 2H2O + O2↑用途:强氧化剂、漂白剂、消毒剂、脱氯剂④硫化氢(无色臭鸡蛋气味的气体)高中阶段能用启普发生器制取的气体:H2、CO2、H2S二.二氧化硫(无色刺激性有毒气体):1.化学性质:+ H2O H2SO3SO催化剂2SO+ O22SO3(无色固体)△SO3 + H2O == H2SO4(工业制硫酸)用途:漂白剂(化合漂白品红,不稳定)练习1、Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合后通入品红和BaCl2的混合溶液,能观察到的现象是()①溶液很快退色;②溶液不退色;③出现沉淀;④不出现沉淀A.①② B.①③ C.②③ D.②④2.空气污染(形成酸雨)正常雨水pH减小到一定程度不再减小的原因+ H2O H2SO3(中强酸)SO2H2SO3 + O2 == 2 H2SO4(强酸)练习2、酸雨主要是燃烧含硫燃料时释放出的SO2造成的,每隔一定时间测定酸雨的pH值,随时间推移测得的pH值()A.逐渐变大B.逐渐变小至某一定值C.不变D.无法判断是否变化三.硫酸:酸性(化):H2SO4 == 2H+ + SO42-吸水性(物):干燥剂(碱性气体除外)五大性质:脱水性(化):脱水碳化(黑面包实验)强氧化性(化):Cu + 2H2SO4(浓)CuSO4 + SO2↑+ 2H2O难挥发性(物):浓HCl、浓HNO3易挥发(对比)练习3、下列气体中,不能用浓硫酸作干燥剂的是①HCl;②HI;③Cl2;④H2;⑤ H2S;⑥SO2;⑦SO3()A.①②⑤⑥B.②④⑤⑥C.③④⑥⑦D.②⑤⑦练习4、浓硫酸在与下列哪些物质反应时,既表现出强酸性又表现强氧化性的是()A.和铜片加热 B.赤热的碳 C.氢硫酸 D.亚硫酸钠SO42-离子检验:滴加稀HCl酸化的BaCl2溶液练习5、用一种试剂即可将浓度均为 1mol/L的Na2SO3、Na2SO4、Na2CO3、Na2S、BaCl2五种溶液区分开来,这种试剂是()A.CuCl2溶液B.AgNO3溶液C.稀硫酸D.NaOH溶液补充:BaSO4:“钡餐”X射线造影剂。