高一化学金属化学方程式总结 金典 全部
- 格式:docx
- 大小:34.70 KB
- 文档页数:10

高一化学方程式大全总结化学方程式大全包括了化学反应中的所有反应方程式。
化学方程式由反应物、生成物和反应条件组成,用化学符号表示。
下面是一些高一化学常见的反应方程式的总结:1.酸碱中和反应方程式:酸+碱→盐+水例如:HCl + NaOH → NaCl + H2O2.金属与酸反应的方程式:金属+酸→盐+氢气例如:2HCl + Mg → MgCl2 + H23.金属与非金属氧化物反应方程式:金属+氧化物→相应的金属氧化物例如:Ca + O2 → CaO4.金属与水反应方程式:金属+水→金属氢氧化物+氢气例如:2Na + 2H2O → 2NaOH + H25.金属与非金属氧化物的反应方程式:金属+非金属氧化物→相应的金属氧化物例如:2Al + 3Cl2O → Al2O3 + 3Cl26.金属与酸性氧化物反应方程式:金属+酸性氧化物→相应的金属氧化物+气体例如:Mg + CO2 → MgO + C7.金属与金属氧化物反应方程式:金属+金属氧化物→相应的金属+氧化物例如:2K + Fe2O3 → 2Fe + K2O8.单质在氧气中燃烧方程式:非金属+氧气→氧化物例如:C + O2 → CO29.碱金属与水反应方程式:碱金属+水→碱式氢氧化物+氢气例如:2Na + 2H2O → 2NaOH + H210.烧碱与酸反应方程式:烧碱+酸→盐+水例如:NaOH + HCl → NaCl + H2O11.过滤反应方程式:固体/悬浊液+溶液→溶液+沉淀例如:AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq) 12.沉淀反应方程式:离子交换反应:阳离子+阴离子→沉淀例如:BaCl2(aq) + Na2SO4(aq) → BaSO4(s) + 2NaCl(aq) 13.气体生成反应方程式:反应物→生成物+气体例如:2H2O2(aq) → 2H2O(l) + O2(g)14.氧化还原反应方程式:氧化剂+还原剂→氧化物+还原物例如:2Na + Cl2 → 2NaCl15.高温分解反应方程式:反应物→生成物例如:2H2O(g) → 2H2(g) + O2(g)这些只是化学方程式的一小部分,还有许多其他类型的化学方程式,例如植物光合作用方程式、电解反应方程式、酸雨反应方程式等等。
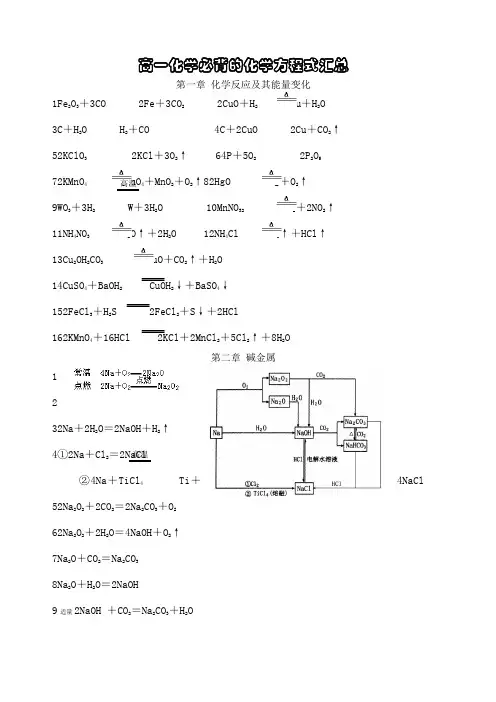
高一化学必背的化学方程式汇总第一章 化学反应及其能量变化1Fe 2O 3+3CO 2Fe +3CO 2 2CuO +H 2 Cu +H 2O 3C +H 2O H 2+CO 4C +2CuO 2Cu +CO 2↑ 52KClO 3 2KCl +3O 2↑ 64P +5O 2 2P 2O 5 72KMnO 4 K 2MnO 4+MnO 2+O 2↑82HgO 2Hg +O 2↑ 9WO 3+3H 2 W +3H 2O 10MnNO 32 MnO 2+2NO 2↑ 11NH 4NO 3 N 2O ↑+2H 2O 12NH 4Cl NH 3↑+HCl ↑ 13Cu 2OH 2CO 3 2CuO +CO 2↑+H 2O 14CuSO 4+BaOH 2 CuOH 2↓+BaSO 4↓ 152FeCl 3+H 2S 2FeCl 2+S ↓+2HCl162KMnO 4+16HCl 2KCl +2MnCl 2+5Cl 2↑+8H 2O第二章 碱金属1 232Na +2H 2O =2NaOH +H 2↑4①2Na +Cl 2=2NaCl②4Na +TiCl 4 Ti +4NaCl52Na 2O 2+2CO 2=2Na 2CO 3+O 2 62Na 2O 2+2H 2O =4NaOH +O 2↑ 7Na 2O +CO 2=Na 2CO 3 8Na 2O +H 2O =2NaOH9适量2NaOH +CO 2=Na 2CO 3+H 2O高温 高温10过量NaOH +CO 2=NaHCO 311NaOH +HCl =NaCl +H 2O 122NaCl +2H 2O 2NaOH +H 2↑+Cl 2↑ 13Na 2CO 3+CO 2+H 2O =2NaHCO 3142NaHCO 3 Na 2CO 3+CO 2↑+H 2O 15Na 2CO 3+2HCl =2NaCl +H 2O +CO 2↑反应相对NaHCO 3慢 16NaHCO 3+HCl =NaCl +H 2O +CO 2↑ 反应相对Na 2CO 3 快 17①CaOH 2适量 CaOH 2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O②CaOH 2过量 CaOH 2+NaHCO 3=CaCO 3↓+NaOH +H 2O184Li +O 2 2Li 2O 192K +2H 2O =2KOH +H 2↑202Na +CuSO 4+2H 2O =CuOH 2↓+Na 2SO 4+H 2↑21NaH +H 2O =NaOH +H 2↑ 222Na +S Na 2S22NH 4HCO 3 NH 3↑+H 2O ↑+CO 2↑232NaCl 熔融 2Na +Cl 2↑242NH 4Cl + CaOH 2 △ CaCl 2 + 2H 2O + 2NH 3↑第三章 物质的量 第四章 卤 素1Cu +Cl 2 CuCl 2 22Fe +3Cl 2 2FeCl 3 32P +3Cl 2 2PCl 32P +5Cl 2 2PCl 542Na +Cl 2=2NaCl52NaCl +2H 2O 2NaOH+H 2↑+Cl 2↑ 6H 2+Cl 2 2HCl 7 8电解点燃点燃电解点燃 点燃 点燃 点燃 电解 点燃9Cl 2+2NaOH =NaCl +NaClO +H 2O 10Cl 2+H 2O =HCl +HClO 11Cl 2+2KI =I 2+2KCl 123Cl 2+2FeBr 2=2FeCl 3+2Br 2 13NaCls +H 2SO 4浓=NaHSO 4+HCl ↑2NaCls +H 2SO 4浓 Na 2SO 4+2HCl ↑14NaOH +HCl =NaCl +H 2O 15Fe +2HCl =FeCl 2+H 2↑ 16CuO +2HCl =CuCl 2+H 2O17CaCO 3+2HCl =CaCl 2+H 2O +CO 2↑ 183Cl 2+6KOH 浓 5KCl +KClO 3+3H 2O 195KCl +KClO 3+3H 2SO 4=3K 2SO 4+3Cl 2↑+3H 2O202KClO 3+I 2=2KIO3+Cl 2 21KClO 3+6HCl 浓=KCl +3H 2O +3Cl 2↑ 224HCl +O 2 2Cl 2↑+2H 2O23CaClO 2+CO 2+H 2O =CaCO 3↓+2HClO24H 2+F 2=2HF 25H 2+Br 2 2HBr26H 2+I 2 2HI 272HClO 2HCl +O 2↑282F 2+2H 2O =4HF +O 2 292NaBr +Cl 2=2NaCl +Br 230Br 2+2KI =I 2+2KBr31KBr +AgNO 3=AgBr↓+KNO 332KI +AgNO 3=AgI ↓+KNO 3 332AgBr 2 2Ag +Br 2 342NH 4Cl + CaOH 2 △ CaCl 2 + 2H 2O + 2NH 3↑ 35I 2+5Cl 2+6H 2O =2HIO 3+10HCl第五章 物质结构 元素周期律1Mg +2H 2O MgOH 2↓+H 2↑2Mg +2HCl =MgCl 2+H 2↑32Al +6HCl =2AlCl 3+3H 2↑ 42Al +2NaOH +2H 2O =2NaAlO 2+3H 2↑ 5Al 2O 3+6HCl =2AlCl 3+3H 2O 6Al 2O 3+2NaOH =2NaAlO 2+H 2O 7NaOH 适量 AlCl 3+3NaOH =AlOH 3↓+3NaClC 450 ︒C 500 ︒光照 光照NaOH过量 AlCl3+4NaOH=NaAlO2+3NaCl+2H2O8AlOH3+3HCl=AlCl3+3H2O9AlOH3+NaOH=NaAlO2+2H2O第六章硫和硫的化合物环境保护1S+H2 H2S 22Na+S Na2S 3Fe+S FeS42Cu+S Cu2S 5Hg+S HgS 6S+O2SO272H2S+O22S↓+2H2OO2不足2H2S+3O22SO2+2H2OO2足量8SO2+2H2S=3S↓+2H2O 9H2S+X2=2HX+S↓X=Cl、Br、I10FeS+2HCl=FeCl2+H2S↑ 11Na2S+FeCl2=FeS↓+2NaCl12Na2S+2HCl=2NaCl+H2S↑13H2S+2NaOH=Na2S+2H2O14H2S+HgNO32=HgS↓+2HNO315Na2S+PbSO4=Na2SO4+PbS↓16Na2S+CuCl2=2NaCl+CuS↓ 17Na2S+2AgNO3=2NaNO3+Ag2S↓18H2S+PbSO4=H2SO4+PbS↓19H2S+CuCl2=2HCl+CuS↓20H2S+2AgNO3=2HNO3+Ag2S↓ 21SO2+H2O H2SO322SO2适量SO2+2NaOH=Na2SO3+H2O,SO2过量SO2+NaOH=NaHSO323SO2+Na2SO3+H2O=2NaHSO324Na2SO3+2HCl=2NaCl+H2O+SO2↑252Na2SO3+O2=2Na2SO4262SO2+O22SO327SO3+H2O=H2SO428SO2+X2+2H2O=H2SO4+2HXX=Cl、Br、I295SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO430Na2SO3+X2+H2O=Na2SO4+2HXX=Cl、Br、I31Na2SO3+H2SO4浓 Na2SO4+H2O+SO2↑32Cu+2H2SO4浓 CuSO4+SO2↑+2H2O33C+2H2SO4浓 CO2↑+2SO2↑+2H2O34S+2H2SO4浓 3SO2↑+2H2O△点燃点燃点燃△△△△△352HX+H2SO4浓 SO2↑+X2↑+2H2OX=Br、I364FeS2+11O22Fe2O3+8SO2372NaHSO3Na2SO3+SO2↑+H2O38H2S+H2SO4浓=S↓+SO2↑+2H2O3H2S+H2SO4浓=4S↓+4H2OH2S过量H2S+3H2SO4浓 4SO2↑+4H2O浓H2SO4过量39H2SO4+2NaOH=Na2SO4+2H2O40H2SO4+BaOH2=BaSO4↓+2H2O41H2SO4+CuOH2=CuSO4+2H2O42CuSO4+BaOH2=CuOH2↓+BaSO4↓433O2 2O3442H2O22H2O+O2↑453S+6KOH浓 2K2S+K2SO3+3H2O462K2S+K2SO3+3H2SO4=3S↓+3K2SO4+3H2O47H2S+Na2S=2NaHS 48NaHS+HCl=NaCl+H2S↑49NaHS+NaOH=Na2S+H2O50SO3+CaO=CaSO451S+2KNO3+3C K2S+N2↑+3CO2↑52NH42SO4 + 2NaOH△ 2NH3↑ + Na2SO4 + 2H2O第七章硅和硅酸盐工业1C+O2 CO22CO2+2Mg C+2MgO32NaOH+CO2=Na2CO3+H2O 4Na2CO3+2HCl=2NaCl+H2O+CO2↑5Na2CO3+CO2+H2O=2NaHCO362C+O22CO72NaHCO3 Na2CO3+CO2↑+H2O,NaHCO3+NaOH=Na2CO3+H2O8Na2CO3+CaOH2=CaCO3↓+2NaOH 9CO2+C 2CO102CO+O2 2CO211CaCO3+2HCl=CaCl2+CO2↑+H2O12CO2+CaOH2=CaCO3↓+H2OCO2适量2CO2+CaOH2=CaHCO32CO2过量高温△△放电2MnO△点燃△高温点燃点燃13CO 2+CaCO 3+H 2O =CaHCO 3214Na 2CO 3+BaOH 2=BaCO 3↓+2NaOH 15CaHCO 32+2NaOH =CaCO 3↓+Na 2CO 3+2H 2O16C +Si SiC 17Si +2F 2=SiF 4 18Si +O 2 SiO 219Si +2Cl 2 SiCl 4 20Si +4HF =SiF 4↑+2H 2↑21Si +2NaOH +H 2O =Na 2SiO 3+2H 2↑22SiO 2+2C Si+2CO ↑ 23SiO 2+3C SiC +2CO ↑ 24SiO 2+CaO CaSiO 3 25SiO 2+2NaOH =Na 2SiO 3+H 2O 26SiO 2+4HF =SiF 4↑+2H 2O 27Na 2SiO 3+2HCl +H 2O =2NaCl +H 4SiO 4↓ 28Na 2SiO 3+CO 2+2H 2O =Na 2CO 3+H 4SiO 4↓H 2O 过量 29Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓30Na 2SiO 3+2CO2+2H 2O =2NaHCO 3+H 2SiO 3↓CO 2过量 31H 2SiO 4 2H 2O +SiO 2 32H 2SiO 3 H 2O +SiO 2 33H 2SiO 3+2NaOH =Na 2SiO 3+2H 2O 34H 4SiO 4+2NaOH =Na 2SiO 3+3H 2O高温△℃500400 高温 高温 高温 △。

高一化学方程式总结大全一、碱金属:1. 新切的钠有银白色光泽,但很快发暗;方程式:4Na+O2=2Na2O;该产物不稳固。
钠在空气中燃烧时,发出黄色的火焰;同时生成淡黄色的固体,方程式:2Na+O2点燃==== Na2O2。
锂燃烧方程式:4Li+O2点燃==== 2Li2O;钾燃烧方程式:K+O2点燃==== KO2。
2. 钠与氧气在不点火时安稳反应,硫的化学性质不如氧气活泼,将钠粒与硫粉混合时爆炸,方程式:2Na+S=Na2S3. 钠与水剧烈反应后滴有酚酞的水变成红色,方程式:2Na+2H2O=2NaOH+H2↑;钾与水反应更剧烈,乃至爆炸,为了安全,常在小烧杯上盖一块小玻璃片。
4. 过氧化钠粉末用脱脂棉包住,①滴几滴水,脱脂棉燃烧;方程式:2Na2O2+2H2O=4NaOH+O2↑;②用玻璃管吹气,脱脂棉也燃烧;有关的方程式:2Na2O2+2CO2=2Na2CO3+O2↑;这两个反应都是放热反应,使脱脂棉到达着火点。
在过氧化钠与水或CO2反应生成O2的两个反应中,为生成1mol O2,需要的Na2O2的物质的量都为2mol,同时需要的H2O或CO2的物质的量都为2mol。
5. 纯碱的化学式是Na2CO3 ,它不带结晶水,又俗名苏打。
碳酸钠晶体化学式是Na2CO3?10H2O,在空气中不稳固,容易失去结晶水,风化,最后的产物是粉末状,叫无水碳酸钠。
钠、氧化钠、过氧化钠、氢氧化钠等在空气中露置的最后产物都是无水碳酸钠。
6. 碳酸钠和碳酸氢钠两种固体物质都可以与盐酸反应放出气体,有关离子方程式分别为:CO32-+2H+=H2O+CO2↑;HCO3-+H+=H2O+CO2↑;其中,以碳酸氢钠与盐酸的反应速度更快;如果碳酸钠和碳酸氢钠的质量相同,当它们完全反应时消耗的盐酸以碳酸钠为多。
7. 碳酸钠和碳酸氢钠的热稳固性较差的是碳酸氢钠,其加热时产生分解,方程式是:2NaHCO3=Na2CO3+H2O+CO2↑。

金属+非金属化学方程式整理(全)-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN2金属化学方程式整理一、钠、镁、铝及其化合物1、 钠暴露在空气中4Na+O 2==2Na 2O ; 钠在空气中点燃:2Na+O 2 == Na 2O 22、 2Na+2H 2O==2NaOH +H 2↑3、 2Na+2HCl==2NaCl +H 2↑4、 钠投入硫酸铜溶液中:2Na+2H 2O==2NaOH +H 2 ↑ CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4 总:2Na+2H 2O+CuSO 4== Cu(OH)2↓+Na 2SO 4 +H 2 ↑5、 Mg+2HCl==MgCl 2+H 2↑ ( Mg+2H +==Mg 2++H 2 ↑ ) 2Al+6HCl ==2AlCl 3+3H 2↑ ( 2Al+6H +==2Al 3++3H 2 ↑ )6、 2Al+2NaOH+2H 2O ==2NaAlO 2+3 H 2↑( 2Al+2OH -+2H 2O ==2AlO 2-+3 H 2↑ )7、 2Na 2O 2+2H 2O==4NaOH+O 2↑ ( 2Na 2O 2+2H 2O==4Na ++4OH -+O 2↑) 8、 2Na 2O 2+2CO 2==2Na 2CO 3+O 29、 Na 2O + 2HCl == 2NaCl + H 2O ( 说明Na 2O 是碱性氧化物 ) 10、2Na 2O 2 + 4HCl==4NaCl + 2H 2O + O 2↑ ( Na 2O 2不是碱性氧化物 ) 11、Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑ ( CO 32- +2H + == H 2O + CO 2↑) 12、NaHCO 3 + HCl== NaCl + H 2O + CO 2↑ ( HCO 3- + H + == H 2O + CO 2↑) 13、2NaHCO 3= Na 2CO 3+H 2O+CO 2↑14、Al 2O 3 + 6HCl == 2AlCl 3 + 3H 2O ( Al 2O 3 + 6H +== 2Al 3++ 3H 2O ) 15、Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O ( Al 2O 3 + 2OH - ==2AlO 2- + H 2O ) 16、AlCl 3 + 3NH 3·H 2O== Al(OH)3↓+ 3NH 4Cl (实验室制氢氧化铝)Al 3++3NH 3· H 2O== Al(OH)3↓+3NH 4+17、Al(OH)3+3HCl==AlCl 3+3H 2O ( Al(OH)3+3H +== Al 3++3H 2O ) 18、Al(OH)3+NaOH==NaAlO 2+2H 2O ( Al(OH)3+OH - ==AlO 2-+2H 2O )△△△319、2Al(OH)3 == Al 2O 3+3H 2O 20、少量CO 2通入NaOH 溶液:2NaOH+ CO 2== Na 2CO 3+ H 2O ( 2OH -+ CO 2==CO 32-+ H 2O ) 21、足量CO 2通入NaOH 溶液:NaOH+ CO 2== NaHCO 3 ( OH -+ CO 2==HCO 3- ) 22、少量NaOH 加入AlCl 3溶液:AlCl 3+3NaOH== Al(OH)3↓+3NaCl ( Al 3++3OH - ==Al(OH)3↓ ) 23、足量NaOH 加入AlCl 3溶液:AlCl 3+4NaOH== NaAlO 2+3NaCl+2 H 2O ( Al 3++4OH - == AlO 2-+2H 2O ) 24、Na 2CO 3 与NaHCO 3相互转化Na 2CO 3+ H 2O+ CO 2==2NaHCO 3 (CO 32-+ H 2O+ CO 2== 2HCO 3-) NaHCO 3+NaOH== Na 2CO 3+ H 2O (HCO 3-+ OH - == CO 32-+ H 2O )25、氯碱工业(电解饱和食盐水):2NaCl +2 H 2O==== 2NaOH +H 2↑+Cl 2↑ 26、侯氏(侯德榜)制(纯)碱法(饱和食盐水中先通氨气,再通二氧化碳) ①NaCl +NH 3+H 2O+ CO 2==NaHCO 3↓+NH 4Cl ②2NaHCO 3=== Na 2CO 3+H 2O+CO 2↑ 二、铁及其化合物1、Fe+2HCl==FeCl 2+H 2↑ ( Fe +2H +=Fe 2++H 2↑) Fe+CuSO 4==FeSO 4+Cu ( Fe +Cu 2+=Fe 2++Cu )2、FeO+2HCl=FeCl 2 +H 2O ( FeO +2H +=Fe 2++H 2O )3、Fe 2O 3+6HCl=2FeCl 3 +3H 2O ( Fe 2O 3+6H +=2Fe 3++3H 2O )4、Fe 3O 4+8HCl=FeCl 2 +2FeCl 3+4H 2O ( Fe 3O 4+8H += Fe 2++2Fe 3++4H 2O )5、Fe 2? + 2OH ? = Fe(OH)2?6、Fe 3? + 3OH ? = Fe(OH)3?电解△47、4Fe(OH)2+O 2+2H 2O=4Fe(OH)3 (现象:白色沉淀迅速变成灰绿色,最后变为红褐色)8、2Fe(OH)3 == Fe 2O 3+3H 2O9、Fe(OH)2+2HCl=FeCl 2 +2H 2O ( Fe(OH)2 +2H +=Fe 2++2H 2O ) 10、Fe(OH)3+3HCl=FeCl 3+3H 2O ( Fe(OH)3 +3H +=Fe 3++3H 2O )11、Fe 3? +3SCN ?=Fe(SCN)3 (现象:溶液呈红色。

...高一化学方程式总结〔1〕.Fe与O2:3Fe+2O2Fe3O4 一.钠:〔2〕.Al2O3电解:2Al2O34Al+3O2↑〔1〕.Na在空气中与O2:4Na+O2=2Na2O〔白色〕〔2〕.Na在O2中燃烧:2Na+O2Na2O2〔淡黄色〕〔3〕.Na与S:2Na+S=Na2S〔研磨即爆炸〕〔4〕.Na与Cl2:2Na+C2l2NaCl〔5〕.Na与H2O:2Na+2H2O=2NaOH+H2↑〔2Na+2H2O +-=2Na+2OH+H2↑〕+〔6〕.Na与HCl:2Na+2HCl=2NaCl+H2↑〔2Na+2H +=2Na+H2↑〕〔7〕.Na与CuSO4溶液:2Na+2H2O+CuSO4=Na2SO4+ Cu(OH)2↓+H2↑〔8〕.Na与FeC3l溶液:6Na+6H2O+2FeC3l=6NaCl+ 〔3〕.Fe与H2O〔g〕高温:3Fe+4H2O〔g〕Fe3O4+4H23+2+〕〔4〕.FeCl3+Fe:2FeCl3+Fe=3FeC2l〔2Fe+Fe=3Fe2+3+〔5〕.FeCl2+Cl2:2FeCl2+Cl2=2FeCl3〔2Fe+Cl2=2Fe -+2Cl〕〔6〕.FeCl3与Cu:2FeCl3+Cu=2FeC2l+CuC2l(用于雕刻3+2+2+〕铜线路板)〔2Fe+Cu=2Fe+Cu〔7〕.FeO与HCl:FeO+2HCl=FeC2l+H2O〔同H2SO4〕+2+〔FeO+2H=Fe+H2O〕〔8〕.Fe2O3与HCl:Fe2O3+6HCl=2FeC3l+3H2O〔同+=2Fe3++3H2O〕H2SO4〕〔Fe2O3+6H〔9〕.Fe3O4与HCl:Fe3O4+8HCl=2FeC3l+FeC2l+4H2O +2+3+〔同H2SO4〕〔Fe3O4+8H=Fe+2Fe+4H2O〕〔10〕.FeSO4与NaOH:FeSO4+2NaOH=Fe(OH)2↓+2Fe(OH)3↓+3H2↑〔9〕.Na2O与H2O:Na2O+H2O=2NaOH 〔10〕.Na2O与CO2:Na2O+CO2=Na2CO32+-=Fe(OH)2↓〕Na2SO4〔Fe+2OH〔11〕.FeCl3与NaOH:FeCl3+3NaOH=Fe(OH)3↓+3NaCl〔11〕.Na2O2与H2O:2Na2O2+2H2O=4NaOH+O2↑+-〔2Na2O2+2H2O=4Na+4OH+O2↑〕〔12〕.Na2O2与CO2:2Na2O2+2CO2=2Na2CO3+O2〔供氧〕〔13〕.Na2CO3与HCl:Na2CO3+2HCl=2NaCl+H2O+2-+CO2↑〔互滴鉴别〕〔CO3+2H=H2O+CO2↑〕〔14〕.NaHCO3与HCl:NaHCO3+HCl=NaCl+H2O+CO2 -+↑〔HCO3+H=H2O+CO2↑〕〔15〕.NaHCO3与NaOH:NaHCO3+NaOH=Na2CO3+H2O --2-〔HCO3+OH=CO3+H2O〕〔16〕.Na2CO3与H2O与CO2:Na2CO3+H2O+CO2=2--〕2NaHCO3〔鉴别、除杂〕〔CO3+H2O+CO2=2HCO33+-=Fe(OH)+3OH3↓〕+〔Fe(OH)3+3H3+=Fe〔Fe〔12〕.Fe(OH)2与H2O与O2:4Fe(OH)2+2H2O+O2=4Fe(OH)3〔白色沉淀→灰绿色沉淀→红褐色沉淀〕〔13〕.Fe(OH)2与HCl.Fe(OH)2+2HCl==FeC2l+2H2O+2+〔Fe(OH)2+2H=Fe+2H2O〕〔14〕.Fe(OH)3与HCl:Fe(OH)3+3HCl==FeC3l+3H2O+3H2O〕〔15〕.Fe(OH)3加热:2Fe(OH)3Fe2O3+3H2O 〔16〕.FeCl3与KSCN F:eCl3+3KSCN==Fe(SCN3+)3KCl 3+-3+〔Fe=Fe(SCN3)〕(红色溶液,用于鉴别Fe +3SCN)〔17〕.NaHCO3分解:2NaHCO3Na2CO3+H2O+CO2↑〔18〕.NaOH与CO2(少量):2NaOH+CO2(少量)=Na2CO3 -2-+H2O〔2OH+CO2(少量)=CO3 +H2O〕〔17〕.FeCl3与H2S(少量):2FeCl3+H2S(少量)=2FeC2l+2HCl+S↓〔18〕.FeCl3与KI:2FeCl3+2KI=2FeC2l+2KCl+2I↓〔19〕.FeCl3与H2O:FeCl3+3H2OFe(OH)3(胶体)+3HCl〔19〕.NaOH与CO2〔过量〕:NaOH+CO2〔过量〕=NaHCO3〔OH --〕+CO2〔过量〕=HCO3二.铝:〔20〕.C与H2O:C+H2OCO+H2(生成水煤气) 四.硅:〔1〕Si与NaOH与H2O:Si+2NaOH+H2O=Na2SiO3+-2-2H2↑〔Si+2OH+H2O=SiO3+2H2↑〕...〔1〕.Al与6HCl:2Al+6HCl=2AlC3l+3H2↑〔同H2SO4〕〔2Al+6H+=2Al3++3H2↑〕〔2〕Si与HF:Si+4HF=SiF4+2H2↑〔3〕Si与F2:Si+2F2=SiF4〔2〕.Al与NaOH与H2O:2Al+2NaOH+2H2O=2--NaAlO2+3H2↑〔2Al+2OH+2H2O=2AlO2+3H2↑〕〔3〕.Al2O3与HCl:Al2O3+6HCl=2AlC3l+3H2O+3+〔Al2O3+6H=2Al+3H2O〕〔4〕.Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O--〔Al2O3+2OH=2AlO2+H2O〕〔5〕.Al(OH)3与HCl:Al(OH)3+3HCl=AlC3l+3H2O+3+〔Al(OH)3+3H=Al+3H2O〕〔6〕.Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O--〔Al(OH)3+OH=AlO2+2H2O〕〔7〕.2Al(OH)3Al2O3+3H2O〔8〕.AlCl3与NH3·H2O:AlCl3+3NH3·H2O=Al(OH)3↓+3++3NH4Cl〔Al+3NH3·H2O=Al(OH)3↓+3NH4〕〔9〕.NaAlO2与HCl与H2O:-+NaAlO2+HCl+H2O=NaCl+Al(OH)3↓〔AlO2+H+H2O=Al(OH)3↓〕〔4〕Si与O2:Si+O2SiO2〔研细的硅与纯氧〕〔5〕Si与C:Si+CSiC〔6〕C与SiO2:2C+SiO22CO↑+Si〔工业制粗硅〕〔7〕Cl2:与Si:2Cl2+Si=SiC4l〔8〕SiC4l与H2:SiCl4+2H2=Si+4HC〔l粗硅提纯〕〔9〕SiO2与NaOH:SiO2+2NaOH=Na2SiO3+H2O-2-〔SiO2+2OH=SiO3+H2O〕〔10〕CaO与SiO2::CaO+SiO2CaSiO3〔11〕SiO2与HF:SiO2+4HF=SiF4+2H2O〔12〕Na2SiO3与HCl:Na2SiO3+2HCl=2NaCl+H2SiO3↓〔13〕Na2SiO3与H2O与CO2:Na2SiO3+H2O+CO2=NaCO+HSiO↓〔强酸制弱酸〕2323〔14NaH〕SiOOCO()NaSiO+HO+2CO与23222322与过量:()=2NaHCO+HSiO过量↓323〔10〕.NaAlO2与CO2(少量)与H2O:2NaAlO2+CO2(少量)+3H2O=2Al(OH)3↓+Na2CO3-2-〕〔12〕.AlO2+CO2(少量)+3H2O=2Al(OH)3↓+CO3〔11〕.NaAlO2与CO2(过量)与2H2O:NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+NaHCO3--〕〔AlO2+CO2(过量)+2H2O=Al(OH)3↓+HCO3〔12〕.Al与O2:4Al+3O2=2Al2O3〔15〕SiO2与Na2CO3:SiO2+Na2CO3Na2SiO3+CO2↑〔16〕SiO2与CaCO3:SiO2+CaCO3CaSiO3+CO2↑〔工业制玻璃〕〔17〕H2SiO3与NaOH:H2SiO3+2NaOH==Na2SiO3+ 2H2O〔18〕H2SiO3分解:H2SiO3SiO2+H2O五.氯:三.铁:〔1〕Cu与Cl2:Cu+Cl2CuCl2(棕黄色烟) CaSO3↓+H2O〔11〕Ca(OH)2与SO2(过量):Ca(OH)2+SO2(过量)〔2〕Cl2与Fe:3Cl2+2Fe2FeCl3(棕黄色烟)〔高价产物〕=Ca(HSO3)2〔12〕CaO与SO2:CaO+SO2=CaSO3〔13〕SO2与O2:2SO2+O22SO3〔3〕Na与Cl2:2Na+Cl22NaCl(白烟) 〔14〕Cl2与SO2:Cl2+SO2+2H2O=H2SO4+2HCl(同Br2、+2--I2)〔Cl2+SO2+2H2O=4H+SO4+2Cl)〔15〕H2S与SO2:2H2S+SO2=2H2O+3S↓〔4〕Cl2与H2:Cl2+H22HCl(燃烧苍白色火焰,光照〔16〕SO3与H2O:SO3+H2O=H2SO4〔17〕CaO与SO3:CaO+SO3=CaSO4会爆炸)〔5〕Cl2与P:3Cl2+2P2PCl3(液体) 〔18〕H2S与O2(少量):2H2S+O2(少量)2H2O+2S〔6〕Cl2与P:5Cl2+2P2PCl5(固体)〔白色烟雾〕〔7〕Cl2与H2O:Cl2+H2OHCl+HClO(新制氯水成分+,Cl-,ClO-,OH-)三分子H2O,C2l,HClO四离子H〔8〕Cl2与2NaOH:Cl2+2NaOH=NaCl+NaClO+H2O〔9〕Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaC2l+Ca(ClO)2+2H2O 〔19〕H2S+O2(足量):2H2S+3O2(足量)2H2O+2SO2 〔20〕FeS与HCl:FeS+2HCl=H2S↑+FeC2l(同H2SO4,实验室制备H2S)〔21FeSO4FeS〕与:+11O2FeO+8SO2222232〔22SOH〕与O SO+HO=HSO〔工业制硫酸〕:323224〔工业制漂白粉〕〔10〕漂白粉的漂白原理Ca(ClO)2与H2O与CO2(少量):七.氮Ca(ClO)2+H2O+CO2(少量)=CaCO3↓+2HClO〔强酸制弱酸〕〔1〕N2与H2:N2+3H22NH3〔工业合成氨〕〔11〕漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):〔2〕N2与O2:N2+O22NOCa(ClO)+HO+CO()=CaCO+2HClO少量↓22232HClO2HCl+O2↑〔12〕FeCl2与Cl2:2FeCl2+C2l=2FeC3lN2与Mg:N2+3MgMg3N2〔3〕〔4〕NO与O2:2NO+O2=2NO2〔13〕NaBr与Cl2:2NaBr+Cl2==2NaCl+Br2〔2Br -+C2l〔5〕2NO2N2O4-==2Cl+Br2〕- 〔14〕KI+C2l:2KI+C2l==2KCl+2I〔2I -+Cl2==2Cl + 〔6〕NO2与H2O:3NO2+H2O=2HNO3+NO〔7〕NO与3O2与2H2O:NO+3O2+2H2O=4HNO3〔8〕NO2与O2与H2O:4NO2+O2+2H2O=4HNO3I2〕〔15〕实验室制备氯气MnO2与HCl(浓):MnO2+4HCl(浓)+-MnCl2+Cl2↑+2H2O〔MnO2+4H+2Cl 〔9〕Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2+H2O〔实验室制备SO2〕〔10〕Na2SO3+O2:2Na2SO3+O2=2Na2SO4 〔11〕SO2(少量)与NH3与H2O:SO2(少量)+2NH3+H2O=2+Mn+Cl2↑+2H2O〕〔16〕NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3〔X=Cl,Br,I〕(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子) (NH4)2SO3++OH-〔12〕NH3+H2ONH3·H2ONH4〔13〕NH3与HCl:NH3+HCl=NH4Cl(白烟) 〔14〕NH3与HNO3:NH3+HNO3=NH4NO3(白烟)〔17〕NaCl与AgNO3:NaCl+AgNO3=AgCl↓+NaN3O 〔15〕NH3与H2SO4:2NH3+H2SO4=(NH4)2SO4(白色沉淀)〔18〕NaBr与AgNO3:NaBr+AgNO3=AgBr↓+NaN3O (浅黄色沉淀) 〔16〕NH3与O2:4NH3+5O24NO+6H2O〔17〕NO+O2:2NO+O2=2NO2〔18〕NO2+H2O:3NO2+H2O=2HNO3+NO〔工业制硝酸〕〔19〕KI与AgNO3:KI+AgNO3=AgI↓+KN3O(黄色沉淀)〔19〕NH4Cl受热分解:NH4ClNH3↑+HCl↑〔20〕NH4HCO3六.硫:受热分解:NH4HCO3NH3↑+H2O+CO2↑〔1〕Na与S加热:2Na+SNa2S〔2〕Fe与S:Fe+SFeS 〔21〕(NH4)2SO4与NaOH:(NH4)2SO4+2NaOH〔3〕Cu与S:2Cu+SCu2S〔低价产物〕+ Na2SO4+2NH3↑+2H2O(用于检验NH4)〔4〕H2与S:H2+SH2S 〔22〕NH4Cl与Ca(OH)2:2NH4Cl+Ca(OH2)CaCl2+2NH3↑+2H2O〔实验室制氨气〕〔5〕S与O2:S+O2SO2八.硫酸〔6〕S与NaOH:3S+6NaOH2Na2S+Na2SO3+ 〔1〕H2SO4(浓)与Cu:2H2SO4(浓)+CuCuSO4+-2-2-3H2O〔3S+6OH2S+SO3+3H2O〕〔7〕SO2:与H2O:SO2+H2OH2SO3〔注意“可逆反响〞的定义〕〔8〕NaOH与SO2(少量):2NaOH+SO2(少量)=Na2SO3+ 2H2O+SO2↑〔2〕HSO2↑2SO4(浓)与Zn:2H2SO4(浓)+Zn=ZnSO4+2H2O+〔3〕H2SO4(浓)与Fe〔少量〕:6H2SO4(浓)+2FeFe2(SO4)3+6H2O+3SO2↑(Fe少量)H2O 〔4〕H2SO4(浓)与C:2H2SO4(浓)+CCO2↑+2H2O〔9〕NaOH与SO2〔过量〕:NaOH+SO2〔过量〕=NaHSO3+2SO2↑〔10〕Ca(OH)2与SO2(少量):Ca(OH)2+SO2(少量)= 〔5〕H2SO4(浓)与S:2H2SO4(浓)+S2H2O+3SO2↑〔6〕H2S+H2SO4(浓):H2S+H2SO4(浓)=S↓+SO2↑+2+SO2↑+2H2O〔7〕HBr+H2SO4(浓):2HBr+H2SO4(浓)=Br2H2O〔8〕HNO3遇光分解:4HNO34NO2↑+O2↑+2H2O〔硝酸显黄色的原因〕〔9〕Cu与HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O +-2+〔Cu+4H+2NO3=Cu+2NO2↑+2H2O〕(10)HNO3(稀)与Cu:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O+-2+〔3Cu+8H+2NO3=3Cu+2NO↑+4H2O〕〔11〕HNO3(浓)与Fe:6HNO3(浓)+FeFe(NO3)3+3H2O+3NO2↑〔12〕HNO3(稀)与Fe(足量):8HNO3(稀)+3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O〔13〕HNO3(稀)与Fe(少量):4HNO3(稀)+Fe(少量)= Fe(NO3)3+NO↑+2H2O〔14〕C与HNO3(浓):C+4HNO3(浓)CO2↑+4NO2↑+2H2O。

铭叔精华品牌系列の告别版★-----高一化学方程式汇总必修1一、金属的化学性质1.钠在空气中变暗:4Na + O2 = 2Na2O (常温)2.钠在空气中燃烧(黄色火焰):2Na + O2△ Na2O2 (艳色反应)3.钠与水反应(浮、熔、游、响、红):2Na+ 2H2O= 2NaOH+ H2↑4.钠与盐酸反应:2Na+2HCl = 2NaCl+H2↑5.钠与CuSO4溶液反应: 2Na + 2H2O+ CuSO4= Na2SO4+Cu(OH)2↓+ H2↑6.钠在氯气中燃烧(产生白烟):2Na+Cl2 ===== 2NaCl7.钠与硫的反应(爆炸):2Na+S ===== Na2S8.铝箔在氧气中剧烈燃烧: 4Al+3O2====2Al2O39.铝与盐酸反应: 2Al+6HCl=2AlCl3+3H2↑10.铝与氢氧化钠溶液反应:2Al+ 2NaOH+ 2H2O=2NaAlO2+ 3H2↑11.铁在氧气中燃烧: 3Fe +2O2==== Fe3O412.高温下铁与水蒸气反应: 3Fe + 4H2O(g) △ Fe3O4 + 4H2二、钠的重要化合物13.氧化钠与水反应:Na2O+H2O=2NaOH14.氧化钠与二氧化碳反应:Na2O+ CO2= Na2CO315.氧化钠与盐酸反应:Na2O+ 2HCl= 2NaCl+ H2O16.过氧化钠与水反应:2Na2O2+ 2H2O= 4NaOH+ O2↑17. 过氧化钠与二氧化碳反应:2Na2O2+ 2CO2=2Na2CO3+ O218. 过氧化钠与盐酸反应:2Na2O2+4HCl= 4NaCl+2H2O+O2↑19. 碳酸钠与足量盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑20.碳酸钠与少量盐酸反应:Na2CO3+HCl =NaHCO3+NaCl21.碳酸氢钠与盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑22.碳酸氢钠与氢氧化钠反应:NaHCO3+NaOH = Na2CO3+ H2O23.向饱和碳酸钠溶液中通入CO2气体会析出晶体: Na2CO3+ CO2+ H2O = 2NaHCO324.碳酸氢钠受热分解:2NaHCO3△Na2CO3+H2O +CO2 ↑点燃研磨点燃点燃三、铝的重要化合物25.氧化铝是两性氧化物:(1)与盐酸反应:Al 2O 3+6HCl= 2AlCl 3+3 H 2O(2)与NaOH 溶液反应:Al 2O 3+ 2NaOH= 2NaAlO 2+H 2O26.氢氧化铝是两性氢氧化物:(1)与盐酸反应:Al(OH)3+3HCl=AlCl 3+3H 2O(1)与NaOH 溶液反应:Al(OH)3+ NaOH=NaAlO 2+2H 2O27.实验室制A l (O H )3:Al 2(SO 4)3 +6NH 3·H 2O=2Al(OH)3↓+3(NH 4)2SO 428.氢氧化铝加热分解:2Al (OH)3△Al 2O 3+ 3H 2O29.往AlCl 3溶液中逐滴加入NaOH 溶液至刚好生成沉淀: 3NaOH+ AlCl 3=Al (OH)3↓+3NaCl继续加入NaOH 溶液至沉淀溶解: NaOH +Al (OH)3=NaAlO 2+2H 2O30.往NaAlO2溶液中加入稀盐酸至刚好生成沉淀:HCl+NaAlO 2+H 2O= Al (OH)3↓+ NaCl继续加入稀盐酸至沉淀溶解:3HCl+ Al (OH)3= AlCl 3+3H 2O31. 向偏铝酸盐溶液中通入过量CO 2:CO 2+AlO 2-+2H 2O=Al(OH)3↓+HCO 3-四、铁的重要化合物附加:氢氧化铁胶体的制备:FeCl 3 + H 2O(沸水) == Fe(OH)3 + HCl32.氯化铁与氢氧化钠溶液反应:FeCl 3 + 3NaOH = Fe(OH)3 ↓+3NaCl33.硫酸亚铁与氢氧化钠溶液反应:2NaOH+ FeSO 4=Fe(OH)2↓+ Na 2SO 434.氢氧化亚铁在空气中变质:4Fe(OH)2+O 2+2H 2O=4Fe(OH)335.氢氧化铁受热分解:2Fe(OH)3 △Fe 2O 3+3H 2O36.氯化铁溶液中加入铁粉:Fe+ 2FeCl 3=3 FeCl 2 37.氯化亚铁溶液中加入氯水:Cl 2+2FeCl 2=2FeCl 338. 氧化铁与盐酸反应:Fe 2O 3+ 6HCl= 2FeCl 3+3H 2O39. 氧化亚铁与盐酸反应:FeO+2HCl=FeCl 2+H 2O40. 氢氧化铁与盐酸反应:Fe(OH)3+ 3HCl= FeCl 3+3H 2O41. 氢氧化亚铁与盐酸反应:Fe(OH)2+ 2HCl= FeCl 2+2H 2O42.氯化铁溶液中加入铜粉:Cu+2FeCl 3 =2FeCl 2 +CuCl 2第四章43. 二氧化硅与氢氟酸反应(雕刻玻璃) SiO 2 + 4HF = SiF 4↑ + 2H 2O44. 硅单质与氢氟酸反应:Si + 4HF = SiF 4 + 2H2↑45. 二氧化硅与氧化钙高温反应 SiO 2+ CaO == CaSiO 346. 二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O高温 加热47. 单质硅与氢氧化钠溶液反应: Si + 2NaOH + H 2O = Na 2SiO 3 +2H 2↑48. 硅酸的制备 Na 2SiO 3 + 2HCl == H 2SiO 3(胶体) + 2NaCl49. 硅酸钠溶液通入CO 2制得胶体 Na 2SiO 3 + CO 2 + H 2O == H 2SiO 3(胶体)+Na 2CO 350. 高纯硅的制备:①二氧化硅与碳高温下反应制粗硅: SiO 2 + 2C == Si + 2CO↑②粗硅的提纯:Si + 2Cl 2 == SiCl 4 ;SiCl 4 + 2H 2 == Si + 4HCl51. 金属铁在氯气中燃烧 3Cl 2 + 2Fe == 2FeCl 352. 金属钠在氯气中燃烧: 2Na + Cl 2 点燃 2NaCl53. 养金鱼晒水两条方程式 H 2O + Cl 2 == HCl + HClO 2HClO ==== 2HCl + O 2↑54. 氯气的实验室制法 MnO 2 + 4HCl(浓) △ MnCl 2 + 2H 2O + C12 ↑55. 氯气通入澄清石灰水 2Cl 2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl 2 + 2H 2O56. 漂白粉原理(失效原因): Ca(ClO)2 + CO 2 + H 2O = CaCO 3↓ + HClO57. 二氧化硫与水反应 SO 2+H 2OH 2SO 358. 二氧化硫与氢氧化钙溶液反应 SO 2 + Ca(OH)2 ==CaSO 3↓+ H 2O59. 工业制硫酸: ①二氧化硫与氧气反应 2SO 2+O 2 2SO 3 ②三氧化硫与水反应 SO 3+H 2O == H 2SO 460. 等体积的SO 2和Cl 2通入水中 Cl 2+SO 2+2H 2O == H 2SO 4 +2HCl61. SO 2通入氢硫酸溶液中 2H 2S +SO 2 == 2H 2O + 3S↓62. 实验室制备SO 2 Na 2SO 3 + H 2SO 4 == Na 2SO 4 + H 2O + SO 2↑ 63. “雷雨发庄稼”涉及到的三条方程式 N 2 + O 2 ==== 2NO2NO + O 2 == 2NO 2 3 NO 2 + H 2O ==2HNO 3 + NO64. NO 2和氧气4:1比例通入水中完全变成硝酸:4NO 2 + O 2 + 2H 2O = 4HNO 365. NO 和氧气4:3比例通入水中完全变成硝酸: 4NO + 3O 2 + 2H 2O = 4HNO 366. 氨气与水反应 NH 3 + H 2ONH 3·H 2O67. 氨水受热分解:NH 3·H 2O △ NH 3↑ + H 2O68. 氨气催化氧化(工业制硝酸) 4NH 3 + 5O 2 == 4NO + 6H 2O69. 工业合成氨 N 2 + 3H 2 2NH 3 70. 氨气实验室制法 2NH 4Cl + Ca(OH)2 + 2NH 3↑+ 2H 2O71. 氨气与氯化氢反应产生白烟:NH 3 + HCl = NH 4Cl72. 碳酸氢氨受热分解:NH 4HCO 3 △ NH 3↑ + H 2O↑ + CO 2↑光照 催化剂 △放电或高温 催化剂 高温高压高温 点燃73. 硝酸铵与氢氧化钠反应:NH4 + NaOH △ NH3↑ + NaNO3 + H2O74. 氯化铵受热分解NH4Cl == NH3↑+ HCl↑75. 氯气与氢气反应:Cl2 + H2点燃2HCl76. 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O77. 浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑78. 浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2↑+ 2SO2↑ + 2H2O79. 浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑80. 稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑必修2第一章1. 锂在空气中燃烧:4Li + O2△2Li2O2. 钠在空气中燃烧:2Na + O2△Na2O23. 钠与水反应:2Na + 2H2O = 2NaOH + H2↑4. 钾与水反应:2K + 2H2O = 2KOH + H2↑5. 镁与沸水反应:Mg+2H2O(沸水) △Mg(OH)2+H2↑Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑Mg与HCl反应: Mg+2 HCl 错误!未找到引用源。

高中化学方程式大全高一
以下是部分高一化学方程式:
1. 金属钠与盐酸的化学方程式:2Na+2HCl=2NaCl+H2↑
2. 氢氧化钠方在空气中变质的化学方程式:
3. 金属钠放在空气的氧化:4Na+O2=2Na2O (银白色变暗)
4. 金属钠在空气燃烧:2Na+O2=Na2O2Δ (生成淡黄色粉末)
5. 过氧化钠在空气中变质:
6. 过氧化钠与酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑
7. 氧化钠在空气中变质:
8. 氧化钠与酸反应:Na2O+2HCl=2NaCl+H2O
9. 氧化钠在空气中燃烧:2Na2O+O2=2Na2O2Δ
10. 氯气与铜的反应方程式:Cu+Cl2=CuCl2点燃(棕黄色的烟)
11. 氯气与氢气的反应方程式:Cl2+H2=2HCl 点燃(苍白色火焰,生成白雾)
12. 氯气与钠单质的反应方程式:2Na+Cl2=2NaCl 点燃(淡黄色的烟)
13. 氯气与水的方程式:Cl2+H2O=HCl+HClO
以上化学方程式仅供参考,可以查询化学教辅书获取更多相关内容。

高一化学方程式总结通用7篇高一化学方程式总结篇一化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃2H2O5、红磷在空气中燃烧:4P + 5O2 点燃2P2O56、硫粉在空气中燃烧:S + O2 点燃SO27、碳在氧气中充分燃烧:C + O2 点燃CO28、碳在氧气中不充分燃烧:2C + O2 点燃2CO9、二氧化碳通过灼热碳层:C + CO2 高温2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑CO32- + 2H+ = H2O + CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3 + HCl =NaHCO3 + NaClCO32- + H+ = HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+ = H2O +CO2↑小苏打受热分解2NaHCO3==【加热】Na2CO3 + H2O +CO2 ↑氧化还原反应:1. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O2. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑3. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑4. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑5. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO26.一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO27.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2氧化性:2FeCl3 + Fe === 3FeCl22FeCl3 + Cu === 2FeCl2 + CuCl2 (用于雕刻铜线路版)2FeCl3 + Zn === 2FeCl2 + ZnCl2FeCl3 + Ag === FeCl2 + AgCFe2(SO4)3 + 2Ag === FeSO4 + Ag2SO4(较难反应)Fe(NO3)3 + Ag 不反应2FeCl3 + H2S === 2FeCl2 + 2HCl + S2FeCl3 + 2I === 2FeCl2 + 2Cl + I2FeCl2 + Mg === Fe + MgCl2还原性:2FeCl2 + Cl2 === 2FeCl33Na2S + 8HNO3(稀) === 6NaNO3 + 2NO + 3S + 4H2O3Na2SO3 + 2HNO3(稀) === 3Na2SO4 + 2NO + H2O2Na2SO3 + O2 === 2Na2SO4硫和硫的化合物1、硫和钠反应的方程式:2Na+S=Na2S (条件:研磨) 现象:轻微爆炸2、硫和铁反应的方程式:Fe+S=FeS(条件加热)3、硫和浓硫酸反应的化学方程式:S+2H2SO4 =SO2↑ +2 H2O (条件:加热)4、硫和氢氧化钠溶液反应的化学方程式:3S+6NaOH=2Na2S+Na2SO3 + 3H2O(除硫的`化学方法)5、SO2与水反应的方程式:SO2 + H2O =H2SO3 (可逆反应要用可逆符号)6、少量的SO2与NaOH溶液反应的化学方程式:SO2 +2NaOH=Na2SO3 + H2O7、过量的SO2与NaOH溶液反应的化学方程式:SO2 + NaOH=NaHSO38、少量的SO2与澄清石灰水反应的化学方程式:SO2 + Ca(OH)2= CaSO3↓ + H2O9、少量的SO2与饱和的碳酸氢钠溶液反应的化学方程式:SO2 +2NaHCO3= Na2SO3 +2CO2 +H2O10、SO2与Na2SO3溶液反应的化学方程式:SO2 + Na2SO3 +H2O =2NaHSO311、SO2与氢硫酸反应的化学方程式:SO2 + 2H2S=3S↓+2H2O高一化学方程式总结篇二钠及其化合物的性质1.钠在空气中缓慢氧化:4Na+O2==2Na2O2.钠在空气中燃烧:2Na+O2点燃====Na2O23.钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。

高中化学必修1金属和非金属及其化合物化学方程式汇总9、“铝三角”(氢氧化铝的反应在上面已经提到,略):AlCl3+3NaOH(少量)=Al(OH)3↓+3NaClAl3++3OH-=Al(OH)3↓+AlCl3+4NaOH(过量)=2NaAlO2 + 2H2O +3NaClAl3++4OH- = AlO2- +2H2ONaAlO2+HCl(少量)+H2O=Al(OH)3↓+NaClAlO2- +H+ +H2O=Al(OH)3↓NaAlO2+4HCl(过量)=AlCl3+3NaCl+2H2OAlO2- +4H+ =Al 3+ + 2H2O10、明矾净水原理明矾溶于水后发生电离:KAl(SO4)2==K++Al3++2SO42-铝离子与水反应生成:Al(OH)3胶体:Al3++3H2O==Al(OH)3(胶体)+3H+三、铁及其重要化合物1、工业炼铁原理:Fe2O3+3CO 高温 2Fe+3CO22、铁与非金属反应:2Fe+3Cl2点燃 2FeCl33Fe+2O2点燃 Fe3O43、与水反应:3Fe+4H2O(g) 高温 Fe3O4+4H24、铁与酸反应:Fe+2HCl== FeCl2+H2↑Fe+2H+== Fe2++H2↑5、铁与盐溶液反应:Fe+CuSO4==Cu+FeSO4 Fe+Cu2+==Cu+Fe2+Fe+2FeCl3 == 3FeCl2Fe+2Fe3+ == 3Fe2+6、铁的氧化物Fe2O3 + 6H+ == 2Fe3+ + 3H2OFeO + 2H+ == Fe2+ + H2O7、Fe2+与Fe3+的检验①、Fe2+的检验:(1) 颜色:浅绿色 (2)加NaOH溶液:先产生白色沉淀,后变成灰绿色,最后成红褐色Fe2++2OH-== Fe(OH)2↓ (白色)4Fe(OH)2+O2+2H2O== 4Fe(OH)3(红褐色)(3) 先加KSCN溶液,不变色,再加新制氯水,溶液变成血红色2Fe2++Cl2==2Fe3++2Cl-②、Fe3+的检验(1)颜色:棕黄色(2)加KSCN溶液:溶液变成血红色(3)加NaOH溶液:红褐色沉淀 Fe3++3OH-== Fe(OH)3↓8、氢氧化铁受热分解:2Fe(OH)3△ Fe2O3 + 3H2O9、 Fe2+与Fe3+的转化(1)Fe2+→Fe3+2Fe2++Cl2==2 Fe3++2Cl-(2) Fe3+→Fe2+Fe+2Fe3+ == 3Fe2+四、硅及其重要化合物1、二氧化硅① 酸性氧化物:SiO2+2NaOH==Na2SiO3+H2OSiO2+CaO高温 CaSiO3② 弱氧化性:SiO2 +4HF==SiF4↑+2H2O2、硅酸盐Na2SiO3+2HCl==H2SiO3↓+2NaClNa2SiO3+ CO2+H2O==H2SiO3 ↓+Na2CO3(酸性:H2CO3 > H2SiO3)五、氯的重要化合物1、氯气与金属的反应2Fe+3Cl2点燃 2FeCl3Cu+Cl2点燃 CuCl22Na+Cl2点燃 2NaCl2、氯气与非金属的反应H2+Cl2 点燃 2HCl 2P+3Cl2点燃 2PCl3 2P+5Cl2点燃 2PCl5 3、氯气与水的反应Cl2+H2O == HCl + HClO(次氯酸)4、次氯酸光照分解:2HClO 光照 2HCl + O2↑5、Cl2与碱溶液的反应Cl2+2NaOH=NaCl+NaO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(制漂白粉)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO(漂白原理)(酸性:H2CO3 > HClO)六、硫及其重要化合物1、硫的可燃性S+O2点燃 SO22、2SO2 + O2 2SO33、与水反应:SO2+H2O H2SO3SO3+H2O == H2SO44、与碱反应:SO2 + Ca(OH)2= CaSO3 + H2OSO3 + Ca(OH)2= CaSO4 + H2O5、与碱性氧化物反应:SO2+CaO == CaSO3SO3+CaO == CaSO46、浓硫酸强氧化性C + 2H2SO4(浓) △ CO2↑+ 2SO2↑+ 2H2OCu+2H2SO4(浓)△ CuSO4+SO2↑十2H2O七、氮及其重要化合物1、合成氨: N2 + 3H22NH32、NH3①氨气与水:NH3 + H2O NH3·H2O NH4+ + OH -②氨气与酸:NH3+HCl=NH4ClNH3+HNO3=NH4NO33、铵盐与碱反应:NH4NO3+NaOH △ NaNO3+NH3↑+H2O2NH4Cl + Ca(OH)2△ CaCl2 + 2NH3↑+ 2H2O(实验室制氨气)4、铵盐不稳定性:NH4Cl △ NH3↑+HCl ↑ NH4HCO3△ NH3+H2O+CO2↑5、HNO3强氧化性:4HNO3(浓)+Cu==Cu(NO3)3+3NO2↑+2H2O8HNO3+3Cu==3Cu(NO3)3+2NO↑+4H2O6、雷雨发庄稼N2 + O2放电 2NO2NO + O2 == 2NO23NO2 + H2O == 2HNO3 + NO其它知识1、固体颜色:淡黄色固体: Na2O2 , S2、颜色反应:Na元素:黄色;K元素:紫色(透过蓝色钴玻璃)3、沉淀颜色:Mg(OH)2白色;Fe(OH)2 白色; Fe(OH)3 红褐色;Cu(OH)2蓝色4、离子溶液颜色:Fe2+浅绿色;Fe3+黄色;Cu2+蓝色5、气体颜色:NO2红棕色;Cl2黄绿色6、 Al 、Fe在冷的浓H2SO4、浓HNO3中发生钝化。

高一化学方程式总结一.钠:(1).Na在空气中与O2:4Na + O2 = 2Na2O(白色)(2).Na在O2中燃烧:2Na + O2Na2O2(淡黄色)(3).Na与S:2Na + S = Na2S(研磨即爆炸)(4).Na与Cl2:2Na + Cl22NaCl(5).Na与H2O:2Na + 2H2O = 2NaOH + H2↑ (2Na + 2H2O = 2Na+ + 2OH- + H2↑)(6).Na与HCl:2Na + 2HCl = 2NaCl + H2↑ (2Na + 2H+ =2Na+ + H2↑ )(7).Na与CuSO4溶液:2Na + 2H2O + CuSO4 = Na2SO4+ Cu(OH)2↓ + H2↑(8).Na与FeCl3溶液:6Na + 6H2O + 2FeCl3 = 6NaCl + 2Fe(OH)3↓ + 3H2↑(9).Na2O与H2O:Na2O + H2O = 2NaOH(10).Na2O与CO2:Na2O + CO2= Na2CO3(11).Na2O2与H2O:2Na2O2 + 2H2O = 4NaOH + O2↑(2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑)(12).Na2O2与CO2:2Na2O2 + 2CO2 = 2Na2CO3 + O2(供氧)(13).Na2CO3与HCl:Na2CO3 +2HCl = 2NaCl + H2O +CO2↑(互滴鉴别)(CO32- + 2H+ = H2O + CO2↑)(14).NaHCO3与HCl:NaHCO3 + HCl = NaCl + H2O + CO2↑(HCO3- + H+ = H2O + CO2↑)(15).NaHCO3与NaOH:NaHCO3 +NaOH=Na2CO3 + H2O (HCO3- + OH- = CO32- + H2O)(16).Na2CO3与H2O 与CO2 :Na2CO3 + H2O + CO2 =2NaHCO3(鉴别、除杂)(CO32- + H2O + CO2 = 2HCO3-)(17).NaHCO3 分解:2NaHCO3Na2CO3+H2O+ CO2↑(18).NaOH与CO2 (少量):2NaOH + CO2 (少量) = Na2CO3 + H2O (2OH-+ CO2 (少量) = CO32- + H2O)(19).NaOH 与CO2(过量):NaOH + CO2(过量)= NaHCO3(OH -+ CO2(过量)= HCO3-)二.铝:(1).Al与6HCl:2Al+6HCl=2AlCl3+3H2↑(同H2SO4)(2Al+6H+ =2Al3+ + 3H2↑ )(2).Al 与NaOH 与H2O:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑(2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑)(3).Al2O3与HCl:Al2O3 + 6HCl = 2AlCl3 + 3H2O(Al2O3 + 6H+ =2Al3+ + 3H2O)(4).Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3 + 2OH- = 2AlO2- + H2O )(5).Al(OH)3与HCl:Al(OH)3 + 3HCl = AlCl3 + 3H2O(Al(OH)3 + 3H+ = Al3+ + 3H2O)(6).Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O (Al(OH)3 + OH- = AlO2- + 2H2O)(7).2Al(OH)3Al2O3 + 3H2O(8).AlCl3与NH3·H2O:AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3NH4Cl (Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+)(9).NaAlO2与HCl与H2O:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ (AlO2- + H+ +H2O = Al(OH)3↓ )(10).NaAlO2 与CO2(少量)与H2O:2NaAlO2 + CO2(少量)+3H2O=2Al(OH)3↓+Na2CO3(12).AlO2- + CO2(少量)+ 3H2O = 2Al(OH)3↓ + CO32-)(11).NaAlO2与CO2(过量)与2H2O:NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+NaHCO3(AlO2- + CO2(过量) + 2H2O = Al(OH)3↓ + HCO3-)(12).Al 与O2 :4Al + 3O2 = 2Al2O3三.铁:(1).Fe与O2:3Fe+2O2Fe3O4(2).Al2O3电解:2Al2O34Al+3O2↑(3).Fe与H2O(g)高温:3Fe+4H2O(g)Fe3O4+4H2(4).FeCl3 + Fe :2FeCl3 + Fe = 3FeCl2(2Fe3+ + Fe = 3Fe2+)(5).FeCl2+Cl2:2FeCl2+Cl2=2FeCl3(2Fe2+ + Cl2 = 2Fe3++2Cl-)(6).FeCl3与Cu:2FeCl3 + Cu = 2FeCl2 + CuCl2(用于雕刻铜线路板) (2Fe3+ + Cu = 2Fe2++ Cu2+)(7).FeO与HCl:FeO+ 2HCl = FeCl2 + H2O(同H2SO4)(FeO+2H+=Fe2+ +H2O )(8).Fe2O3 与HCl :Fe2O3 + 6HCl = 2FeCl3 + 3H2O(同H2SO4)(Fe2O3 + 6H+=2Fe3+ + 3H2O)(9).Fe3O4 与HCl:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 +4H2O(同H2SO4)(Fe3O4 + 8H+=Fe2+ +2Fe3+ +4H2O)(10).FeSO4与NaOH:FeSO4 + 2NaOH=Fe(OH)2↓ +Na2SO4(Fe2+ + 2OH-=Fe(OH)2↓)(11).FeCl3与NaOH:FeCl3 + 3NaOH=Fe(OH)3 ↓+ 3NaCl (Fe3+ + 3OH-=Fe(OH)3 ↓)(12).Fe(OH)2 与H2O 与O2:4Fe(OH)2 + 2H2O + O2 =4Fe(OH)3 (白色沉淀→灰绿色沉淀→红褐色沉淀)(13).Fe(OH)2与HCl.Fe(OH)2+2HCl==FeCl2+2H2O(Fe(OH)2 + 2H+=Fe2+ + 2H2O)(14).Fe(OH)3与HCl:Fe(OH)3+3HCl==FeCl3+3H2O(Fe(OH)3 + 3H+ = Fe3+ + 3H2O)(15).Fe(OH)3加热:2Fe(OH)3Fe2O3 + 3H2O(16).FeCl3与KSCN:FeCl3+3KSCN==Fe(SCN)3+3KCl(Fe3++ 3SCN- = Fe(SCN)3)(红色溶液,用于鉴别Fe3+) (17).FeCl3与H2S(少量):2FeCl3 + H2S(少量) = 2FeCl2 + 2HCl + S↓ (18).FeCl3与KI:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2↓(19).FeCl3与H2O:FeCl3+3H2O Fe(OH)3(胶体)+3HCl (20).C与H2O:C+H2O CO+H2 (生成水煤气)四.硅:(1)Si与NaOH与H2O:Si + 2NaOH + H2O = Na2SiO3 +2H2↑ (Si+2OH-+H2O= SiO32- + 2H2↑)(2)Si与HF:Si+ 4HF = SiF4 + 2H2↑(3)Si与F2:Si+ 2F2 = SiF4(4)Si与O2:Si+O2SiO2 (研细的硅与纯氧)(5)Si 与C:Si + C SiC(6)C与SiO2:2C+ SiO22CO↑+Si(工业制粗硅)(7)Cl2:与Si:2Cl2+Si= SiCl4(8)SiCl4 与H2:SiCl4 +2H2=Si+4HCl(粗硅提纯)(9)SiO2 与NaOH:SiO2 + 2NaOH = Na2SiO3 + H2O(SiO2 + 2OH- = SiO32-+ H2O )(10)CaO与SiO2::CaO+SiO2CaSiO3(11)SiO2 与HF:SiO2 + 4HF = SiF4 + 2H2O(12)Na2SiO3 与HCl:Na2SiO3 +2HCl=2NaCl+H2SiO3↓(13)Na2SiO3 与H2O与CO2:Na2SiO3 + H2O+CO2 =Na2CO3 + H2SiO3↓(强酸制弱酸)(14)Na2SiO3与H2O与CO2 (过量):Na2SiO3 + H2O+ 2CO2 (过量) = 2NaHCO3+H2SiO3↓(15)SiO2与Na2CO3:SiO2 + Na2CO3Na2SiO3+ CO2↑ (16)SiO2 与CaCO3:SiO2 + CaCO3CaSiO3+ CO2↑(工业制玻璃)(17)H2SiO3与NaOH:H2SiO3 + 2NaOH == Na2SiO3 +2H2O(18)H2SiO3分解:H2SiO3 SiO2 + H2O五.氯:(1)Cu与Cl2:Cu+Cl2CuCl2 (棕黄色烟)(2)Cl2与Fe:3Cl2+2Fe2FeCl3(棕黄色烟) (高价产物)(3)Na 与Cl2 :2Na + Cl2 2NaCl (白烟)(4)Cl2 与H2:Cl2 +H22HCl (燃烧苍白色火焰,光照会爆炸)(5)Cl2 与P:3Cl2 + 2P 2PCl3 (液体)(6)Cl2 与P:5Cl2 + 2P 2PCl5(固体) (白色烟雾)(7)Cl2与H2O:Cl2+H2O HCl+HClO (新制氯水成分三分子H2O,Cl2,HClO四离子H+,Cl-,ClO-,OH-)(8)Cl2 与2NaOH:Cl2 + 2NaOH = NaCl + NaClO + H2O(9)Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (工业制漂白粉)(10)漂白粉的漂白原理Ca(ClO)2与H2O与CO2(少量) :Ca(ClO)2+H2O+ CO2(少量) = CaCO3↓+2HClO (强酸制弱酸)(11)漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):Ca(ClO)2+H2O+CO2(少量) = CaCO3↓+ 2HClO2HClO2HCl+O2↑(12)FeCl2与Cl2:2FeCl2 + Cl2 = 2FeCl3(13)NaBr 与Cl2:2NaBr + Cl2 == 2NaCl + Br2(2Br - + Cl2 == 2Cl- + Br2)(14)KI + Cl2:2KI + Cl2 == 2KCl + I2(2I- + Cl2 == 2Cl- + I2)(15)实验室制备氯气MnO2与HCl(浓):MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O (MnO2+ 4H+ + 2Cl-Mn2+ + Cl2↑ + 2H2O)(16)NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3(X=Cl,Br,I)(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子)(17)NaCl 与AgNO3:NaCl + AgNO3 = AgCl↓ + NaNO3 (白色沉淀)(18)NaBr 与AgNO3:NaBr + AgNO3 = AgBr↓ + NaNO3 (浅黄色沉淀)(19)KI 与AgNO3:KI +AgNO3 = AgI↓ + KNO3 (黄色沉淀)六.硫:(1)Na 与S加热:2Na + S Na2S(2)Fe与S:Fe+S FeS(3)Cu与S:2Cu+S Cu2S (低价产物)(4)H2与S:H2 + S H2S(5)S 与O2:S + O2 SO2(6)S 与NaOH:3S + 6NaOH 2Na2S + Na2SO3 + 3H2O (3S + 6OH-2S2- + SO32- + 3H2O)(7)SO2:与H2O:SO2+H2O H2SO3(注意“可逆反应”的定义)(8)NaOH与SO2 (少量):2NaOH+ SO2 (少量) = Na2SO3 + H2O(9)NaOH与SO2(过量):NaOH+ SO2(过量)= NaHSO3(10)Ca(OH)2 与SO2 (少量) :Ca(OH)2 + SO2 (少量) =CaSO3↓+ H2O(11)Ca(OH)2 与SO2(过量):Ca(OH)2 + SO2(过量)=Ca(HSO3)2(12)CaO与SO2:CaO+ SO2 = CaSO3(13)SO2与O2:2SO2+O2 2SO3(14)Cl2与SO2:Cl2+SO2 +2H2O=H2SO4+2HCl (同Br2、I2) (Cl2+SO2 +2H2O= 4H+ + SO42- + 2Cl-)(15)H2S 与SO2:2H2S + SO2= 2H2O + 3S↓(16)SO3与H2O:SO3+H2O=H2SO4(17)CaO与SO3:CaO+ SO3 = CaSO4(18)H2S 与O2(少量):2H2S + O2(少量) 2H2O+2S (19)H2S + O2(足量):2H2S + 3O2(足量) 2H2O + 2SO2(20)FeS 与HCl:FeS + 2HCl = H2S↑ + FeCl2(同H2SO4,实验室制备H2S)(21)FeS2与O2:4FeS2+11O22Fe2O3 + 8SO2(22)SO3与H2O:SO3+H2O=H2SO4(工业制硫酸)七.氮(1)N2与H2:N2+3H22NH3(工业合成氨)(2)N2与O2:N2+O22NO(3)N2 与Mg:N2 + 3Mg Mg3N2(4)NO 与O2:2NO + O2 = 2NO2(5)2NO 2 N2O4(6)NO2与H2O:3NO2+H2O = 2HNO3+NO(7)NO与3O2与2H2O:NO+3O2+2H2O=4HNO3(8)NO2与O2与H2O:4NO2+O2+2H2O=4HNO3(9)Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2 +H2O (实验室制备SO2)(10)Na2SO3 + O2:2Na2SO3 + O2 = 2Na2SO4(11)SO2(少量) 与NH3 与H2O: SO2(少量) + 2NH3 + H2O = (NH4)2SO3(12)NH3+H2O NH3·H2O NH4++OH-(13)NH3 与HCl :NH3 + HCl = NH4Cl(白烟)(14)NH3 与HNO3:NH3 + HNO3 = NH4NO3(白烟)(15)NH3 与H2SO4:2NH3 + H2SO4 = (NH4)2SO4(16)NH3与O2:4NH3+5O2 4NO+6H2O(17)NO + O2:2NO + O2 = 2NO2(18)NO2+H2O:3NO2+H2O=2HNO3+NO(工业制硝酸)(19)NH4Cl受热分解:NH4Cl NH3↑+HCl↑(20)NH4HCO3受热分解:NH4HCO3NH3↑+ H2O +CO2↑(21)(NH4)2SO4与NaOH:(NH4)2SO4 + 2NaOHNa2SO4 + 2NH3↑+ 2H2O (用于检验NH4+)(22)NH4Cl 与Ca(OH)2:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+2H2O(实验室制氨气)八.硫酸(1)H2SO4(浓) 与Cu:2H2SO4(浓) + Cu CuSO4 + 2H2O + SO2↑(2)H2SO4(浓) 与Zn:2H2SO4(浓) +Zn = ZnSO4 + 2H2O + SO2↑(3)H2SO4(浓) 与Fe(少量):6H2SO4(浓) + 2FeFe2(SO4)3 + 6H2O + 3SO2↑ (Fe少量)(4)H2SO4(浓) 与C:2H2SO4(浓) + C CO2↑ + 2H2O + 2SO2↑(5)H2SO4(浓) 与S:2H2SO4(浓) + S 2H2O + 3SO2↑(6)H2S + H2SO4(浓):H2S + H2SO4(浓)= S↓+ SO2↑+ 2H2O(7)HBr + H2SO4(浓):2HBr + H2SO4(浓)= Br2 + SO2↑+ 2H2O(8)HNO3遇光分解:4HNO3 4NO2↑+ O2↑+ 2H2O(硝酸显黄色的原因)(9)Cu与HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O)(10)HNO3(稀)与Cu:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O)(11)HNO3(浓)与Fe:6HNO3(浓) + Fe Fe(NO3 )3+ 3H2O + 3NO2↑(12)HNO3(稀)与Fe(足量):8HNO3(稀) + 3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O(13)HNO3(稀)与Fe(少量):4HNO3(稀) + Fe(少量)= Fe(NO3)3 + NO↑ + 2H2O(14)C与HNO3(浓):C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O。

◇+高一化学方程式总结◇+(一)◇1Na:1、钠与氧气反应:4Na+O2=2Na2O钠在空气中燃烧:2Na+O2△Na2O22、钠与水反应:2Na+2H2O=2NaOH+H2↑3、过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑4、过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O25、金属钠与硫酸铜溶液:○12Na + 2H2O = 2NaOH + H2↑○22NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4总方程式:2Na + CuSO4 + 2H2O = Cu(OH)2 + Na2SO4 + H2↑6、金属钠与四氯化钛:4Na + TiCl4熔融Ti + 4NaCl◇2Cl:7、氯气与金属铁反应:2Fe+3Cl2点燃2FeCl38、氯气与金属铜反应:Cu+Cl2点燃CuCl29、氯气与金属钠反应:2Na+Cl2点燃2NaCl10、氯气与氢气反应:H2 + Cl2 点燃HCl11、氯气与磷反应:P + Cl2(不足)点燃PCl3P + Cl2(充足)点燃PCl512、氯气与水反应:Cl2+H2O=HCl+HClO13、次氯酸光照分解:2HClO光照2HCl+O2↑14、氯气与氢氧化钠溶液反应:Cl2+2NaOH=NaCl+NaClO+H2O15、氯气与消石灰反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O16、盐酸与硝酸银溶液反应:HCl+AgNO3=AgCl↓+HNO317、漂白粉长期置露在空气中:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO◇3Fe:18、氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl19、硫酸亚铁与氢氧化钠溶液反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO420、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2=4Fe(OH)321、氢氧化铁加热分解:2Fe(OH)3△Fe2O3+3H2O↑22、三氯化铁溶液与铁粉反应:2FeCl3+Fe=3FeCl223、氯化亚铁中通入氯气:2FeCl2+Cl2=2FeCl324、铁与水蒸气反应:3Fe+4H2O(g)=Fe3O4+4H2↑25、氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O◇4N:26、氮气与氧气在放电下反应:N2+O2放电2NO27、一氧化氮与氧气反应:2NO+O2=2NO228、二氧化氮与水反应:3NO2+H2O=2HNO3+NO29、NO、NO2的回收:NO2+NO+2NaOH=2NaNO2+H2O30、浓硝酸与铜反应:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑31、稀硝酸与铜反应:3Cu+8HNO3(稀)△3Cu(NO3)2+4H2O+2NO↑32、氨气的实验室制取:2NH4Cl+Ca(OH)2△CaCl2+2H2O+2NH3↑33、氨水受热分解:NH3•H2O△NH3↑+H2O34、氨气与氯化氢反应:NH3+HCl=NH4Cl35、氯化铵受热分解:NH4Cl△NH3↑+HCl↑36、碳酸氢氨受热分解:NH4HCO3△NH3↑+H2O↑+CO2↑37、硝酸铵与氢氧化钠反应:NH4NO3+NaOH△NH3↑+NaNO3+H2O38、硫酸铵与氢氧化钠反应:(NH4)2SO4+2NaOH△2NH3↑+Na2SO4+2H2O ◇4S:39、S + Fe△FeS40、S + Cu△Cu2S41、S + Na =Na2S42、S + O2点燃SO243、S + H2△H2SH2S + SO2 =S↓+ H2OH2S + H2SO4(浓) = S↓+ SO2 + 2H2O [不能用浓硫酸干燥硫化氢]44、二氧化硫与水反应:SO2+H2O≈H2SO345、二氧化硫与氧气在催化剂的作用下反应:2SO2+O2催化剂2SO346、三氧化硫与水反应:SO3+H2O=H2SO447、SO2+CaO=CaSO348、SO2尾气处理:SO2+2NaOH=Na2SO3+H2O49、SO2+Ca(OH)2=CaSO3↓+H2O50、SO2+Cl2+2H2O=2HCl+H2SO451、SO2 + CaO = CaSO352、实验室制取SO2: Na2SO3 + H2SO4(浓) △SO2↑+ H2O + Na2SO4实验室制取H2S: Na2S + H2SO4△H2S + Na2SO453、浓硫酸与铜反应:Cu+2H2SO4(浓)△CuSO4+2H2O+SO2↑54、浓硫酸与木炭反应:C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O◇5Mg55、Mg的制取:○1CaCO3高温、煅烧CaO + CO2↑○2CaO + H2O = Ca(OH)2○3Mg2+ + Ca(OH)2 = Mg(OH)2 + Ca2+○4Mg(OH)2 + 2HCl =MgCl2 + 2H2O○5MgCl2电解、熔融Mg + Cl2↑◇6Si56、Si + O2△SiO257、Si+2F2=SiF458、二氧化硅与氢氟酸反应:SiO2+4HF=SiF4+2H2O硅单质与氢氟酸反应:Si+4HF=SiF4+2H2↑59、二氧化硅与氧化钙高温反应:SiO2+CaO高温CaSiO360、二氧化硅与氢氧化钠溶液反应:SiO2+2NaOH=Na2SiO3+H2O硅单质与氢氧化钠溶液反应: Si+2NaOH+H2O=Na2SiO3+2H2↑61、SiO2 + Na2CO3高温Na2SiO3 + CO2↑62、往硅酸钠溶液中通入二氧化碳:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓63、硅酸钠与盐酸反应:Na2SiO3+2HCl=2NaCl+H2SiO3↓64、硅单质的实验室制法:粗硅的制取:SiO2+2C高温电炉Si+2CO粗硅转变为纯硅:○1Si(粗)+2Cl2△SiCl4○2SiCl4+2H2高温Si(纯)+4HCl◇7Al65、铝与氢氧化钠溶液反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑66、氧化铝与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O67、氯化铝与一水合氨反应:AlCl3 + 3NH3•H2O = Al(OH)3↓+ 3NH4Cl68、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH + 3H2O=2Na[Al(OH)4]四羟基合铝酸钠溶液通入二氧化碳:CO2(过量) + Na[Al(OH)4] = NaHCO3 + Al(OH)3↓CO2(少量) + 2Na[Al(OH)4] = Na2CO3+ 2Al(OH)3↓+H2O69、实验室制取氢氧化铝:Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH3)2SO470、氢氧化铝与盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O71、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH=Na[Al(OH)4]72、氢氧化铝加热分解:2Al(OH)3△Al2O3+3H2O73、Al3+ + 3Al(OH)4-= 4Al(OH)3↓。
.必修一金属及其化合物化学方程式一、金属钠及其化合物1、钠在空气中(1)钠块在空气中变暗:2Na +O2=Na2O(白色固体)(钠长时间露置在空气中最终变为碳酸钠)(2)在空气中加热4Na+2O2 =2Na2O2(淡黄色固体)现象:钠融化成小球,然后剧烈燃烧,产生黄色火焰,生成淡黄色固体(3)2Na2O+O2=2Na2O22、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2NaOH +H2↑2Na +2H2O =2Na++2OH-+H2↑3、钠与盐溶液反应(先水后盐)(1)与氯化钠溶液:本质上就是与水反应(2)与硫酸铜溶液:2Na +2H2O =2NaOH +H2↑2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4总:2Na +2H2O + CuSO4=Cu(OH)2↓+ Na2SO4+H2↑2Na +2H2O+ Cu2+ =Cu(OH)2↓+H2↑+ 2Na+(3)与氯化铁溶液:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na+ +3H2↑4、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O =4NaOH +O2 ↑2Na2O2+2H2O =4Na++4OH -+O2↑现象:产生大量气泡,带火星的木条复燃,试管外壁发热,滴加酚酞后溶液变红(振荡后褪色)碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH Na2O +H2O =2Na++2OH -5、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+2CO2=2Na2CO3+O2碱性氧化物Na2O与二氧化碳的反应Na2O+CO2===Na2CO36、过氧化钠与盐酸的反应2Na2O2+4HCl =4NaCl +2H2O+O2 ↑2Na2O2+4H+=4Na++2H2O+O2↑碱性氧化物Na2O与盐酸的反应Na2O +2HCl =2NaCl +H2O Na2O +2H+=2Na++H2O7、氢氧化钠(1)与酸性氧化物反应a向NaOH中通入少量CO2:2NaOH+ CO2 (少量)== Na2CO3 + H2OOH -+CO2 (少量)= CO32-+H2Ob 继续向该溶液中通入CO2:Na2CO3+H2O +CO2=2NaHCO3CO32-+H2O +CO2=2HCO3-c向NaOH中通入过量CO2:NaOH+ CO2(过量)== NaHCO3a+bOH -+CO2 (过量)= HCO3-d向Ca(OH)2中通入少量CO2:CO2+Ca(OH)2(过量)===CaCO3↓+H2OCa2++ 2OH -+CO2 (少量)= CaCO3↓+H2Oe继续向该溶液中通入CO2:CaCO3+H2O +CO2=Ca(HCO3)2CaCO3+H2O +CO2=Ca2++ 2HCO3-f向Ca(OH)2中通入过量CO2:2CO2(过量)+Ca(OH)2===Ca(HCO3)2 d+eOH -+CO2 (过量)= HCO3-CaCl2不与CO2反应:因为一般情况下弱酸不能制强酸8、苏打(纯碱)与盐酸反应(根据滴加顺序不同,现象不同,所以可以鉴别盐酸和碳酸氢钠)①向盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑CO32-+2H+=H2O +CO2↑现象:立即有气泡产生②纯碱溶液中滴加盐酸,至过量△△.Na2CO3+HCl =NaHCO3+NaCl CO32-+H+ =HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑现象:先无明显现象,然后有气泡产生9、碳酸氢钠和盐酸反应(无论是向碳酸氢钠中滴加稀盐酸还是向盐酸中滴加碳酸氢钠,现象均为:立即有气泡产生)NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑10、碳酸钠与Ca(OH)2反应:Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓CO32-+Ca2+ = CaCO3↓11、碳酸氢钠与碱反应(1)与NaOH反应:NaHCO3 + NaOH== Na2CO3 + H2OHCO3-+OH -=H2O +CO32-(2)与Ca(OH)2反应Ca(OH)2 + NaHCO3(少)==CaCO3↓+ H2O+ NaOHCa2+ +OH -+HCO3-(少)==CaCO3↓+ H2OCa(OH)2 + 2NaHCO3(多)== CaCO3↓ + 2H2O+Na2CO3Ca2+ +2OH -+2HCO3-(多)== CaCO3↓ + 2H2O+CO32-12、碳酸钠与某些盐反应Na2CO3+CaCl 2== CaCO3↓+2NaCl CO32-+Ca2+ = CaCO3↓NaHCO3+CaCl 2== 不反应(可用于鉴别碳酸钠和碳酸氢钠)13、小苏打受热分解2NaHCO3=Na2CO3+H2O +CO2↑14、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离子方程式)二、铝及其化合物1、与非金属4Al + 3O2 = 2Al2O32Al+3Cl2 == 2AlCl32Al + 3S == Al2S32、铝片与稀盐酸反应2Al +6HCl =2AlCl3 +3H2↑2Al +6H+=2Al3++3H2↑3 、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH-+2H2O =2AlO2-+3H2↑4、与盐溶液反应:置换出较不活泼的金属单质2Al+3CuSO4 ==Al2(SO4 )3+3Cu 2Al+3Cu2+ = 2Al3++3Cu5、与水不反应:6、Al2O3(两性氧化物)(1)与强酸反应Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+ = 2Al3++3H2O(2)与强碱反应Al2O3+2NaOH = 2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O7. Al(OH)3(两性氢氧化物)(1)Al(OH)3的制备:可溶性铝盐和氨水Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+(2)与强酸反应Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O (3)与强碱反应Al(OH)3+NaOH =NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O (4)加热分解2Al(OH)3△Al2O3 + 3H2O8、Al3+(1)少量强碱:AlCl3+3NaOH===Al(OH)3↓+3N aCl Al3++3OH-=Al(OH)3↓(2)过量强碱:AlCl3+4NaOH===NaAlO2 +3NaCl+2 H2OAl3++4OH-=AlO2-+2 H2O9、AlO2-(1)少量HCl:NaAlO2 +HCl+H2O=NaCl+Al(OH)3↓AlO2-+H++H2O=Al(OH)3↓(2)继续向该溶液中加入盐酸:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O△点燃△.(3)过量HCl:NaAlO2+4HCl=NaCl+AlCl3+2H2O AlO2-+4H+=Al3++2 H2O(4)通入少量CO2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(5)通入过量CO2CO2+NaAlO2+2H2O=Al(OH)3↓+Na HCO3 (工业制取氢氧化铝)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-10、KA1(SO4)2 (净水剂)(1)使硫酸根恰好沉淀完全: KA1(SO4)2+2Ba(OH)2==2BaSO4↓+KAlO2Al3++4OH-+2Ba2++2SO42-==2BaSO4↓+AlO2-(2)使铝离子恰好沉淀完全: 2KA1(SO4)2+3Ba(OH)2==2Al(OH)3↓+3BaSO4↓+K2SO42Al3++ 3 SO42- + 6OH—+ 3Ba2+==3Ba SO4↓+ 2Al(OH)3↓(3)净水原理:Al3++3H2O=== Al(OH)3(胶体)+3 H+11、相互滴加顺序不同而现象不同的几组反应:(可用于鉴别)①:AlCl3+ NaOH ②:NaAlO2 + HCl ③:Na2CO3+ HCl (NaHSO4)三、铁及铁的化合物1、铁的冶炼: 3CO+ Fe2O3== 2Fe+ 3CO22、与非金属:(1)2Fe + 3Cl2 === 2FeCl3(2)3 Fe + 2O2=== Fe3O4(3)Fe + S === FeS3、与水蒸气:3 Fe + 4 H2O(g) ====Fe3O4+ 4 H24、与非氧化性酸:Fe + 2 HCl === FeCl2+ H2↑Fe + 2 H+ == Fe2++ H2↑5、与盐:Fe + CuSO4 == FeSO4+Cu Fe + Cu2+===Fe2+ + Cu6、与碱不反应:7、铁的氧化物FeO(黑色)、Fe2O3(红棕色,俗名铁红)、Fe3O4(磁性氧化铁,黑色晶体)(1)FeO + 2 HCl === FeCl2 + H2O(非氧化性酸,不变价;遇HNO3变价,下同)FeO + 2 H+ == Fe2+ + H2O(2)Fe2O3 + 6HCl ===2 FeCl3 + 3 H2OFe2O3 + 6 H+ ===2 Fe3+ + 3 H2O(3)Fe3O4+ 8 HCl ===2 FeCl3 + FeCl2 + 4 H2OFe3O4+ 8 H+ === 2 Fe3+ +Fe2+ + 4 H2O用途:作油漆的颜料,炼铁的原料8、铁的氢氧化物(Fe(OH)2,Fe(OH)3)(1)制备:A:FeSO4 + 2 NaOH = Fe(OH)2↓+ Na 2SO4Fe2+ + 2 OH—= Fe(OH)2↓B:3NH3 .H2O + FeCl3 ==== Fe(OH)3↓+ 3 NH4CIFe3+ + 3NH3 .H2O =Fe(OH)3↓+ 3 NH4+(2)氢氧化亚铁不稳定性:4 Fe(OH)2 + O2 + 2 H2O= 4 Fe(OH)3(3)氢氧化铁不稳定性:2Fe(OH)3 ==== Fe2O3 + 3H2O(4)与酸:Fe(OH)3+ 3HCl ====FeCl3+ 3 H2O Fe(OH)3+ 3 H+ === Fe3+ + 3 H2O Fe(OH)2+ 2 HCl ==== FeCI2+ 2 H2O(非氧化性酸,不变价;遇HNO3变价)Fe(OH)2 + 2 H+ == Fe2+ + 2H2O9、Fe2+盐(还原性离子,易被氧化,保存需加少量Fe粉及相应酸)(1)与氯气:2FeCl2 + Cl2 = 2 FeCl3 2Fe2+ + Cl2 === 2Fe3+ + 2 CI—(2)FeSO4溶液和H2O2:2Fe2+ + H2O2 + 2H+== 2Fe3+ + 2H2O(3)FeSO4溶液和酸性KMnO4溶液:5 Fe2+ + MnO4—+8 H+=== Mn 2++ 4H2O+ 5Fe3+(4)FeSO4溶液在空气中变质:4Fe2+ + O2 + 4 H+=== 4Fe3+ + 2H2O10、Fe3+盐(氧化性离子,易被还原. 易水解,保存需加少量相应酸抑制水解.)(1) 2 FeCl3 + Fe =3 FeCl22Fe3+ + Fe === 3 Fe2+(2)2 FeCl3+ Cu === 2FeCl2+ CuCl22Fe3+ + Cu ==2Fe2++ Cu2+(3)Fe3+的检验:FeCl3 + 3 KSCN == 3 KCI+ Fe(SCN)3Fe3+ + 3SCN— === Fe(SCN)3(4)用途:净水剂Fe3+ +3 H2O=== Fe(OH)3(胶体)+ 3 H+高温点燃点燃△高温△.。
高中化学方程式大全一、氧化还原反应方程式1.金属与非金属的氧化反应例如:2Na+Cl₂→2NaCl2Mg+O₂→2MgO2.金属与酸的反应例如:Zn+2HCl→ZnCl₂+H₂3.金属与水的反应例如:2Na+2H₂O→2NaOH+H₂4.非金属与氧气的反应例如:C+O₂→CO₂5.过氧化氢分解例如:2H₂O₂→2H₂O+O₂6.还原剂与氧化剂的反应例如:Cl₂+2KBr→2KCl+Br₂二、酸碱中和反应方程式1.强酸与强碱的中和反应例如:HCl+NaOH→NaCl+H₂O2.强酸与弱碱的中和反应例如:HCl+NH₄OH→NH₄Cl+H₂O3.弱酸与弱碱的中和反应例如:CH₃COOH+NH₄OH→CH₃COONH₄+H₂O三、水解反应方程式1.盐的水解例如:NaCl+H₂O→NaOH+HCl2.酸酐的水解例如:(CH₃CO)₂O+H₂O→2CH₃COOH3.酯的水解例如:CH₃COOCH₃+H₂O→CH₃COOH+CH₃OH四、氧气化反应方程式1.元素与氧气的直接反应例如:S+O₂→SO₂C+O₂→CO₂2.含氢的有机物燃烧反应例如:CH₄+2O₂→CO₂+2H₂O五、重组反应方程式1.单质重组反应例如:2Na+Cl₂→2NaClN₂+3H₂→2NH₃2.高低价金属的重组反应例如:Cu+2AgNO₃→Cu(NO₃)₂+2Ag3.过氧化物分解例如:2H₂O₂→2H₂O+O₂六、酸反应方程式1.均一催化酸解例如:2H₂O₂→2H₂O+O₂2.酸与金属氧化物反应例如:2HCl+Mg(OH)₂→MgCl₂+2H₂O七、氧化反应方程式1.金属与氧反应生成金属氧化物例如:2Na+O₂→2Na₂O2.非金属与氧反应生成非金属氧化物例如:C+O₂→CO₂八、盐酸与金属氧化物反应方程式例如:2HCl+CuO→CuCl₂+H₂O九、铜与含氧化剂的反应方程式例如:2Cu+O₂→2CuO。
高一必修一化学方程式大全1、金属钠投到硫酸铜溶液中的化学方程式:2Na+2H2O=2NaOH+H21CuSO4+2NaOH=Cu(OH) 21+ Na2SO4 (先冒气泡再蓝色沉淀)2、金属钠与盐酸的化学方程式: 2Na+2HCl=2NaCl+H213、氢氧化钠方在空气中变质的化学方程式:2NaOH+CO2=Na2CO3+H2ONa2CO3+10H2O=Na2CO3-10H 204、金属钠放在空气的氧化: 4Na+O2-2Na20 (银白色变暗)5、金属钠在空气燃烧: 2Na+O2=Na202△(生成淡黄色粉末)6、过氧化钠在空气中变质:2Na202+2H2O=4NaOH+O212Na202+2CO2=2Na2CO3+027、过氧化钠与酸反应: 2Na202+4HCl=4NaCl+2H20+0218、氧化钠在空气中变质:Na20+H2O=2NaOHNa20+CO2=Na2CO39、氧化钠与酸反应: Na20+2HCl=2NaCl+H2O10、氧化钠在空气中燃烧: 2Na2O+O2=2Na20211、氯气与铁的反应方程式: 2Fe+3Cl2-2FeCl3点燃(红棕色的烟)12、氯气与铜的反应方程式:Cu+Cl2=CuCl2 点燃(棕黄色的烟)13、氯气与氢气的反应方程式: C12+H2=2HC1点燃(苍日色火焰,生成日雾)14、氯气与钠单质的反应方程式: 2Na+Cl2=2NaCl点燃(淡黄色的烟)15、工业制漂白:2CI2+2Ca(OH) 2=CaCI2+Ca(CIO) 2+2H2O (为Ca(OH) 2石灰乳)16、氯气与水的方程式: Cl2+H2O=HCI+HCIO17、消毒、处理多余的氯气、制84消毒液:Cl2+2NaOH=NaCIO+NaCl+H2O18、次氯酸钠在空气中变质:2NaClO+CO2+H2O=2HCIO+Na2CO3NaCIO+CO2+H2O=HCI O+NaHCO319、漂白在空气中变质: Ca(ClO) 2+CO2+H2O=CaCO31+2HCIO20、次氯酸见光分解:2HCIO=2HCl+O21 光照21、氯化铁通入沸水中制氢氧化铁胶体:FeCI3+3H2O=Fe(OH) 3 (胶体)+3HCI Δ22、碳酸钠与盐酸的反应方程式:Na2CO3+2HCI(过)=2NaCl+CO21+H2ONa2CO3+HCI(少)=Na HCO3+NaCl23、碳酸氢钠与盐酸的反应方程式:NaHCO3+HCl=NaCl+H2O+CO2124、碳酸氢钠与碱反应方程式:NaHCO3+NaOH=Na2CO3+H2ONaHCO3+Ca(OH) 2=2H2O+Na2CO3+CaCO31 25、碳酸氢钠受热易分解: 2NaHCO3=Na2CO3+CO21+H2OA 26、二氧化碳通入碳酸钠溶液中: Na2CO3+CO2+H2O=2NaHCO3 27、浑浊石灰水变澄清: CO2+CaCO3+H2O=Ca(HCO3) 2 28、碳酸氢钙受热分解: Ca(HCO3) 2= CO21+CaCO3+H2O△29、氢氧化亚铁在空气中变质:4Fe(OH) 2+O2+2H2O=4Fe(OH) 3 (由白色沉淀变成灰绿色再变成红褐色沉淀) 30、保存氯化亚铁溶液:2FeCI3+Fe=3FeCI2 2Fe3++Fe=3Fe2+ 31、制造印刷线路板: 2FeCI3+Cu=2FeCl2+CuCI2 2Fe3++Cu=2Fe2++Cu2+ 32, 2FeCl2+Cl2=2FeCl3 2Fe2++Cl2=2Fe3++2Cl- 33、Fe203+3CO=2Fe+3CO2高温34, Ba2++SO42+=BaSO41 Ag++Cl-=AgCII 35、Zn+Cu2+=Zn2++Cu Zn+Fe2+=Zn2++Fe。
高一化学必修一化学方程式总结在高一化学必修一中,我们学习了众多重要的化学方程式,这些方程式是理解化学知识的关键。
下面就为大家详细总结一下。
一、金属及其化合物相关的化学方程式1、钠及其化合物(1)钠在空气中燃烧:2Na + O₂=点燃= Na₂O₂(2)钠与水反应:2Na + 2H₂O = 2NaOH + H₂↑(3)过氧化钠与水反应:2Na₂O₂+ 2H₂O = 4NaOH + O₂↑(4)过氧化钠与二氧化碳反应:2Na₂O₂+ 2CO₂= 2Na₂CO₃+ O₂2、铝及其化合物(1)铝与氧气反应:4Al + 3O₂= 2Al₂O₃(2)铝与盐酸反应:2Al + 6HCl = 2AlCl₃+ 3H₂↑(3)铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H₂O =2NaAlO₂+ 3H₂↑(4)氧化铝与盐酸反应:Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O+ H₂O(6)氢氧化铝与盐酸反应:Al(OH)₃+ 3HCl = AlCl₃+ 3H₂O (7)氢氧化铝与氢氧化钠溶液反应:Al(OH)₃+ NaOH =NaAlO₂+ 2H₂O3、铁及其化合物(1)铁与氧气反应:3Fe + 2O₂=点燃= Fe₃O₄(2)铁与盐酸反应:Fe + 2HCl = FeCl₂+ H₂↑(3)铁与硫酸铜溶液反应:Fe + CuSO₄= FeSO₄+ Cu(4)氧化亚铁与盐酸反应:FeO + 2HCl = FeCl₂+ H₂O(5)氧化铁与盐酸反应:Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O (6)四氧化三铁与盐酸反应:Fe₃O₄+ 8HCl = FeCl₂+2FeCl₃+ 4H₂O(7)氢氧化亚铁与氧气、水反应:4Fe(OH)₂+ O₂+ 2H₂O =4Fe(OH)₃二、非金属及其化合物相关的化学方程式1、硅及其化合物(1)硅与氧气反应:Si + O₂=高温= SiO₂(2)二氧化硅与氢氟酸反应:SiO₂+ 4HF = SiF₄↑ + 2H₂O+ H₂O(4)硅酸钠溶液与盐酸反应:Na₂SiO₃+ 2HCl = 2NaCl +H₂SiO₃↓2、氯及其化合物(1)氯气与金属钠反应:2Na + Cl₂=点燃= 2NaCl(2)氯气与金属铁反应:2Fe + 3Cl₂=点燃= 2FeCl₃(3)氯气与氢气反应:H₂+ Cl₂=点燃= 2HCl(4)氯气与水反应:Cl₂+ H₂O = HCl + HClO(5)次氯酸光照分解:2HClO =光照= 2HCl + O₂↑(6)氯气与氢氧化钠溶液反应:Cl₂+ 2NaOH = NaCl + NaClO + H₂O3、硫及其化合物(1)硫在氧气中燃烧:S + O₂=点燃= SO₂(2)二氧化硫与水反应:SO₂+ H₂O ⇌ H₂SO₃(3)二氧化硫与氧气反应:2SO₂+ O₂⇌ 2SO₃(4)三氧化硫与水反应:SO₃+ H₂O = H₂SO₄(5)铜与浓硫酸反应:Cu + 2H₂SO₄(浓) =△= CuSO₄+SO₂↑ + 2H₂O(6)碳与浓硫酸反应:C + 2H₂SO₄(浓) =△= CO₂↑ + 2SO₂↑ + 2H₂O4、氮及其化合物(1)氮气与氧气反应:N₂+ O₂=放电= 2NO(2)一氧化氮与氧气反应:2NO + O₂= 2NO₂(3)二氧化氮与水反应:3NO₂+ H₂O = 2HNO₃+ NO(4)氨气与水反应:NH₃+ H₂O ⇌ NH₃·H₂O(5)氨气与盐酸反应:NH₃+ HCl = NH₄Cl(6)氯化铵受热分解:NH₄Cl =△= NH₃↑ +HCl↑(7)碳酸氢铵受热分解:NH₄HCO₃=△= NH₃↑ + CO₂↑ +H₂O(8)硝酸铵与氢氧化钠反应:NH₄NO₃+ NaOH =△= NH₃↑ + NaNO₃+ H₂O(9)铜与浓硝酸反应:Cu + 4HNO₃(浓) = Cu(NO₃)₂+ 2NO₂↑ + 2H₂O(10)铜与稀硝酸反应:3Cu + 8HNO₃(稀) = 3Cu(NO₃)₂+2NO↑ + 4H₂O这些化学方程式在高一化学学习中非常重要,同学们一定要牢记并理解其反应原理,通过多做练习来熟练掌握,为后续的化学学习打下坚实的基础。
高中化学方程式总结大全一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H)1、氧化性:F2+H2===2HF (阴暗处爆炸)F2+Xe(过量)==XeF22F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–)nF2+2M===2MFn(M表示大部分金属)2F2+2H2O===4HF+O2(水是还原剂)2F2+2NaOH===2NaF+OF2+H2OF2+2NaCl===2NaF+Cl2F2+2NaBr===2NaF+Br2F2+2NaI===2NaF+I27F2(过量)+I2===2IF7F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO )3F2(过量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 )Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl3Cl2+2Fe2FeCl3Cl2+Cu CuCl2Cl2+2FeCl2===2FeCl3(在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-)Cl2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl-+Br2Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I23Cl2(过量)+2KI+3H2O===6HCl+KIO33Cl2+I–+3H2O=6H++6Cl–+IO3–5Cl2+I2+6H2O===2HIO3+10HCl5Cl2+I2+6H2O=10Cl–+IO3–+12H+Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓Cl2+H2S===2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl–+S↓Cl2+SO2+2H2O===H2SO4+2HClCl2+SO2+2H2O=4H++SO42–+2Cl–Cl2+H2O2===2HCl+O2Cl2+H2O2=2H++Cl–+O22O2+3Fe Fe3O4O2+K===KO2S+H2H2S 2S+C CS2S+Zn ZnSS+Fe FeS (既能由单质制取,又能由离子制取)S+2Cu Cu2S (只能由单质制取,不能由离子制取)3S+2Al Al2S3(只能由单质制取,不能由离子制取)N2+3H2催化剂高温高压2NH3N2+3Mg Mg3N2N2+3Ca Ca3N2N2+3Ba Ba3N2N2+6Na2Na3N N2+6K2K3NN2+6Rb2Rb3N N2+2Al2AlNP4+6H24PH3P+3Na Na3P 2P+3Zn Zn3P2H2+2Li2LiH2、还原性S+O2SO2S+H2SO4(浓)3SO2↑+2H2OS+6HNO3(浓)H2SO4+6NO2↑+2H2OS+4H++6==6NO2↑+2H2O+-24SO3S+4HNO3(稀)3SO2+4NO↑+2H2O3S+4H++4-3NO3SO2+4NO↑+2H2ON2+O2 2NO4P+5O2P4O10(常写成P2O5)2P+3X22PX3(X表示F2,Cl2,Br2)PX3+X2 PX5P4+20HNO3(浓)4H3PO4+20NO2↑+4H2OC+2F2CF4C+2Cl2CCl4C+O2(足量)CO2 2C+O2(少量)2COC+CO22CO C+H2O CO+H2(生成水煤气)2C+SiO2Si+2CO(制得粗硅)Si(粗)+2Cl2SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2SiO2 Si+C SiC(金刚砂)Si+2NaOH+H2O==Na2SiO3+2H2↑(Si+2OH-+H2O=-23SiO+2H2↑)3、歧化反应Cl2+H2O==HCl+HClO(加碱或光照促进歧化:(Cl2+H2O H++Cl–+HClO) Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O)Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O)3Cl2+6KOH(浓)5KCl+KClO3+3H2O (3Cl2+6OH–5Cl–+ClO3–+3H2O) 3S+6NaOH2Na2S+Na2SO3+3H2O (3S+6OH–2S2–+SO32–+3H2O)4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2(4P+3OH–+3H2O==PH3↑+3H2PO2–) 11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO43C+CaO CaC2+CO↑3C+SiO2SiC+2CO↑二.金属单质(Na,Mg,Al,Fe,Cu)的还原性2Na+H22NaH 4Na+O2==2Na2O 2Na2O+O22Na2O22Na+O2Na2O2 2Na+S==Na2S(爆炸)2Na+2H2O==2NaOH+H2↑2Na+2H2O=2Na++2OH―+H2↑2Na+2NH3==2NaNH2+H2↑2Na+2NH3=2Na++2NH2―+H2↑4Na+TiCl44NaCl+Ti Mg+Cl2MgCl2Mg+Br2MgBr22Mg+O22MgO Mg+S MgS2Cu+S Cu2S (Cu2S只能由单质制备)Mg+2H2O Mg(OH)2+H2↑2Mg+TiCl4Ti+2MgCl2Mg+2RbCl MgCl2+2Rb2Mg+CO22MgO+C 2Mg+SiO22MgO+SiMg+H2S==MgS+H2Mg+H2SO4==MgSO4+H2↑(Mg+2H+=Mg2++H2↑)2Al+3Cl22AlCl34Al+3O2===2Al2O3 (常温生成致密氧化膜而钝化,在氧气中燃烧)4Al(Hg)+3O2+2xH2O===2(Al2O3。
金属一、碱金属 1.钠4Na+O =2Na O 2 22Na+O 2 点燃 Na 2O 2Cl 2+2Na 点燃 2NaCl 2Na+2H O =2NaOH+H ↑ 4Na+TiCl 4(熔融)=4NaCl+Ti Na O+H O =2NaOH 2 2△2 2 2 2Na O+SO =Na SO 2 3 2 4 Na O+CO =Na CO 2 2 2 3 Na O+2HCl =2NaCl+H O 2 22Na 2O 2+2H 2O = 4NaOH+O 2 ↑ ( 此 反 应 分 两 步Na 2O 2+2H 2O = 2NaOH+H 2O 2 ; 2H 2O 2 = 2H 2O+O 2 ↑。
H 2O 2 的制备可利用类似的反应)2Na O +2CO =2Na CO +O 2 2 2 2 3 2Na 2O 2+H 2SO 4(冷、稀)=Na 2SO 4+H 2O 22NaOH+Si+H O =Na SiO +2H ↑ △2 2 22NaOH+Al O =2NaAlO +H O2 3 2 2 2NaOH+Cl =NaCl+NaClO+H O 2 2 NaOH+HCl =NaCl+H O 23NaOH+AlCl 3 =Al(OH)3 ↓+3NaClNaOH+Al(OH)3=NaAlO 2+2H 2O2NaAlO 2+CO 2+3H 2O =2Al(OH)3 ↓+Na 2CO 33NaAlO +AlCl 3+6H O =4Al(OH)3 ↓Na 2CO 3+SiO 2 高温 Na 2SiO 3+CO 2Na CO +HCl =NaHCO +NaCl 2 3 3 NaHCO +HCl =NaCl+H O+CO3 2 23Na 2CO 3+2AlCl 3+3H 2O = 2Al(OH)3 ↓ +3CO 2 ↑ +6NaCl3Na 2CO 3+2FeCl 3+3H 2O = 2Fe(OH)3 ↓ +3CO 2 ↑ +6NaCl3NaHCO 3+AlCl 3 =Al(OH)3 ↓+3CO 2 ↑ 3NaHCO 3+FeCl 3 =Fe(OH)3 ↓+3CO 2 ↑ NaHCO 3+HCl =NaCl+CO 2 ↑+H 2O 2NaHCO 3△Na 2CO 3+CO 2 ↑+H 2O3Na CO +2Br +H O 2 3 2 23 23 2 2 2.钾2KOH+CO =K CO +H O 2 2 3 2 KOH+CO =KHCO 2 3K 2CO 3+2HCl =2KCl+CO 2 ↑+H 2OK 2CO 3+CaCl 2=CaCO 3 ↓+2KCK 2CO 3+2AgNO 3 =Ag 2CO 3 ↓+2KNO 3KHCO 3+HCl =KCl+CO 2 ↑+H 2O 2KHCO 3 △ K 2CO 3+CO 2 ↑+H 2O3 22KI+Cl 2=2KCl+I 2KI+AgNO 3 =AgI ↓+KNO 32KAl(SO 4)2+6NaOH = K 2SO 4+3Na 2SO 4+2Al(OH)3 ↓2KAl(SO 4)2+3Ba(OH)2 = K 2SO 4+3BaSO 4 ↓ +2Al(OH)3 ↓KAl(SO 4)2+2Ba(OH)2=KAlO 2+2BaSO 4 ↓33锂KSCN+FeCl 3 =Fe(SCN)3+3KCl Li O+CO =Li CO 2 2 2 32NaOH(过量)+CO 2=Na 2CO 3+H 2ONaOH+CO 2(过量)=NaHCO 3蚀2N 玻璃aOH SiO 2=Na 2SiO 3+H 2O (常温下强碱缓慢腐KClO 3+6HCl =KCl+3Cl 2 ↑+3H 2OKClO 3+5KCl+3H 2SO 4=3Cl 2 ↑+3K 2SO 4+3H 2O 2 2 3 22NaOH+2Al+2H O =2NaAlO +3H ↑ NaHCO +Br =NaBr+HBrO+CO ↑ 6NaOH+3S 2Na S+Na SO +3H O 2Na O+O 2Na O 2 2 3 22 2 =2NaHCO +2NaBrO+2NaBr+CO ↑ 2KClO △ 2KCl+3O ↑Li O+H O =2LiOH2 22LiOH+CO 2=Li 2CO 3 ↓+H 2OLiOH+CO =LiHCO 2 3 二、常见金属 1.镁2Mg+O 2 点燃 2MgOMg+2H 2O =2Mg(OH)2 ↓+H 2 ↑ Mg+Cl 2 点燃 MgCl 2 2Mg+CO 2 点燃 2MgO+C 3Mg+N 2 =Mg 3N 2Mg+2HCl =MgCl 2+H 2 ↑ Mg+H 2SO 4 =MgSO 4+H 2 ↑ 2Mg+TiCl 4(熔融)=Ti+2MgCl 2MgO+2HCl =MgCl 2+H 2O MgO+H 2O =Mg(OH)2 ↓Mg(OH)2+2HCl =MgCl 2+2H 2OMg(HCO 3)2+2HCl =MgCl 2+2CO 2 ↑+2H 2O 2Mg(HCO 3)2△Mg(OH)2 ↓+CO 2 ↑+H 2OMg 3N 2+8H 2O =3Mg(OH)2+2NH 3 ·H 2O2.铝Al+3O 2 点燃 2Al 2O 3△2 3 2Al+3Cl 2AlCl 2 34Al+3MnO 高温 2Al O +3Mn2 2 3高温 Al O +2Cr2 3高温 Al 2O 3+2Fe (铝热反应) Al O +3Fe 2 32Al+6HCl =2AlCl 3+3H 2t2Al+3H 2SO 4=Al 2(SO 4)3+3H 2 t2Al+6H 2SO 4(浓) △ Al 2(SO 4)3+3SO 2 t +6H 2O Al+4HNO 3(稀)=Al(NO 3)3+NO t +2H 2O (Al 、Fe 在Li 2CO 3+2HCl =2LiCl+CO 2 ↑+H 2OLiHCO 3+HCl =LiCl+CO 2 ↑+H 2O 2LiHCO 3 △ Li 2CO 3+CO 2 ↑+H 2O冷、浓的 H 2SO 4 、HNO 3中钝化)2Al+2NaOH+2H 2O =2NaAlO 2+3H 2 tAl 2O 3+3H 2SO 4=Al 2(SO 4)3+3H 2O (Al 2O 3 是两性氧Al O +2NaOH =2NaAlO +H O 2 3 2 22Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3HCl =AlCl 3+3H 2O 2Al(OH)3+3H 2SO 4=Al 2(SO 4)3+6H 2O Al(OH)3+NaOH =NaAlO 2+2H 2OAlCl 3+3NaOH =Al(OH)3 ↓+3NaCl AlCl 3+3NH 3 · H 2O =Al(OH)3 ↓+3NH 4Cl2AlCl +3Na CO +3H O = 2Al(OH)3 ↓ +3CO 2 ↑AlCl 3+3NaHCO 3 =Al(OH)3 ↓+3CO 2 ↑AlCl 3+3NaAlO 2+6H 2O =4Al(OH)3 ↓Al 2(SO 4)3+3Na 2S+6H 2O =2Al(OH)3 ↓+3H 2S ↑3.铁2Fe+3Cl 点燃 2FeCl 2 33Fe+2O 点燃 Fe O2 3 4 △2Fe+3Br =2FeBr 2 3△2 2 △3Fe+4H 2O(g) 高温 Fe 3O 4+4H 2 Fe+2HCl =FeCl +H ↑Fe+CuCl =FeCl +Cu 2 2Fe+H S =FeS+H ↑ 2Fe+6H 2SO 4(浓)=Fe 2(SO 4)3+3SO 2 ↑+6H 2O Fe+H 2SO 4(稀)=FeSO 4+H 2 ↑Fe+6HNO 3 =Fe(NO 3)3+3NO 2 ↑+3H 2O2Al+Cr O 2 32Al+Fe O2 3 2Al+3FeO +6Na C 3l2 3 22Al+3S Al S Fe+S FeS Fe+S FeSFe+I FeI 2 22 2 △△ 化物)Fe+4HNO 3 =Fe(NO 3)3+NO ↑+2H 2O 8Fe+30HNO 3 =8Fe(NO 3)3+3NH 4NO 3+9H 2O Fe+(CH 3COO)2Cu =Cu+(CH 3COO)2FeFe O +2Al 高温 Al O +2Fe2 3 2 3△2 3 2Fe 2O 3+3H 2=2Fe+3H 2O (制还原铁粉)Fe O +6HCl =2FeCl +3H O 2 3 3 2Fe O +4H 3Fe+4H O 3 4 2 2Fe 3O 4+8HCl(浓) △ FeCl 2+2FeCl 3+4H 2O4Fe(OH)2+O 2+2H 2O =4Fe(OH)3 2Fe(OH)3△Fe 2O 3+3H 2O2FeCl +Cl =2FeCl 2 2 3FeCl 2+Mg =Fe+MgCl 2三、其他金属 1.锰4 2 4 2 22CuOCu S2 CuCl 2CH +4CuO =4Cu+CO +2H O 4 2 2△3 2 2CuO+2HCl =CuCl +H O 2 2CuO+H SO =CuSO +H O 2 4 4 2Cu(OH)2+2HCl =CuCl 2+2H 2OCu(OH)2+H 2SO 4=CuSO 4+2H 2O Cu(OH)2△CuO+H 2OCuCl 2+H 2S =CuS ↓+2HCl 2FeCl +Fe =3FeCl 3 22FeCl 3+Cu =2FeCl 2+CuCl 2 (用于雕刻印刷电路板)2FeCl +H SO +H O =H SO +2FeCl +2HCl 3 2 3 2 2 4 2 2FeCl +Zn =2FeCl +ZnCl 3 2 22FeCl +H S =2FeCl +2HCl+S ↓ 2FeCl +2KI =2FeCl +2KCl+I 3 2 2FeCl 3+3NH 3 ·H 2O =Fe(OH)3 ↓+3NH 4Cl2FeCl 3+3Na 2CO 3+3H 2O = 2Fe(OH)3 ↓ +3CO 2 ↑+6NaClFeCl 3+3NaHCO 3 =Fe(OH)3 ↓+3CO 2 ↑2FeCl +SO +2H O =2FeCl +H SO +2HCl 3 2 2 2 2 4BaCl 2+H 2SO 4=BaSO 4 ↓+2HClFeCl 3+3KSCN =Fe(SCN)3+3KClFe 2(SO 4)3+2Ag =FeSO 4+Ag 2SO 4 (较难反应) Fe 3C+22HNO 3 =3Fe(NO 3)3+CO 2+13NO 2+11H 2OCuSO 4+H 2S =CuS ↓+H 2SO 4CuSO 4+2NaOH =Cu(OH)2 ↓+Na 2SO 4 CuSO 4+Ba(OH)2 =Cu(OH)2 ↓+BaSO 4 ↓ 3.钙 CaO+H 2O =Ca(OH)2CaO+SiO 2 高温 CaSiO 32Ca(OH)2+2Cl 2=CaCl 2+Ca(ClO)2+2H 2OCa(OH)2+SO 3=CaSO 4+H 2O和Ca 浓CO H 3+ 3 =Ca(NO 3)2+H 2O+CO 2 ↑(用 HNO 3 CaCO 3+SiO 2 高温 CaSiO 3+CO 2 ↑ CaF 2+H 2SO 4(浓)=CaSO 4+2HF ↑ Ca 3(PO 4)2+3H 2SO 4(浓)=3CaSO 4+2H 3PO 4 Ca 3(PO 4)2+2H 2SO 4(浓)=2CaSO 4+Ca(H 2PO 4)2 Ca 3(PO 4)2+4H 3PO 4 =3Ca(H 2PO 4)2 (重钙) CaH 2+2H 2O =Ca(OH)2+2H 2 ↑CuCl 2+2NaOH =Cu(OH)2 ↓+2NaCl+8H 2O 4 2 2 2 22.铜 2KMnO 4+16HCl =2KCl+2MnCl 2+5Cl 2 ↑+8H 2O 2KMnO +5H O +6HCl = 2KCl+2MnCl +5O ↑ 2KMnO △K MnO +MnO +O ↑ 2Cu+O22Cu+SCu+Cl 23CuO+2NH 3Cu+N +3H O Fe O +3CO 2Fe+3CO 3 2 2△△ △ 性气体2)4 不能制备 H 2S 、HI 、HBr 、SO 2 等还原卤族元素、氮族元素一、卤族元素1.氟=2HF2 22F +2H O=4HF+O4HF+SiO =SiF +2H O2 4 22.氯Cl2+H2=2HCl (光照或者点燃)Cl +2Na 2NaCl23Cl +2P 2PCl2 3Cl +PCl PCl2 3 53Cl +2Fe 2FeCl2 3Cl +Cu CuCl2 2Cl +2FeCl =2FeCl2 2 32Cl +2NaBr=Cl +2KI=2KCl+I2 25Cl +I +6H O=2HIO +10HCl2 2 2 3Cl +Na S=2NaCl+S ↓2 2Cl +SO +2H O=H SO +2HCl2 2 2 2 4Cl +H SO +H O=H SO +2HCl2 23 2 2 4Cl +H O=HCl+HClO2 2Cl +H O =2HCl+O2 2 2 2Cl +2NaOH=NaCl+NaClO+H O2 22Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热、浓)=5KCl+KClO3+3H2O=2AlCl +3H ↑2HCl+Fe=FeCl +H ↑4HCl(浓)+MnO2△ MnCl2+Cl2+2H2O4HCl(g)+O2△ 2Cl2+2H2O16HCl+2KMnO =2KCl+2MnCl +5Cl +8H O4 2 2 214HCl+K Cr O =2KCl+2CrCl +3Cl +7H O2 2 73 2 2HCl+NH3=NH4Cl (白烟)2HCl+FeO=FeCl +3H O2 2二、氮族元素1.氮N +3H 2NH2 2 36HCl+Fe2O3=2FeCl3+3H2O8HCl(浓)+Fe3O4△ FeCl2+2FeCl3+4H2OHCl+Na PO =Na HPO +NaCl3 4 2 4HCl+Na HPO =NaH PO +NaCl2 4 2 4HCl+NaH PO =H PO +NaCl2 43 4HCl+Na CO =NaHCO +NaCl2 3 3HCl+NaHCO =NaCl+H O+CO3 2 2HClO=HCl+O ↑3.溴△2 2Br +Fe=FeBr2 3Br +2FeBr =2FeBr2 2 3Br +NaI=NaBr+I2 2Br +HI=HBr+I2 2Br +H O=HBr+HBrO2 2Br +NaOH=NaBr+NaBrO+H O2 2Br +SO +2H O=H SO +2HBr2 2 2 2 4Br2+H2S=S ↓+2HBr2Br +3Na CO +H O2 23 23 2HBr+NaOH=NaBr+H O22HBr+Cl =2HCl+Br2 24.碘2HII +Fe FeI2 2I +2NaOH=NaI+NaIO+H O2 2△2HI+Cl =2HCl+I2 2HI+NaOH=NaI+H O2催化剂高温、高压2NO=2 2Cl +H S=2HCl+S ↓22NaCl+Br2Br +H 2HBrI +H2 2N +O2 2H +I2 23 22HI2 222NaHCO +2NaBrO+2NaBr+CO ↑N 2+3Mg 点燃 Mg 3N 2N 2+6Na =2Na 3N2NO+O =2NO 2 2收尾NO+O 中2的+2N Na O O 和H =2 (用于制硝酸工业中吸6NO+4NH 催化剂 5N +6H O 3 2 2△O 鉴2+别2溴KI 蒸+H 气2O 和=2+2KOH (不能用淀粉 KI 溶 4NO +H S =4NO+SO +H O 2 2 3 2NO +SO =SO +NO 2 2 3 3NO +H O =2HNO +NO 2 2 3N O +H O =2HNO2 5 2 33HNO 3+Ag 3PO4=H 3PO 4+3AgNO 3Al+4HNO 3(稀)=Al(NO 3)3+NO ↑+2H 2O3As S +28HNO +4H O = 6H AsO +9H SO +28NO2 3 3 2 3 4 2 44HNO 3(浓)+C △CO 2 ↑+4NO 2 ↑+2H 2O 2HNO 3+CaCO 3 =Ca(NO 3)2+H 2O+CO 2 ↑ 6HNO 3+Fe =Fe(NO 3)3+3NO 2 ↑+3H 2O 4HNO 3+Fe =Fe(NO 3)3+NO ↑+2H 2O 30HNO 3+8Fe =8Fe(NO 3)3+3N 2O ↑+15H 2O 36HNO 3+10Fe =10Fe(NO 3)3+3N 2 ↑+18H 2O 30HNO 3+8Fe =8Fe(NO 3)3+3NH 4NO 3+9H 2O FeO+4HNO 3 =Fe(NO 3)3+NO 2 ↑+2H 2O 3H 2S+2HNO 3(稀)=3S ↓+2NO+4H 2O 4HNO 3=4NO 2+O 2+2H 2O (见光或者受热分解) H 能3+制H O H 32S =N 、H H4I 、N O Br 、白烟S 2 用HNO 3 和浓 H 2SO 43Na 2S+8HNO 3(稀)=6NaNO 3+2NO+3S ↓+4H 2O3Na 2SO 3+2HNO 3(稀)=3Na 2SO 4+2NO ↑+H 2O 3Cu 2S+22HNO 3 = 6Cu(NO 3)2+10NO ↑ +3H SO +8H O2 4 25HNO 3(浓)+P =H 3PO 4+5NO 2 ↑+H 2O P 4+20HNO 3(浓)=4H 3PO 4+20NO 2+4H 2O S+6HNO 3(浓)=H 2SO 4+6NO 2 ↑+2H 2O 3S+4HNO 3(稀)=3SO 2 ↑+4NO ↑+2H 2O碳族元素、氧族元素S+6HNO 3(浓)=H 2SO 4+6NO 2 ↑+2H 2O3As 2S 3+28HNO 3( 稀 )+4H 2O6H 3AsO 4+9H 2SO 4+28NO ↑As 2S 3+28HNO 3( 浓) =2H 3AsO 4+3H 2SO 4+28NO 2 ↑+8H 2O△3 2 22NH +3Cl =N +6HCl 3 2 2 8NH +3Cl =N +6NH Cl 3 2 2 44NH 3+3O 2(纯氧) 点燃 2N 2+6H 2O4NH +5O 催化剂 4NO+6H O 3 2 2△4NH 3+6NO 催化剂 5N 2+6HO (用氨清除 NO )△NH 3+HCl =NH 4Cl (白烟)NH 3+HNO 3=NH 4NO 3 (白烟) 2NH 3+H 2SO 4 =(NH 4)2SO 4H 法3+NaCl+H 2O+CO 2=NaHCO 3 ↓+NH 4Cl (侯氏制 2NH 3+SO 2+H 2O =(NH 4)2SO 3NH 3 ·H 2O △NH 3 ↑+H 2O NH +H O NH ·H O NH Cl =NH +HCl4 3 2NH 4Cl+Ca(OH)2 △CaCl 2+NH 3 ↑+H 2ONH 4Cl+NaOH △NaCl+NH 3 ↑+H 2ONH Cl+NaOH =NaCl+NH ·H O 2.磷P 2O 5+H 2O(冷)=2HPO 3燥+3 2 O(热)=2H 3PO 4 (P 2O 5 极易吸水、可作气P 2O 5+3H 2SO 4(浓)=2H 3PO 4+3SO 3P O +2NaOH =2NaPO +H O 2 5 3 2P O +6NaOH =2Na PO +3H O2 53 3 24H 3PO 4+Ca 3(PO 4)2 =3Ca(H 2PO 4)2 H 3PO 4(浓)+NaBr =NaH 2PO 4+HBr H 3PO 4(浓)+NaI =NaH 2PO 4+HI2NH +3CuO 3Cu+N +3H O 4 3 2NH 4++OH -3 2 3 2↑=2 2P 4S 3+38HNO 3+8H 2O =9H 2SO 4+12H 3PO 4+38NO ↑一、碳族元素 1.碳C+2F 2=CF 4C+2Cl =CCl 2 42C+O 2(少量) 点燃 2CO C+O 2(足量) 点燃 CO 2 △2C+H 2O 高温 CO+H 2 (生成水煤气)2C+SiO 2 △ Si+2CO (制得粗硅)C+Si C+2S△ △SiC (金刚砂) CS 23C+CaO 电炉CaC 2+CO ↑ 3C+SiO 电炉SiC+2CO ↑C+2H 2SO 4(浓) △ CO 2 ↑+2SO 2 ↑+2H 2O △CO 2 ↑+4NO 2 ↑+2H 2O2CO+O 点燃 2CO2 2△23CO+Fe O 2Fe+3CO 2 3 2CO+H O 催化剂 CO +H2 2 2△CO 2+2Mg 点燃 2MgO+CCO +H O =H CO 2 2 2 3CO 2+2NaOH(过量)=Na 2CO 3+H 2O CO 2(过量)+NaOH =NaHCO 3CO 2+Ca(OH)2(过量)=CaCO 3 ↓+H 2O 2CO 2(过量)+Ca(OH)2 =Ca(HCO 3)2二、氧族元素 1.氧2H O 2O +K 22O +3Fe2O +S 点燃 2 O +N 2 2KO 2点燃 Fe O3 4SO22NO 2O 3CO 2+2NaAlO 2+3H 2O =2Al(OH)3 ↓+Na 2CO 3CO +C H ONa+H O =C H OH+NaHCO 2 6 5 2 6 5 3CO +Na O =Na CO 2 2 2 32CO +2Na O =2Na CO +ONH 3 N a 2Cl+H 2 O 2=N 3aH 2CO 3 ↓+NH 4Cl (侯氏制H 2CO 3CO 2 ↑+H 2O2.硅 Si(粗)+2Cl 2 △ SiCl 4 SiCl 4+2H 2 △ Si(纯)+4HCl Si(粉)+O 2 △SiO 2Si+C△SiC (金刚砂)Si+2NaOH+H O =Na SiO +2H2 23 2△24HF+SiO =SiF +2H O 2 4 2SiO +2H2 2SiO 2+2MgSiO +CaO 2△△Si+2H O22MgO+SiCaSiO3SiO 2+2NaOH =Na 2SiO 3+H 2O (常温下强碱缓慢腐蚀玻璃) 高温SiO 2+CaCO 3 高温 CaSiO 3+CO 22NaOH+SiO =Na SiO +H O 2 2 3 24P+5O 点燃 2P O2 2 5C+O 2(足量) 点燃 CO 2△2 24Na+O =2Na O 2 2△2 2 2 22F +2H O =4HF+O 2 2 2Cl +H O =HCl+HClO 2 223C+SiO 电炉 SiC+2CO ↑ CO+CuO Cu+CO △2Mg+SiO 2点燃 2MgO+Si C+4HNO 3(浓) O +2H 2 22Na O+O 2Na O 2C+SiO Si+2CO Na SiO +CO2 3 2SiO +Na CO2 2 3C+CO 2CO Si+O SiO 3O2点燃2△高温2Na+2H O =2NaOH+H ↑ Mg+2H 2O =Mg(OH)2+H 2 ↑ 3Fe+4H 2O(g) 高温 Fe 3O 4+4H 2 2H 2O 电解 2H 2 ↑+O 2SO +H O =H SO 2 2 2 3 SO +H O =H SO 3 2 2 43NO +H O =2HNO +NO 2 2 3N O +H O =2HNO2 5 2 3P 2O 5+H 2O(冷)=2HPO 3 P 2O 5+3H 2O(热)=2H 3PO 4CO +H O =H CO 2 2 2 32 2 2 2H O +Cl =2HCl+O 2 2 2 25H O +2KMnO +6HCl = 2MnCl +2KCl+5O ↑+8H 22 O 24 2 2 2.硫S+H 22S+C S+Fe △ △△H S2CS 2FeS△3S+2Al Al S 2 3△S+O 2 点燃 SO 2S+6HNO 3(浓)=H 2SO 4+6NO 2 ↑+2H 2O3S+4HNO 3(稀)=3SO 2 ↑+4NO ↑+2H 2O△2 23 2S+2Na =Na 2S(爆炸) S+Mg =MgS△S+2H 2SO 4(浓)=3SO 2 ↑+2H 2O=3S+2H O 2 2 22SO +O △ 2SO2 2 32SO +O +2H O =2H SO 2 2 2 2 4 SO +Cl +2H O =H SO +2HCl 2 2 2 2 4 SO +Br +2H O =H SO +2HBr 2 2 2 2 4 SO +I +2H O =H SO +2HI 2 2 2 2 4 SO +NO =SO +NO 2 2 3SO +2H S =3S+2H O 2 2 2 SO +H O =H SO 2 2 2 3SO 2+2NH 3+H 2O =(NH 4)2SO 3 SO 2+(NH 4)2SO 3+H 2O =2NH 4HSO 3SO 2+Ca(OH)2=CaSO 3 ↓+H 2O不)能用澄清石灰水鉴别 SO 2 和 CO 2 .可用品红鉴2NaOH+SO 2(少量)=Na 2SO 3+H 2O NaOH+SO 2(足量)=NaHSO 3Cl +SO +2H O =H SO +2HCl 2 2 2 2 4SO +H O =H SO 3 2 2 4SO 3+MgO =MgSO 4SO 3+Ca(OH)2=CaSO 4+H 2OSO +Na O =Na SO 3 2 2 4 SO +2KI =K SO +I 3 2 3 22 2H 2S+Mg =MgS+H 22H 2S+3O 2(足量)=2SO 2+2H 2O 2H 2S+O 2(少量)=2S+2H 2O2H S+SO =3S+2H O 2 2 2H 2S+H 2SO 4(浓)=S ↓+SO 2+2H 2O△2 23H 2S+2HNO 3(稀)=3S ↓+2NO+4H 2O 5H S+2KMnO +3H SO 2 4 2 42MnSO +K SO +5S+8H O4 2 4 23H S+K Cr O +4H SO Cr 22(SO 42)3+ K 22 S 7O 4+ 32S+74H 2OH S+4Na O +2H O =Na SO +6NaOH 2 2 2 2 2 4H S+Fe =FeS+H ↑ H 2S+CuCl 2=CuS ↓+2HClH 2S+2AgNO 3 =Ag 2S ↓+2HNO 3 H 2S+HgCl 2 =HgS ↓+2HClH 2S+Pb(NO 3)2=PbS ↓+2HNO 3H S+4NO =4NO+SO +H O2 23 2H 2SO 3+X 2+H 2O =H 2SO 4+2HX (X 表示 Cl 2、Br 2、 I ) 2H SO +O =2H SO 2 3 2 2 4H SO +H O =H SO +H O 2 3 2 2 2 4 2H S+Cl =2HCl+S ↓ 2H O =2H O+O ↑ 3S+6NaOH 2Na S+Na SO +3H O S+2Cu Cu S S+Zn ZnSH S H +S S+Fe FeS2 2 2 2 △ ==225H SO +2KMnO 2 3 42MnSO +K SO +2H SO +3H O4 2 4 2 4 2H SO +2FeCl +H O =H SO +2FeCl +2HCl 2 3 3 2 2 4 2H SO =H O+SO ↑ 2H 2SO 3+2H 2S =3S ↓+2H 2O=ZnSO +H ↑ Fe+H SO =FeSO +H ↑Mg+H 22S O 44 =MgS O 44+H 22 ↑2Al+3H 2SO 4=Al 2(SO 4)3+3H 2 ↑2Al+6H 2SO 4(浓) △ Al 2(SO 4)3+3SO 2 ↑+6H 2O 2NH 3+H 2SO 4 =(NH 4)2SO 42Al+6H 2SO 4(浓) △ Al 2(SO 4)3+3SO 2 ↑+6H 2OH 2S+H 2SO 4(浓)=S ↓+SO 2+2H 2O P 2O 5+3H 2SO 4(浓)=2H 3PO 4+3SO 3 BaO 2+H 2SO 4(稀)=BaSO 4+H 2O 2) Na 2O 2+H 2SO 4(冷、稀)=Na 2SO 4+H 2O 2 离子反应(按字母顺序罗列) 2Al+6H +=2Al 3++3H 2 t2Al+2OH -+2H 2O =2 AlO +3H 2 t Al 3++3H 2O Al(OH)3 3H +Al 3++3OH - =Al(OH)3 ↓Al 3++4OH - =AlO +2H 2O3Al 3++10OH -=2A 2l(OH)3 ↓+ AlO +2H 2O (当n (AlCl 3)/n (NaOH)=3:10 时)Al 3++3NH 3 ·H 2O =Al(OH)3 ↓+3 NH 4+2Al 3++3 CO 2 +3H 2O =2Al(OH)3 ↓+3CO 2 tAl 3++3 HCO 3=Al(OH)3 ↓+3CO 2 tAl 3++3HS -+ 33H 2O =Al(OH)3 ↓+3H 2S t 2Al 3++3S 2-+6H 2O =2Al(OH)3 ↓+3H 2S t Al 3++3 AlO +6H 2O =4Al(OH)3 ↓ 2Al 3++3SiO 2 =Al 2(SiO 3)2 ↓AlO +2H 2 O 3Al(OH)3+OH - AlO +H ++H 2O =Al(OH)3 ↓ AlO +4H +=Al 3++2H 2O 9 Al O 2+30H + =2Al(OH)3 ↓+7Al 3++12H 2O (当 n (NaAlO 2)/n (HCl)=3:10 时)3 AlO +Fe 3++6H 2O =Fe(OH)3 ↓+3Al(OH)3 ↓ AlO + NH 4++H 2O =Al(OH)3 ↓+NH 3 ↑AlO + HCO +H 2O =Al(OH)3 ↓+ CO 322 AlO +CO 2+3H 2O =2Al(OH)3 ↓+ CO 32AlO +CO 2+2H 2O =Al(OH)3 ↓+ HCO Al O +6H +=2Al 3++3H O Al 2O 3+2OH -=2 AlO +H 2OAl(OH)3+3H +=Al 3++2H 2O= MgO+H 2SO 4 =MgSO 4+H 2OAl 2O 3+3H 2SO 4=Al 2(SO 4)3+3H 2O 2H 2SO 4(浓)+C △ CO 2 ↑+2SO 2 ↑+2H 2O 2H 2SO 4(浓)+S =3SO 2 ↑+2H 2O6H 2SO 4(浓)+2Fe =Fe 2(SO 4)3+3SO 2 ↑+6H 2O2H 2SO 4(浓)+Cu △ CuSO 4+SO 2 ↑+2H 2O H 2SO 4(浓)+2HBr △ SO 2+Br 2+2H 2O H 2SO 4(浓)+2HI △ SO 2+I 2+2H 2O H 2SO 4(浓)+CaF 2=CaSO 4+2HF ↑ H 2SO 4(浓)+NaCl △ NaHSO 4+HCl ↑ H 2SO 4(浓)+2NaCl Na 2SO 4+2HCl H 2SO 4(浓)+NaNO 3 △ NaHSO 4+HNO 3 ↑ 3H 2SO 4(浓)+Ca 3(PO 4)2=3CaSO 4+2H 3PO 4 2H 2SO 4(浓)+Ca 3(PO 4)2=2CaSO 4+C a (H 2PO 4)2Al(OH)3+2OH - =AlO +2H 2OAg ++H 2O AgOH+H +Ag ++NH 3 ·H 2O =AgOH ↓+ NH 4+ Ag ++2NH 3 ·H 2O = [Ag(NH 3 )2]+ +H 2OAg ++Cl - =AgCl ↓ Ag ++Br - =AgBr ↓ Ag ++I - =AgI ↓3Ag ++ PO 43=Ag 3PO 4 ↓2Ag ++ CO 2 =Ag 2CO 3 ↓Ag 2CO 3 H + =2Ag ++CO 2 ↑+H 2O Ag 3PO 4+3H + =3Ag ++H 3PO 42Ag[(NH 3)2]++2OH -+CH 3CHO CH 3COO -+ NH 4++2Ag ↓+3NH 3+H 2O2Ag[(NH 3)2]++2OH -+CH 2OH(CHOH)4CHO CH 2 OH(CHOH)4COO -+ NH 4++2Ag ↓+3NH 3+H 2OBa 2++ SO 2 =BaSO 4 ↓ Ba 2++ CO =BaCO 3 ↓3Ba 2++2 PO 43=Ba 3(PO 4)2 ↓Ba 2++2OH -+CO 2=BaCO 3 ↓+H 2OBa 2++2OH -+2H ++ SO 2 =BaSO 4 ↓+2H 2O (NaHSO 4 溶液中加 Ba(OH)2,4使溶液呈中性)Ba 2++OH -+H ++ SO 2 =BaSO 4 ↓+H 2O (NaHSO 4 溶液 中加 Ba(OH)2,使4 Ba 2+全部沉淀)BaCO 3+2H +=Ca 2++CO 2t +H 2O 2Br -+Cl =2Cl -+Br 2 22 3 2 2 4 4 22 3 2 2Br +SO +2H O =2Br -+2H ++ SO 24Br -+2Fe 2++3Cl 2=2Fe 3++2Br 2+ 64Cl - (足量 Cl 2 ) 2Br -+2Fe 2++2Cl 2=2Fe 3++Br 2+4Cl - (当 n (FeBr 2)/n (Cl 2)=1:1 时)10Br -+6Fe 2++8Cl 2=6Fe 3++5Br 2+16Cl - (当 n (FeBr 2)/n (Cl 2)=3:4 时) CO 2 +2Ag + =Ag 2CO 3 ↓CO 23+Ba 2+=BaCO 3 ↓CO 23+Ca 2+=CaCO 3 ↓CO 23+2H +=CO 2 ↑+H 2OCO 23+H 2O HCO +OH -3 C O 32 +2Al 3++3H 2O 2Al(OH)3 ↓+3CO 2 ↑3 CO 23+2Fe 3++3H 2O =2Fe(OH)3 ↓+3CO 2 ↑ CO 2 AlO +3H 2O =2Al(OH)3 ↓+CO 2CO 2+ AlO +2H 2O =Al(OH)3 ↓+ HC O 3CO +OH - =HCO CO 2+Ba 2++2OH - BaCO 3 ↓+H 2O CO 2+2OH - =CO 2 +H 2O 3CO 2+5OH -=2C 3O 2 + HCO +2H 2O (当 n (CO 2)/n (NaOH)=33:5 时) 3CO 2+ SiO 2 +2H 2O =H 4SiO 4 ↓+ CO 23 3Ca 2++2OH -+CO 2=CaCO 3 ↓+H 2O Ca 2++2OH -+SO 2=CaSO 3 ↓+H 2O Ca 2++2ClO -+SO 2+H 2O =CaSO 4 ↓+HClO+H ++Cl - (少 量 SO ) Ca 2++2ClO -+2SO 2+4H 2O = CaSO 4 ↓ +2Cl -+4H ++ SO 2 (足量 SO 2 ) Ca 2++2ClO -+C O 42+H 2O =CaCO 3 ↓+2HClO CaCO 3+2H +=Ca 2++CO 2 ↑+H 2O Cl +H O =Cl -+H ++HClOCl +2OH -=Cl -+ClO -+H O 2 2 Cl +2OH -=Cl -+ClO -+H O 2 2Cl +2I -=2Cl -+I 2 2Cl 2+H 2SO 3+H 2O =2Cl -+ SO 42+4H + Cl 2+H 2S =2Cl -+2H ++S ↓ Cl 2+2Fe 2+=2Fe 3++2Cl - (向 FeBr 2 溶液中少量 Cl 2 ) 3Cl 2+2Fe 2++4Br -=2Fe 3++2Br 2+6Cl - (足量 Cl 2 ) 2Cl 2+2Fe 2++2Br -=2Fe 3++Br 2+4Cl - (当 n (FeBr 2)/n (Cl 2)=1:1 时) 8Cl 2+6Fe 2++10Br -=6Fe 3++5Br 2+16Cl - (当n (FeBr 2)/n (Cl 2)=3:4 时) 2Cl -+4H ++MnO 2=Mn 2++Cl 2 ↑+2H 2O Cl -+Ag + =AgCl ↓ ClO -+H +=HClOClO -+SO 2+H 2O =2H ++Cl -+ SO 2ClO -+H O HClO+OH -2Cr O +6Fe 2++14H +=6Fe 3++2Cr 3++7H 2O7Cu+2Fe 3+=2Fe 2++Cu 2+3Cu+2 NO +8H +=3Cu 2++2NO t +4H 2OCu 2++2H 2 O 3Cu(OH)2+2H +Cu 2++2NH 3 ·H 2O =Cu(OH)2 ↓+2NH 4+ Cu 2++2Na+2H 2O =2Na ++Cu(OH)2 ↓+H 2 t Cu 2++H 2S =2H ++CuS ↓ Cu 2++Fe =Cu+Fe 2+Cu 2++2OH - =Cu(OH)2 ↓ CuO+2H +=Cu 2++H O Fe+2H +=Fe 2++H ↑ Fe+Cu 2+=Fe 2++CuFe+2Fe 3+=3Fe 2+ Fe 2++2OH - =Fe(OH)2 ↓ 2Fe 2++Cl 2=2Fe 3++2Cl -2Fe 2++Br 2=2Fe 3++2Br - 4Fe 2++O 2+4H +=Fe 3++2H 2O 12Fe 2++3O 2+6H 2O =8Fe 3++4Fe(OH)3 ↓ 2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O 6Fe 2++ Cr O +14H +=6Fe 3++2Cr 3++7H 2O 5Fe 2++ Mn 2O +8H +=5Fe 3++Mn 2+4H 2O 3Fe 2++ NO 4H +=3Fe 3++NO ↑+2H 2OFe 2++S 2- =FeS 3↓ 2Fe 2++Cl 2=2Fe 3++2Cl - (向 FeBr 2 溶液中通入少量 Cl ) 2Fe 2++4Br -+3Cl 2=2Fe 3++2Br 2+6Cl - (足量 Cl 2) 2Fe 2++2Br -+2Cl 2=2Fe 3++Br 2+4Cl - (当 n (FeBr 2)/n (Cl 2)=1:1 时) 6Fe 2++10Br -+8Cl 2=6Fe 3++5Br 2+16Cl - (当 n (FeBr 2)/n (Cl 2)=3:4 时)2Fe 2++4I -+3Cl 2=2Fe 3++2I 2+6Cl - (向 FeI 2 溶液中足量 Cl 2 ) 2Fe 2++6I -+4Cl 2 = 2Fe 3++3I 2+8Cl - ( 当 n (FeI 2)/n (Cl 2)=3:4 时) Fe 3++3OH - =Fe(OH)3 ↓ 2Fe 3++Cu =2Fe 2++Cu 2+2Fe 3++Fe =3Fe 2+Cl 2+2I -=2Cl -+I 2 2Fe 3++Zn =2Fe 2++Zn 2+ Cl 2+2I -=I 2+2Cl - (向 FeI 2 溶液中通入少量 Cl 2 ) 2Fe 3++3Zn =2Fe+3Zn 2+3Cl 2+2Fe 2++4I -=2Fe 3++2I 2+6Cl - (足量 Cl 2 ) Fe 3++3 HCO =Fe(OH)3 ↓+3CO 2 t4Cl 2+2Fe 2++6I - =2Fe 3++3I 2+8Cl - (当 Fe 3++3 AlO +6H 2O =Fe(OH)3 ↓+3Al(OH)3 ↓n (FeI 2)/n (Cl 2)=3:4 时) 2Fe 3++3 CO 2+3H 2O =2Fe(OH)3 ↓+3CO 2 ↑2 32 2 2 2 2 22 22 242 4 2Fe 3++H 2S =2Fe 2++S ↓+2H + 2Fe 3++S 2-=2Fe 2++S ↓ 2Fe 3++2I -=2Fe 2++I 22Fe 3++SO 2+2H 2O =2Fe 2++ SO 2 +4H +Fe 3++3SCN - =Fe(SCN) (红色4溶液)Fe 3++3H 2O =Fe(OH)FeO+2H +=Fe 2++H O Fe 2O 3+6H +=Fe 3++3H 2OFe 3O 4+8H +=Fe 2++2Fe 3++4H 2O FeS+2H +=Fe 2++H 2S t H ++OH -=H 2O 2H O+2Na =2Na ++2OH -+H ↑ 2H 2O+2Na 2O 2=4Na ++4OH -+O 2 ↑ H 2O+Na 2O =2Na ++2OH - H O+Cl =Cl -+H ++HClO2 2 2 2H 2O 2+2Fe 2++2H +=2Fe 3++2H 2O5H 2O 2+2 MnO +6H +=2Mn 2++5O 2 ↑+8H 2OH 2O 2+Cl 2=2H 4++2Cl -+O 2 ↑ H 2O 2+SO 2=2H ++ SO 242 3 HCOH ++ HCO H ++ CO 233 3HCO 2O H 2C O 33+ OHHCO + OH =CO 2 +H 2O HCO +H +=CO 2 ↑2O3 HC O 3+Al 3+ =Al(OH)3 ↓+3CO 2 t3 HCO +Fe 3+ =Fe(OH)3 ↓+3CO 2 t2 HCO +Ca 2++2 OH=CaCO 3 ↓+2H 2O+ CO 2 (向NaHC O 33 溶液中加入少量澄清石灰水)3 HCO +Ca 2++ OH =CaCO 3 ↓+H 2O (足量澄清石 灰水 )3HCO +Ca 2++ OH =CaCO 3 ↓+H 2O (向 Ca(HCO 3)2溶液中3加入少量 NaOH 溶液)2 HCO +Ca 2++2 OH =CaCO3 ↓+2H 2O+ CO 2(Ca(H 3CO 3)2 溶液中加入足量 NaOH 溶液) 3 入H 少CO 量3溶=C 液O 23)+H 2O (向 NH 4HCO 3 溶液中加 HCO + NH 4 +2 OH =CO 32+H 2O+NH 3 ·H 2O (向 NH 4HCO 3 溶液中加入足量 NaOH 溶液) 2 HCO +SO 2=SO 2 +CO 2 t +H 2OHCO AlO +H 2 O 3=Al(OH)3 ↓+ CO 32H ++ H POH ++ H 2PO 244H 3PO 4+ OH =H PO +H 2OH PO + OH = HP 2O 2 +H 2O HP 2O 2 + OH = PO 3 H 2OPO 3 +H O HPO 2 + OH HP O 4 2 +H 2O H P 4O + OH H P O 4 +H 2O H 32PO 44+ OHH + P O 43 =HPO 2H ++ HP O 4 2 =H P 4OH ++ 4 =H 32PO 44H ++HS - H ++S 2-22I -+2Fe 3+=2Fe 2++I 2 2I -+Cl =2Cl -+I2 22I -+Br =2Br -+I 2 2I -+Ag + =AgI ↓2I -+H O +2H +=I +2H O 2 2I +2OH -=I -+IO -+H O 2 2I 2+5Cl 2+6H 2O =12H ++10Cl -+2 IO Mg+2H + =Mg 2++H 2 tMg 2++2OH - =Mg(OH)2 ↓ Mg 2++ CO 32=MgCO 3 ↓MgCO 3+2H + =Mg 2++CO 2 ↑+H 2O MgO+2H + =Mg 2++H 2OMg(OH)2+2H + =Mg 2++2H 2O2 2 3HS -+Al 3++3H 2O =Al(OH)3 ↓+3H 2S tH 2SO 3 H ++ HSO HSO H ++ SO 2 3HSO +H 2O H 23SO 3+OH -HSO +OH - =SO 2 +H 2O HSO +H +=SO 2 ↑3+H 2O H 2 SO 33+Cl 2+H 2O =2Cl -+ SO 42+4H +2 H 2S+Cl 2=2Cl -+2H ++S ↓ 2H 2S+SO 2=3S ↓+2H 2O 2H 2S+O 2=2S ↓+2H 2O H 2S+Cu 2+=2H ++CuS ↓ H 2S+(CH 3COO)2Pb =PbS ↓+2CH 3COOH H S+2OH -=S 2-+2H O H ++HS -=H 2S H O+S 2- HS -+OHH O +2I -+2H +=I +2H O 2 2 2 25I -+IO -+6H +=3I +3H O 2 2 H S+OH -=HS -+H O 2 2 HS -+OH -=S 2-+H O H PO3 4 H PO 2 4HPO244 42 HS -+H O H S+ OH H ++ PO 342 2H ++S 2-=HS - H S 2 HS - 233 H 2O+ CO 2 HCO +OH3MnO 2+2Cl -+4H +=Mn 2++Cl 2 t +2H 2O MnO +5Fe 2++8H +=5Fe 3++Mn 2+4H 2O2 Mn O 4+5SO 2+2H 2O =2Mn 2++5SO 2 +4H +2 MnO +5H 2O 2+6H +=2Mn 2++5O2↑4+8H 2O 12 Mn O 4+5C 2H 4+36H +=12Mn 2++10CO 2 ↑+28H 2O2 MnO C O 2 +16H +=2Mn 2++10CO 2 ↑+8H 2O4 2 42Na+2H 2O =2Na ++2OH -+H 2 ↑2Na+Cu 2++2H 2O =2Na ++Cu(OH) 2 ↓+H 2 ↑++H 2O NH 3 ·H 2O+H +2 N H 4+ +SiO 2 +H 2O =H 4SiO 4 ↓+2NH 3 ↑NH + AlO 3+H 2O =Al(OH)3 ↓+NH 3 ↑NH + HC O 2+2OH - = CO 2 +H 2O+NH 3 ·H 2O (向NH 4HCO 43 溶3液中加入足量3 NaOH 溶液)NH +H O NH ·H O NH 3 ·H 2O NH 4++OH -NH 3 ·H 2O+Ag + =AgOH ↓+NH 4+2AgOH =Ag 2O+H 2O (AgNO 3 溶液中加入少量氨水)2NH 3 ·H 2O+Ag + =[Ag(NH 3)2]++H 2O (足量氨水) 溶2N 液H 中3·加H 入2O 少量+Cu2氨水+=C u (OH)2 ↓+2 NH 4+(向 CuSO 44NH 3 ·H 2O+Cu 2+ =[Cu(NH 3)4]2++4H 2O (足量氨水) 2NH 3 ·H 2O+Zn 2+ =Zn(OH)2 ↓+2NH 4+ (向 ZnCl 2 溶液中加入少量氨水)4NH 3 ·H 2O+Zn 2+ =[Zn(NH 3)4]2++4H 2O (足量氨水) 3NH 3 ·H 2O+Al 3+ =Al(OH)3 ↓+3 NH 4+2 NO +2I -+4H +=2NO ↑+I 2+2H 2O5 NO +2 MnO +6H +=2Mn 2++5 NO +3H 2ONO 2++4H 4+=3Fe 3++NO ↑+2H 23O2 N O 3+3SO 2+2H 2O =3SO 2 +2NO ↑+4H +2 NO +3Cu+8H +=3Cu 2++ 24NO ↑+4H 2OOH +H +=H O OH +CO =HCO O 2+2H 2S =2S ↓ H 2O O 2+2S 2-+4H +=S ↓+2H 2O O 2+2HS -+2H +=S ↓+2H 2O O 2+4Fe 2++4H +=Fe 3++2H 2O3O 2+12Fe 2++6H 2O=8Fe 3++4Fe(OH)3 ↓O +2SO 2 =2SO 2 2PO 43 +3Ag + =Ag 3PO 4 ↓2 PO 43 +3Ba 2+ =Ba 3(PO 4)2 ↓2 PO 43+3Ca 2+=Ca 3(PO 4)2 ↓2 PO3 +3Mg 2+ =Mg 3(PO 4)2 ↓PO 34+H + =HPO 2PO 34 +2H + =H P 4OPO 34 +3H +=H 3PO 244Pb 2+ SO 2 =PbSO 4 ↓Pb 2++S 2- PbS ↓PbO 2+2Cl -+4H +=Pb 2++Cl 2 t +2H 2O(CH 3COO)2Pb+H 2S =PbS ↓+2CH 3COOH 3S+6OH -=2S 2-+ SO 2 +3H 2OS 2-+H O HS -+OH - 23S 2-+2Al 3++6H 2O =2Al(OH)3 ↓+3H 2S ↑ S 2-+2Fe 3+=2Fe 2++S ↓SO 2+Ca 2++2ClO -+H 2O = CaSO 4 ↓ +HClO+H ++Cl - (少量 SO 2 )2SO 2+Ca 2++2ClO -+4H 2O = CaSO 4 ↓+2Cl -+4H ++ SO 2(足量 SO 2 )SO 2+2Fe 3++2H 24O =2Fe 2++ SO 2 +4H +SO 2+2 HCO =SO 2 +CO 2 ↑ H 2O SO 2+2OH - SO 2 H 2OSO +OH -=HSO 2SO +Br +2H O =2Br -+2H ++ SO 2 2 2 2 3SO 2+2 NO +2H 2O 3SO 2 +2NO t +4H +SO 2+ClO -+H 32O =2H ++Cl - SO 2SO 2+2H 2S =3S ↓+2H 2O 4SO +H O H SO 2 2 2 35SO 2+2 MnO +2H 2O =2Mn 2++5SO 2 +4H +SO 2 +2H + = S 4O 2 t +H 2O4SO 23+H 2O HSO +OH -SO 23+Ba 2+=BaSO 4 ↓3SO 24+2H ++Ba 2++2OH -=BaSO 4 ↓+2H 2O(NaHSO 4 溶液4中加 Ba(OH)2 ,使溶液呈中性)SO 2 +H ++Ba 2++OH -=BaSO 4 ↓+H 2O (NaHSO 4 溶液中4加 Ba(OH)2 ,使 Ba 2+全部沉淀) S O +2H +=S ↓+SO 2 t +H 2O 3Si+2OH -+H 2O = SiO 2 +2H 2 ↑SiO 2+2OH - =SiO 2 +H 32O SiO 32 +2 NH 4++H 2O 3=H 4SiO 4 ↓+2NH 3 ↑SiO 32+CO 2+2H 2O =H 4SiO 4 ↓+CO 32-SiO 2 +2H ++H 2O =H 4SiO 4 ↓ 3Si O 332+2Fe 3+=Fe 2(SiO 3)2 ↓3SiO 32+2Al 3+=Al 2(SiO 3)2 ↓ Zn+2H +=Zn 2++H ↑Zn+2OH - = ZnO 2 +H 2 ↑Zn+2Fe 3+=2Fe 2+Zn 2+ (少量 Zn 片) 3Zn+2Fe 3+=2Fe+3Zn 2+ (过量 Zn 片)高中化学方程式总结,第11页,共12页SO 2+H 2O 2=2H ++ SO 2 4SO +I +2H O =2I -+2H ++ SO 23 4O +2I -+2H +=I +O +H O 3 2 3 22 2 2 2 22 4 333Zn 2++2H 2O Zn(OH)2+2H + Zn 2++2OH -=Zn(OH)2 ↓Zn 2++2NH 3 ·H 2O =Zn(OH)2 ↓+2 NH + (少量氨水)Zn 2++4NH 3 ·H 2O =[Zn(NH 3)4]2++4H 2 O 4(足量氨水)Zn(OH)2+2H +=Zn 2++2H 2OZn(OH)2+2OH =ZnO 2一 +2H 2OZnO+2H +=Zn 2++H O 2 ZnO+2OH =ZnO 2一 +H 2O高中化学方程式总结,第12页,共12页22。
高一化学金属及其金属化合物的化学方程式总结第一节钠及钠的化合物的化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOH2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO45、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6、向氯化铝溶液中加过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO39、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO311、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO324、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaCl27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO335、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO32、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOH2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaCl3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOH4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaCl5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO38、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO39、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO 3+H2O H2CO3+NaOH2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O第二节铝及其化合物的化学方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O 2NaAlO 2+3H 2 ↑6、铝和浓硫酸共热:2Al +6H 2SO 4Al 2(SO 4)3 +3SO 2 ↑+6H 2O7、铝和浓硝酸共热:Al +6HNO 3Al(NO 3)3 +3NO 2 ↑+3H 2O8、铝和稀硝酸反应:Al +4HNO 3Al(NO 3)3 +NO ↑+2H 2O 8、铝和硝酸银溶液反应:Al +3AgNO 3Al(NO 3)3 +3Ag9、铝与硫酸铜溶液反应:2Al +3CuSO 4Al 2(SO 4)3 +3Cu 10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe 11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu 13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn 二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH 2NaAlO 2+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑ 三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O 四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 43、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH 3Na 2SO 4+2Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)2 2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液: Al 2(SO 4)3 +4Ba(OH)2 Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O7、向明矾溶液中加入少量的氢氧化钡溶液: 3Ba(OH)2 +2KAl(SO 4)2 2Al(OH)3 ↓+3BaSO 4 ↓+K 2SO 48、向明矾溶液中加入足量的氢氧化钡溶液: KAl(SO 4)2 +2Ba(OH)2 KAlO 2+2BaSO 4 ↓+2H 2O冰晶石 电解9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO410、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO 2+2H2O AI(OH)3+NaOH2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO35、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓7、向偏铝酸钠溶液中加氯化铵:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl第三节铁及其化合物的化学方程式一、铁1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3·H2O]4、高温条件铁与氧气反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4Fe2(SO4)3+3SO2↑+6H2O9、过量的铁与浓硫酸共热:Fe+2H2SO4FeSO4+SO2↑+2H2O10、少量的铁与浓硝酸共热:Fe+6HNO3Fe(NO3)3+3NO2↑+3H2O11、过量的铁与浓硝酸共热:Fe+4HNO3Fe(NO3)2+2NO2↑+2H2O12、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑+2H2O13、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O14、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu15、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag16、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O22Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3Fe(NO3)3+NO2↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO43Fe2(SO4)3+SO2↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO33Fe(NO3)3+NO2↑+5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO3)3+NO ↑+14H2O6、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4Fe2(SO4)3+SO2↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3Fe(NO3)3+NO2↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑+8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氢氧化铁1、氢氧化铁与稀硫酸反应:2Fe(OH)3+3H2SO4Fe2(SO4)3+6H2O2、氢氧化铁溶于氢碘酸:2Fe(OH)3+6HI2FeI2+I2+6H2O3、加热氢氧化铁:2Fe(OH)3Fe2O3+3H2O七、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe2、锌与氯化亚铁反应:Zn+FeCl2ZnCl2+Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl36、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr37、氯化亚铁溶液呈酸性:FeCl 2+2H2O Fe(OH)2+2HCl8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2↓+2NaCl9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl10、氯化亚铁溶液中加入偏铝酸钠溶液:FeCl2+2NaAlO2+4H2O Fe(OH)2↓+2Al(OH)3↓+2NaCl11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3Fe(NO3)3+NO2↑+H2O15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3↓+8NaCl+O2↑18、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO八、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl22、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe3、铁与氯化铁溶液反应:Fe+2FeCl33FeCl24、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl25、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl6、氯化铁溶液呈酸性:FeCl 3+3H2O Fe(OH)3+3HCl7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑11、向氯化铁溶液中加入偏铝酸钠溶液:FeCl3+3NaAlO2+6H2O Fe(OH)3↓+3Al(OH)3↓+3NaCl12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓+2HCl14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl15、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓+2NaCl16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓+6NaCl17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl18、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓+Fe(NO3)319、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl20、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)321、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)3。