电极的极化和极化曲线_极化曲线
- 格式:pdf
- 大小:402.40 KB
- 文档页数:6
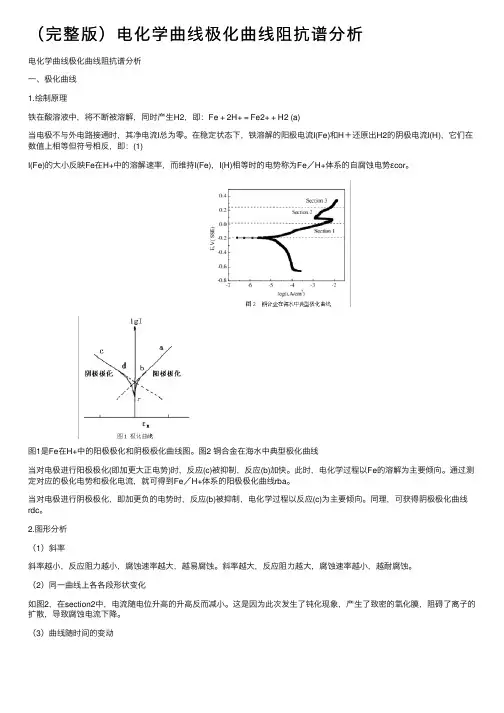
(完整版)电化学曲线极化曲线阻抗谱分析电化学曲线极化曲线阻抗谱分析⼀、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产⽣H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的⼤⼩反映Fe在H+中的溶解速率,⽽维持I(Fe),I(H)相等时的电势称为Fe/H+体系的⾃腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合⾦在海⽔中典型极化曲线当对电极进⾏阳极极化(即加更⼤正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进⾏阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越⼩,反应阻⼒越⼩,腐蚀速率越⼤,越易腐蚀。
斜率越⼤,反应阻⼒越⼤,腐蚀速率越⼩,越耐腐蚀。
(2)同⼀曲线上各各段形状变化如图2,在section2中,电流随电位升⾼的升⾼反⽽减⼩。
这是因为此次发⽣了钝化现象,产⽣了致密的氧化膜,阻碍了离⼦的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),⾃腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增⼤,亦说明更容易腐蚀。
⼆、阻抗谱1.测量原理它是基于测量对体系施加⼩幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因⽽阻抗谱可以通过多种⽅式表⽰。

充放电极化曲线电流电压
充放电极化曲线是描述电池在充电或放电过程中,电极上发生的电化学反应与对应的电流、电压之间的关系曲线。
在充电过程中,随着电荷的积累,电极的电位会发生变化,同时电极上会发生一定的极化现象,表现为电压的升高。
当电流密度一定时,电极电位与对应的电流之间呈线性关系,可以表示为极化曲线。
在极化曲线上,存在两个重要的点:开路电位和电化学极化电位。
开路电位是指电极在没有电流通过时的电位。
如果电极的电势低于开路电位,则电极表面会出现电化学氧化反应或还原反应,导致电极的极化现象。
在极化曲线上,对应于电流密度的点是电化学极化电位,该点的电极电位与电流之间存在一定的斜率关系。
在电池的充放电过程中,随着电流密度的变化,电极的极化现象也会发生变化。
当电流密度较小时,电极上的反应速度较慢,电极的极化现象较小;当电流密度较大时,电极上的反应速度加快,电极的极化现象加剧。
因此,在电池的充放电过程中,需要控制适当的电流密度和电压,以避免过度的极化现象导致电池性能下降或损坏。

阳极极化曲线阴极极化曲线的测定阴极极化曲线的测定The measurement of cathode polarization curve一、实验目的及要求1.测定氢在光亮铂电极上的活化超电势,并求出塔菲尔公式中的两个常数a和b以及交换电流密度i;2.了解超电势的种类和影响超电势的因素;3.掌握采用三电极恒电流法测定阴极极化曲线的实验方法。
二、实验基本原理本实验采用三电极恒电流法测定阴极极化曲线。
在电解H2SO4溶液时,阴极上产生H2,电极反应成为成为单向不可逆过程,电极表面产生极化,其氢超电势为η=Φ不可逆电极电势为φc=φH+/H2-φ甘汞-c对于阴极极化的电化学极化,在一定电流密度范围内塔菲尔公式为η=a+b log i 式中,η为氢超电势,单位为V;a和b为常数,b为该线性方程的斜率,b值随电极性质等的变化影响不大;a为电流密度为1A•cm-1时的超电势值,a值的大小与电极材料、表面状态、电流密度、溶液组成和温度等有关,基本代表了电极反应的不可逆程度的大小。
a 值越大,在所给电流密度氢超电势也越大。
铂电极材料属于低氢超电势金属,其a值在0.1-0.3V之间。
当电流密度极低时,氢超电势不服从上述塔菲尔公式,此时η与电流密度i成正比关系。
所以,氢超电势的测量就是如何测量在一定范围内一系列不同电流密度下的电极电势,以及在实验中如何采取措施消除电阻超电势和浓差超电势等问题。
实验选择甘汞电极作辅助电极与被测电极组成一个电解池使氢在电极上电解;同时选择一个掺比电极与被测电极组成一个原电池,测量电动势,获得被测电极的电极电势。
对于电阻超电势可采用鲁金毛细管消除。
当η=0时,交换电流密度为log i=-a/b 0E同时,作i-φc图,可从图上获得氢在电极上显著析出时的最小析出电势。
三、仪器试剂恒电流法测定极化曲线装置一套。
标准电流电压发生器一台,数字式酸度计一台,电流表一个,饱和甘汞惦记、铂电极各一支。


理想极化曲线和实测极化曲线导言极化曲线是电化学实验中常用的一种实验方法,用于表征电化学电极的电化学性质。
理想极化曲线是在理想条件下通过计算得到的曲线,而实测极化曲线是实际实验测量得到的曲线。
本文将详细解释理想极化曲线和实测极化曲线的概念、原理、实验方法和应用,并通过实例加以说明。
理想极化曲线理想极化曲线是在假设电化学电极满足一定条件下通过计算得到的曲线。
它通常由两个部分组成:极化曲线和Tafel曲线。
极化曲线极化曲线是电化学反应过程中电极电位随电流密度变化的曲线,通常以电位为横坐标,以电流密度为纵坐标。
理想极化曲线可以通过计算得到,其中主要包含两个重要参数:开路电位和极化电流密度。
开路电位是极化曲线与电位轴的交点,反映了电极表面的电化学活性。
极化电流密度则是极化曲线降至负饱和值(忽略质子活化)时的电流密度,用于衡量电极材料的电化学反应活性。
Tafel曲线Tafel曲线是描述电化学反应速率与电极电位之间关系的曲线,它是理想极化曲线的一部分。
Tafel曲线可以通过实验测量得到,其斜率给出了电极反应的速率常数。
在Tafel曲线中,通常存在两个部分:阳极Tafel曲线和阴极Tafel曲线。
阳极Tafel曲线描述了阳极反应速率与阳极电位之间的关系,阴极Tafel曲线描述了阴极反应速率与阴极电位之间的关系。
实测极化曲线实测极化曲线是通过实际电化学实验测量得到的曲线,它反映了电化学电极在实验条件下的电化学性质。
实测极化曲线的形状和理想极化曲线通常是相似的,但具体参数可能会有差异。
实验方法为了测量实测极化曲线,需要进行电化学实验,并且需要注意以下几点。
首先,选择合适的工作电极和参比电极。
工作电极是被测量的电极,参比电极具有稳定的电位,用于测量工作电极的电位。
其次,控制实验条件,如温度、溶液浓度、电解质种类等。
保持实验条件的一致性,可以减小实测极化曲线的误差。
然后,通过改变工作电极的电位,测量电流密度,并记录测得的数据。
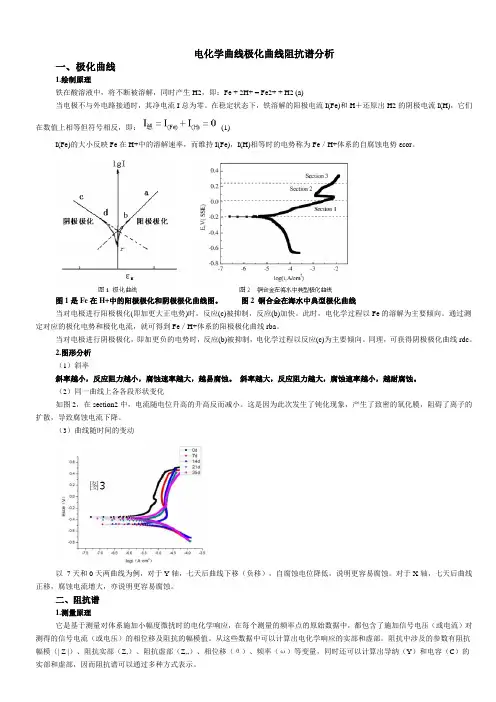
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。

金属电极的极化曲线是描述金属电极在电化学反应过程中电势与电流之间关系的曲线。
它通常是通过进行极化实验来获取的,其中对电极施加一定的电位或电流,并测量相应的电流或电势响应。
极化曲线通常具有三个主要区域:
1. 阳极极化区:在该区域内,电极表面发生氧化反应,即金属电极溶解或氧化。
在该区域,电流随电位的增加而增加,形成一个斜上升的曲线。
2. 反极化区:在该区域内,电极表面的氧化反应逐渐减弱或停止,电流开始饱和。
在该区域,电流变化缓慢,形成一个相对平缓的曲线。
3. 阴极极化区:在该区域内,电极表面发生还原反应,即金属电极得到电子或还原。
在该区域,电流随电位的增加而减小,形成一个斜下降的曲线。
极化曲线的形状和特征取决于金属电极的特性、电解质溶液的成分和浓度,以及外部施加的电位或电流。
通过分析极化曲线,可以获得有关电极的电化学反应、电化学反应动力学以及电极的电化学性能的信息。
这对于研究腐蚀、电镀、电池等电化学过程具有重要意义。

极化曲线-电极电位与极化电流或极化电流密度之间关系的曲线叫作极化曲线极化曲线-电极电位与极化电流或极化电流密度之间关系的曲线叫作极化曲线,极化曲线是以电极电位为纵坐标,以电极上通过的电流为横坐标获得的曲线,它表征腐蚀原电池反应的推动力电位与反应速度电流之间的函数关系。
极化曲线分为4个区,活性溶解区、过渡钝化区、稳定钝化区、过钝化区。
学术术语来源——钛种植体基台与种植体上部结构合金的耐腐蚀性能文章亮点:1 金属种植体的腐蚀非常重要,因为它对种植体的生物相容性和机械整合产生不利影响。
随着基底材料的腐蚀,其表面钝化膜溶解,就会有离子释放到周围环境中。
过多金属离子的释放会产生不利的生物反应,甚至导致种植失败。
大量资料评价了钛种植体的耐腐蚀性,然而种植体上部结构合金的选择仍然存在着问题,合金本身的腐蚀及多种合金同时应用引起的电偶腐蚀已受到广泛关注。
2 实验利用动电位极化技术研究并探讨钛种植体基台、金合金、镍铬合金、钴铬合金及钛合金在人工唾液中的电化学腐蚀行为,并进行相互比较,发现金合金、纯钛是耐腐蚀性较好的材料,镍铬合金的腐蚀速度最大,应尽量避免用镍铬合金作为种植体上部结构。
关键词:生物材料;口腔生物材料;稳态电位;电偶序;电偶腐蚀;纯钛;金合金;钴铬合金;钛合金;镍铬合金主题词:钛;金合金;铬合金摘要背景:国内有学者运用动电位极化技术测定常用牙科金属自腐蚀电位值来评价低贵金属的腐蚀性能,发现合金的贵金属含量是影响其耐腐蚀性能的主要原因。
目的:评价TA2型商业纯钛、金合金、钴铬合金、钛合金及镍铬合金的体外耐腐蚀性能。
方法:将TA2型商业纯钛、金合金、钴铬合金、钛合金及镍铬合金分别浸入人工唾液中,运用动电位极化技术测量5种材料在人工唾液中的自腐蚀电位和自腐蚀电流密度。
结果与结论:5种合金的自腐蚀电位值由大到小排列顺序为金合金、商业纯钛、钛合金、钴铬合金、镍铬合金;金合金与纯钛电位较正,不易发生腐蚀;钛合金和钴铬合金居中,由于可以形成稳定氧化膜,具有较强的抗孔蚀和缝隙腐蚀能力;镍铬合金电位较负,则较容易发生溶解。

维基百科极化曲线
极化曲线是指在电化学中描述电极极化过程的一种曲线。
在电化学中,电极极化是指电极在电化学反应中由于电流通过或者外界条件改变而发生的极化现象。
极化曲线通常是以电极电势(或电流密度)为横坐标,以电极极化的程度(如电极极化电阻、极化电流等)为纵坐标所绘制的曲线。
极化曲线可以用来研究电极的极化特性,了解电化学反应的动力学过程。
极化曲线通常可以分为阳极极化曲线和阴极极化曲线。
阳极极化曲线描述了阳极在不同电流密度下的极化行为,而阴极极化曲线则描述了阴极在不同电流密度下的极化行为。
通过分析极化曲线,可以了解电极的极化机理,评估电极的性能以及优化电化学反应的条件。
极化曲线的形状可以提供很多信息,比如电化学反应的动力学特性、电化学界面的特性以及电解质的传输特性等。
通过分析极化曲线,可以确定最佳的工作条件,提高电化学反应的效率和选择合适的电极材料。
总的来说,极化曲线在电化学领域具有重要的意义,它为研究
电极极化提供了重要的工具,也为优化电化学反应条件提供了重要的参考依据。
通过分析极化曲线,可以更好地理解电化学反应的动力学过程,推动电化学领域的发展和应用。

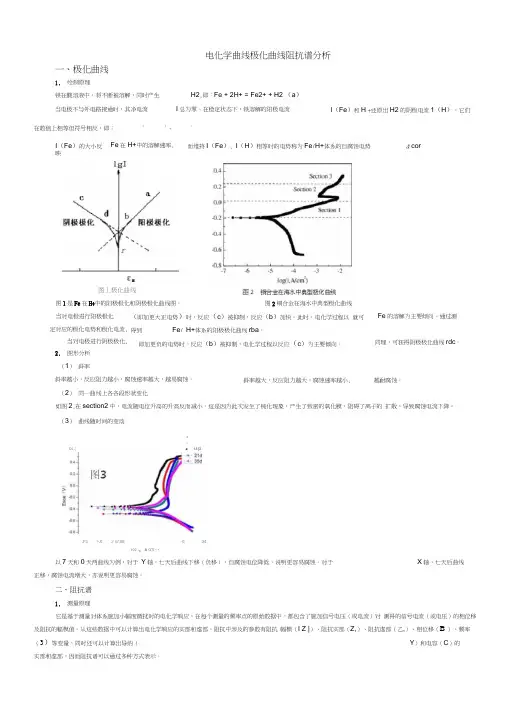
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流在数值上相等但符号相反,即: 1 1 - 12.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(I Z |)、阻抗实部(Z,)、阻抗虚部(乙,)、相位移(B )、频率(3)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
I(Fe)的大小反映而维持I(Fe), I(H)相等时的电势称为Fe/H+体系的自腐蚀电势& corFe在H+中的溶解速率,图丄极化曲线图1是Fe在H+中的阳极极化和阴极极化曲线图。
当对电极进行阳极极化定对应的极化电势和极化电流,当对电极进行阴极极化,图2铜合金在海水中典型极化曲线(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以就可得到Fe/ H+体系的阳极极化曲线rba。
即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
Fe的溶解为主要倾向。
通过测同理,可获得阴极极化曲线rdc。
将一种金属(电极)浸在电解液中,在金属与溶液之间就会形成电位,这种电位称为该金属在该溶液中的电极电位。
当有外加电流通过此电极(电解)时,其电极电位会发生变化,这种现象称为电极的极化。
如果电极为阳极,则电极电位将向正方向偏移,称为阳极极化;对于阴极,电极电位将向负方向偏移,称为阴极极化。
令:(16.1)图16.1 典型的阴、阳极极化曲线对于可逆电极,即为平衡电极电位; 对于不可逆电极,为系统达到稳态时的电极电位,即稳态电极电位,或称自腐蚀电位。
习惯上将电极电流密度为i 时对应的电极电位与平衡电极电位之差定义为在该电流密度时的过电位,用符号表示。
并规定阴、阳极的过电位均为正。
根据上述定义,可以分别写出阴、阳极的过电位计算公式为:过电位是一个很重要的电化学参量。
例如在金属电沉积中,析出金属的过电位越小,消耗的电能也就越少。
在电解提纯工艺中,往往借助改变析出金属的过电位,来改变金属的析出顺序,从而获得所需的金属,达到提纯的目的。
如前所述,过电位的大小与流经电极的电流密度有关,电极电位(或过电位)与电流密度的关系曲线称为极化曲线。
图16.1是一种典型的极化曲线。
随着电流密度的增加,电极电位将越来越偏离平衡电位,亦即过电位将越来越大。
极化曲线还常用半对数座标表示,如图16.2 所示。
考察图16.2 可知,当电流密度较大时,过电位与电流密度的对数成线性关系,即:式(16.4),式(16.5) 均称为塔菲尔(Tafel)公式。
图16.2 半对数极化曲线示意图事实上,对于任一电极总是同时存在着两个共轭反应(也可存在两对或两对以上的反应),一是还原反应:(16.6)与之相对应的共轭反应是氧化反应:(16.7)式中o为氧化态;R 为还氧态。
由反应(16.6) 产生的电流密度称为阴极电流密度,用符号表示;而因反应(16.7) 产生的电流密度称为阳极电流密度,用符号i阳表示。
习惯上规定i阴为正,i阳为负。
则电极上的总电流密度i 应是阴极和阳极电流密度的代数和,即:i = i阴+ i阳(16.8)当电极上施以很大的负电压时,反应(16.7)被抑制,而以反应(16.6)为主,即i阴》|i阳|,则i≈i 阴,电极为阴极。
文章编号:100123849(2008)0720029206 电极的极化和极化曲线( )①——极化曲线覃奇贤, 刘淑兰(天津大学化工学院,天津 300072)Polar ization of Electrode and Polar ization Curve ( )(the end )——Polar ization CurveQ I N Q i 2x ian ,L I U Shu 2lan3 电极电位的测量311 液体接界电位1)定义 两种组成不同、浓度不同或者组成及浓度均不相同的电解液相接触时,在界面上产生的电位差,叫做液体接界电位,以E j 表示。
2)产生原因 当两种组成不同、浓度不同或者组成及浓度均不相同的电解液相接触时,由于两相中相同离子或不同离子存在浓度梯度,必然发生扩散,达稳态时,在两相界面间形成了双电层,双电层所具有的电位差就是液体接界电位。
3)液体接界电位的消除 液体接界电位是不可逆成分,原电池中存在液体接界电位,使原电池电动势的数值丧失热力学意义。
因此在电极电位的测量中必须设法消除或者是将其减到最小。
最常用的方法是采用盐桥,将液体接界电位减到最小。
盐桥实际上是将两种不同溶液隔开的中间溶液,该溶液的浓度很高(一般采用饱和溶液),而且所含正离子与负离子的迁移数比较接近,最常用的是饱和KC l 溶液。
当饱和的KC l 溶液与两种不同溶液相接触时,接界处的电位差主要是由KC l 的扩散产生的,在两个相界面形成的液体接界电位比原来的数值小得多,而且符号相反,因此总的数值将更小。
值得注意的是,盐桥中的溶液不应与原电池中的电解液发生反应,例如待测溶液为A gNO 3溶液,则不能选用KC l 盐桥。
通常用做盐桥的电解质还有KNO 3和N H 4NO 3。
312 电极电位的标度在电极电位的定义中规定,以标准氢电极为负极,待测电极为正极组成原电池,测得该原电池的电动势,叫做待测电极的电极电位,如手册中[1]给出的标准电极电位就是氢标电极电位。
极化曲线是表示电极电势与极化电流或极化电流密度之间关系的曲线。
通常用于研究电极的电化学行为,例如电极的活性、腐蚀行为等。
极化曲线的测定方法有多种,其中最常用的方法是稳态恒电位法。
该方法的步骤如下:
1. 准备电极和电解质溶液,并将电极插入电解质溶液中。
2. 将电极连接到恒电位仪上,并设置电位为0 mV。
3. 通过恒电位仪控制电位,使电极处于不同的电位下,并测量相应的极化电流或极化电流密度。
4. 重复上述步骤,直到覆盖整个电位范围。
5. 绘制极化曲线,并对曲线进行分析和解释。
极化曲线的形状和性质可以反映电极的电化学行为,例如电极的活性、腐蚀行为、氧化还原反应等。
在工业和环境科学领域,极化曲线的测定和分析是非常重要的,可以帮助人们更好地理解和控制电化学反应过程。
极化曲线的测定及应用一、目的要求1.掌握恒电位法测定电极极化曲线的原理和实验技术。
通过测定金属铁在H2SO4 溶液中的阴极极化和阳极极化曲线求算铁的自腐蚀电位、自腐蚀电流和钝化电位范围、钝化电流等参数。
2.了解不同pH值、Cl-浓度、缓蚀剂等因素对铁电极极化的影响。
3.讨论极化曲线在金属腐蚀与防护中的应用。
二、原理Fe在H2SO 4 溶液中会不断溶解,同时产生H2。
Fe溶解:Fe -2e =Fe 2+。
H2析出:2H+ +2e =H2。
Fe电极和H2电极及溶液构成了腐蚀原电池。
其腐蚀反应为:Fe +2H+ = Fe 2+ + H2。
这是Fe在酸性溶液中腐蚀的原因。
当电极不与外电路接通时,阳极反应速率和阴极反应速率相等,Fe溶解的阳极电流I Fe与H2析出的阴极电流I H在数值上相等但方向相反,此时其净电流为零。
I=I Fe + I H=0。
I corr=I Fe=-I H≠0。
I corr值的大小反映净了Fe在H2SO 4 溶液中的腐蚀速率,所以称I corr为Fe在H2SO 4 溶液中的自腐蚀电流。
其对应的电位称为Fe在H2SO 4 溶液中的自腐蚀电位E corr,此电位不是平衡电位。
虽然,阳极反应放出的电子全部被阴极还原所消耗,在电极与溶液界面上无净电荷存在,电荷是平衡的。
但电极反应不断向一个方向进行,I corr≠0,电极处于极化状态,腐蚀产物不断生成,物质是不平衡的,这种状态称为稳态极化。
它是热力学的不稳定状态。
自腐蚀电流I corr和自腐蚀电位E corr可以通过测定极化曲线获得。
极化曲线是指电极上流过的电流与电位之间的关系曲线,即I=f(E)。
图27-1是用电化学工作站测定的Fe在1.0mol/L H2SO4 溶液中的阴极极化和阳极极化曲线图。
ar为阴极极化曲线,当对电极进行阴极极化时,阳极反应被抑制,阴极反应加速, 电化学过程以H2析出为主。
ab为阳极极化曲线,当对电极进行阳极极化时,阴极反应被抑制,阳极反应加速,电化学过程以Fe溶解为主。
文章编号:100123849(2008)0720029206 电极的极化和极化曲线( )①——极化曲线覃奇贤, 刘淑兰(天津大学化工学院,天津 300072)Polar ization of Electrode and Polar ization Curve ( )(the end )——Polar ization CurveQ I N Q i 2x ian ,L I U Shu 2lan3 电极电位的测量311 液体接界电位1)定义 两种组成不同、浓度不同或者组成及浓度均不相同的电解液相接触时,在界面上产生的电位差,叫做液体接界电位,以E j 表示。
2)产生原因 当两种组成不同、浓度不同或者组成及浓度均不相同的电解液相接触时,由于两相中相同离子或不同离子存在浓度梯度,必然发生扩散,达稳态时,在两相界面间形成了双电层,双电层所具有的电位差就是液体接界电位。
3)液体接界电位的消除 液体接界电位是不可逆成分,原电池中存在液体接界电位,使原电池电动势的数值丧失热力学意义。
因此在电极电位的测量中必须设法消除或者是将其减到最小。
最常用的方法是采用盐桥,将液体接界电位减到最小。
盐桥实际上是将两种不同溶液隔开的中间溶液,该溶液的浓度很高(一般采用饱和溶液),而且所含正离子与负离子的迁移数比较接近,最常用的是饱和KC l 溶液。
当饱和的KC l 溶液与两种不同溶液相接触时,接界处的电位差主要是由KC l 的扩散产生的,在两个相界面形成的液体接界电位比原来的数值小得多,而且符号相反,因此总的数值将更小。
值得注意的是,盐桥中的溶液不应与原电池中的电解液发生反应,例如待测溶液为A gNO 3溶液,则不能选用KC l 盐桥。
通常用做盐桥的电解质还有KNO 3和N H 4NO 3。
312 电极电位的标度在电极电位的定义中规定,以标准氢电极为负极,待测电极为正极组成原电池,测得该原电池的电动势,叫做待测电极的电极电位,如手册中[1]给出的标准电极电位就是氢标电极电位。
但是标准氢电极制做麻烦,使用也不方便,因此实际测量中都是采用另外几种参比电极,如甘汞电极、氧化汞电极、硫酸亚汞电极及氯化银电极等。
根据被测电解液的组成可在上述几种参比电极中选择。
由于测量时选用的参比电极不同,便得到了不同标度的电极电位,所以必须在测量结果中注明是相对哪种参比电极,在电极电位的单位之后用英文缩写标明,例如某待测电极相对于饱和甘汞电极的平衡电极电位应写成E e V ,vs SCE (V ersu s Satu rated Calom el E lectrode )。
如果为了与某文献的氢标电极电位数据做对比,则需要采用下式将相对于甘汞电极的电极电位换算成氢标电极电位。
原电池的电动势E 等于正极的电极电位减去负极的电极电位[2]。
测量时若甘汞电极为正极,其电极电位为E 甘汞,待测电极为负极,其电极电位为E 研(待测电极常称做研究电极,其电极电位以E 研表①收稿日期:2007210222作者简介:覃奇贤(19362),男,广西武鸣人,天津大学化工学院教授(已退休)1 示),则E=E甘汞2E研所以 E研=E甘汞2E(1)当甘汞电极在测量中为负极,待测电极为正极时,E=E研2E甘汞所以 E研=E+E甘汞(2)313 电极电位的测量电极的绝对电位是无法测量的,必须借助参比电极测定其相对值,即电极电位。
1)参比电极的选择甘汞电极 H g H g2C l2(s),C(KC l)。
在甘汞电极中通常KC l溶液的浓度有011m o l L、1m o l L及饱和溶液。
对于强酸或强碱性溶液不宜采用甘汞电极,因为在这些溶液中产生的液体接界电位大。
被测溶液中若不允许含有C l2离子,则甘汞电极不能直接插入待测液中。
被测溶液中含有与C l2离子生成沉淀的离子如A g+离子也不宜选用甘汞电极。
氧化汞电极 H g H gO(s),C(OH2)。
在氧化汞电极中常用的碱溶液有011m o l L KOH、1m o l L KOH和011m o l L N aOH。
氧化汞电极适用于碱性溶液的测量。
硫酸亚汞电极 H g H g2SO4(s),C(SO422)。
在该电极中常用的H2SO4浓度有011m o l L和1 m o l L。
适用于含有硫酸盐的溶液。
氯化银电极 A g A gC l(s),C(C l2)。
该电极中常用的KC l浓度有011m o l L、1m o l L,也可以采用011m o l L的HC l溶液。
对于中性氯化物电解液的测量,采用氯化银电极比较方便,因为氯化银电极对C l2离子可逆,可以直接放入待测溶液中,从而避免了液体接界电位。
长期使用的参比电极,特别是使用不当时,其电极电位可能发生变化,因此应定期进行校核。
2)电极电位的测量a1测量方法 在电化学测量中通常将待测电极称做研究电极。
测量研究电极的电极电位是将其与参比电极组成原电池,若待测溶液中含有与参比电极的电极反应可逆的离子,可将参比电极直接放入待测溶液中,没有液体接界电位产生。
如果待测溶液中不含与参比电极电极反应可逆的离子,或者由于两种溶液中有发生化学反应的离子存在,使相互受到污染,则应采用盐桥和中间容器将二者隔开,用高阻抗毫伏表或恒电位仪测量该原电池的电动势,即研究电极相对于参比电极的电极电位,若需要以电极电位表示,可用(1)或(2)式进行换算。
b1几种不同情况下的电极电位平衡电极电位 对于一个可逆电极,当J=0时,电极与溶液界面间的物质转移和电荷转移均处于平衡状态,所测得的电极电位叫做平衡电极电位,以E e表示。
稳定电位 对于一个不可逆电极,当J=0时,在电极与溶液界面同时存在两对电极反应如金属氧化为金属离子和金属离子还原为金属的一对反应以及氢原子氧化为H+离子和H+离子还原为氢的一对反应,达稳态时,电荷的转移达到平衡,但物质的转移并不平衡,即金属的溶解及氢的析出以相同的反应速度在进行着,这种稳态下的电极电位叫做稳定电位,以E s表示。
在这里要特别强调指出的是,在极化曲线测量中,测得J=0时的电极电位,一定要辨别清楚是平衡电位还是稳定电位,不能认为J=0时的电极电位就是平衡电位。
例如以Fe做阴极测量硫酸盐镀铜溶液的阴极极化曲线时,J=0的电极电位是稳定电位,而不是平衡电位。
又如测量金属锌在N aC l溶液中J=0时的电极电位是稳定电位,也就是金属腐蚀与防护领域中的腐蚀电位,以E Co rr表示。
J≠0时的电极电位 系指研究电极上有电流通过时,某一电流密度下的电极电位,以E表示。
例如极化曲线上每点的电极电位都表示对应该点电流密度下的电位数值。
在一定条件下测得研究电极的平衡电极电位或稳定电位都是定值,如果实验的目的是为了测量研究电极上有电流通过时的极化情况,则将J=0时的电极电位统称做起始电位。
4 极化曲线的测量极化曲线的测量分稳态法和暂态法。
稳态极化曲线是指电极过程达稳态时电流密度与电极电位(或过电位)之间的关系曲线。
电极过程达稳态是组成电极过程的各个基本过程,如双电层充电、电化学反应及传质等都达到稳态。
而暂态过程是从电极开始极化到电极过程达到稳态的过程。
与稳态不同,暂态考虑了时间因素。
下面只讨论稳态下极化曲线的测量。
411 稳态极化曲线的测量方法1)恒电流法 也叫控制电流法。
是指控制研究电极的电流密度依次恒定在不同的数值,测量相应的稳态电极电位,二者之间的关系曲线即恒电流极化曲线。
此时电流密度是自变量,电极电位是因变量,其函数关系为E=f(J)。
恒电流法不适用于一个电极电位值对应多个电流密度值的情况,例如具有阳极钝化行为的阳极极化曲线,只能用恒电位法进行测量。
2)恒电位法 也叫控制电位法。
是指控制研究电极的电极电位依次恒定在不同的数值,测量相应的稳态电流密度,二者之间的关系曲线即为恒电位极化曲线。
在这种情况下,电极电位是自变量,电流密度是因变量,其函数关系为J=f(E)。
412 三电极体系测量研究电极的稳态极化曲线,需要同时测定通过研究电极的电流密度和电极电位。
测量中应该采用三电极体系,即研究电极、参比电极和辅助电极。
1)研究电极 要求电极材料组成一定,表面状态均一,有较好的重现性。
经打磨、除油及除锈等表面处理步骤使电极表面具有较低的粗糙度。
应具有确定的易于计算的表面积,非工作面要绝缘。
2)辅助电极 也叫对电极。
其作用是与研究电极构成回路,实现研究电极的极化。
辅助电极的表面积应大于研究电极,最好采用镀铂黑的铂电极。
3)参比电极 用来测量研究电极的电极电位。
参比电极应具有已知的稳定的电极电位,可以在313所介绍的参比电极中选择,有的参比电极已有商品出售,也可以在实验室自行制备。
在测量过程中参比电极不能发生极化,也不能被电解液污染。
以饱和甘汞电极为例介绍一下参比电极的制备方法:a1将图3所示的玻璃半电池管及封装P t丝的玻璃管冼净、烘干;b1把少许经重蒸馏的汞倒入半电池管中,将末端封装P t丝的玻璃管插入汞中,并使P t丝全部浸入汞中;c1在玻璃管中放入少许汞,并在其中插入铜丝作导电用;d1将一定量的甘汞、数滴纯汞和少量KC l饱和溶液一起研磨成糊状物;e1在半电池管的汞上放一层1mm厚的甘汞糊状物,把汞表面完全覆盖;f1在半电池管中吸入经甘汞饱和的饱和KC l溶液,并放入少许固体KC l。
其它如氧化汞电极和硫酸亚汞电极都与饱和甘汞电极的制备方法大同小异。
图3 甘汞电极413 电解池及盐桥1)电解池 测量极化曲线最好选用如图4所示的H型电解池,该电解池便于固定电极,而且将研究电极的电极室与辅助电极的电极室分开,中间用素烧瓷或微孔烧结玻璃隔开,可以防止辅助电极的反应产物对研究电极的污染。
图4 H形电解池2)盐桥 当被测溶液与参比电极溶液不相同时,为了消除液体接界电位,应该用盐桥将二者相连接。
常用的盐桥有以下几种:a1琼脂盐桥 将饱和KC l溶液中加入2%~3%的琼脂,加热溶解后立即灌入U形管中,冷却凝固后即可使用。
在金属电沉积电解液的极化曲线测量中建议不使用琼脂盐桥,因为琼脂是一种有机物,可能会影响极化测量结果。
b1液体盐桥i)U形管盐桥 在玻璃U形管中灌入溶液,两端用卷紧的完全润湿的滤纸塞住,滤纸尽量不要露在玻璃管口外边。
ii)带有旋塞的U形管盐桥 在U形管的中部有一个旋塞,打开旋塞,灌满溶液后关闭旋塞。
iii)带有旋塞和吸管的U形管盐桥 如图4所示,打开旋塞和吸管将与参比电极相同的溶液吸满右端,关闭旋塞再将待测溶液吸满左端后夹紧吸管。
这种盐桥既消除了液体接界电位,又防止了溶液的相互污染。
3)鲁金毛细管 指盐桥靠近研究电极的尖嘴部分(见图4),在极化曲线的测量中,因为有电流通过电解液,溶液中各处都存在不同的电位降,盐桥和研究电极表面之间溶液的电位降将附加在测量的电极电位中,造成不能忽略的误差,鲁金毛细管可以尽量靠近研究电极表面以减小欧姆电位降带来的测量误差,一般尖嘴距研究电极应小于1mm,太近将会屏蔽研究电极表面的电力线。