(完整版)3.1硫酸工业制备
- 格式:doc
- 大小:2.09 MB
- 文档页数:8

工业制硫酸的工艺流程工业制硫酸的工艺流程硫酸是一种广泛应用于工业生产的重要化学品,被广泛用于化肥生产、冶炼、制药等多个领域。
下面将介绍一种常用的工业制硫酸的工艺流程。
首先,硫矿石是制硫酸的主要原料。
硫矿石经过矿石碎磨后,与空气中的氧气反应生成二氧化硫气体。
当然,有时也可使用高纯度的硫粉作为原料。
硫矿石的磨碎是为了增加反应表面积,提高反应速率。
接下来,二氧化硫气体会进入硫磺炉中进行回收。
炉内首先操作是燃烧产生燃烧炉气,将矿石粉末送入烧结器。
在烧结器内,硫矿石首先被加热至160℃,这样可以将矿石中的硫分子升华成为岩芯硫或者岩芯粉。
然后,这些岩芯硫或岩芯粉再通过烟气中炭黑传导的方式将热量传递给炉气。
接下来,矿石中的硫分子会和炉气中的氧气反应生成二氧化硫气体。
这样,硫矿石中的硫就得以转化为硫磺。
在进一步的工艺中,二氧化硫气体会被进一步加工转化为三氧化硫气体SO3。
二氧化硫气体通过CT浓缩和HRSOX过程(冷氧化副硝酸),可以转变为60-62% SO3的SO2-O2混合气体。
这样,得到的气体混合物可以进入SO2-转变反应器,使用催化剂将混合气体中的SO2和O2反应生成SO3。
反应温度一般约为450-500℃,反应压力约为1.3-1.6兆帕。
最后,SO3气体会进入吸收塔与水反应生成硫酸。
在吸收塔中,SO3被与大量的冷却、浓硫酸发生反应,生成硫酸。
这个反应过程是放热反应,反应会产生大量的热量,需要通过冷却器来控制反应温度。
在整个制硫酸的过程中,注意控制反应条件的温度、压力和催化剂的使用,以确保反应的高效率和安全性。
此外,对于产生的废气和废水也要进行环境保护处理。
总之,工业制硫酸的工艺流程主要包括矿石粉碎、硫磺回收、SO2转变为SO3和SO3与水反应生成硫酸等步骤。
这个工艺流程的设计和操作对于提高硫酸产量和质量稳定性至关重要。
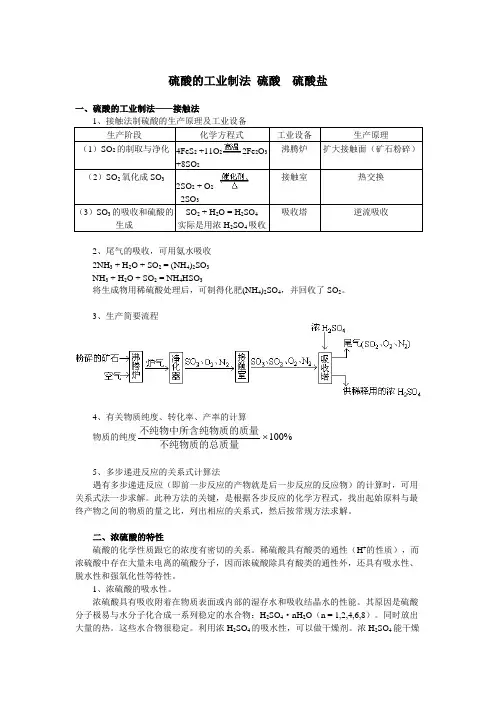
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
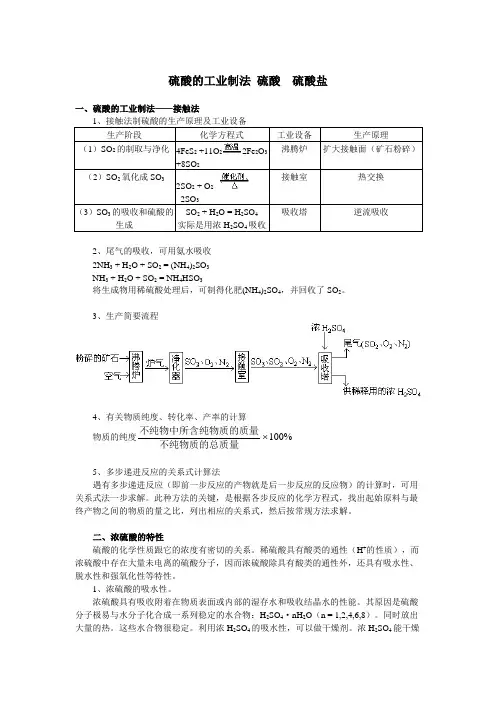
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。


工业制硫酸的三个方程式1. 硫酸的魅力说到硫酸,很多人可能会皱起眉头,觉得它太过于化学,离我们生活太远了。
其实,硫酸在工业上可是个大忙人,几乎无处不在。
它在化肥、塑料、药品等领域都有着举足轻重的地位。
就好像家里的调味料一样,虽然没太引人注意,但一旦缺了它,生活就会变得奇奇怪怪的。
因此,今天咱们就来聊聊工业制硫酸的几个方程式,简单易懂,绝对不会让你打瞌睡!2. 制硫酸的基本步骤2.1 硫的燃烧首先,要制造硫酸,得从硫开始说起。
硫可不是个单纯的小家伙,它得先经过燃烧,变成二氧化硫(SO₂)。
你想啊,就像烤肉一样,肉得先在火上滋滋作响,才能变得香气四溢。
这个反应式可以写作:S + O2 → SO2这里的“+”就像是在说:“来吧,硫和氧一块儿搭伙。
”二氧化硫就这样冒出来了,哇,这味儿真不错。
不过,二氧化硫这家伙可不是个好人,它一来就能让空气变得不那么好闻,所以得想办法再把它变成硫酸。
2.2 二氧化硫的氧化接下来就是二氧化硫的氧化过程。
听上去好像有点复杂,但其实也不难。
二氧化硫要经过催化剂的帮助,变成三氧化硫(SO₃)。
这一步就像是帮它加了个速,让它变得更强大。
这个反应式可以写作:2SO2 + O2 x→{催化剂 2SO3。
看吧,这一步可真是“火上加油”,二氧化硫在催化剂的催动下,转身就变成了三氧化硫。
这可不简单,要是没有催化剂,这个反应可就得慢吞吞的,真是让人无奈。
3. 三氧化硫与水的反应3.1 形成硫酸最后一步,终于迎来了主角硫酸的登场。
三氧化硫遇上水,简直是天生一对,立刻就能反应生成硫酸(H₂SO₄)。
这一刻就像是等了好久的约会,终于成真了!反应式如下:SO3 + H2O → H2SO4看,这一瞬间,硫酸就从水中“扑通”跳了出来。
硫酸的威力可真不小,它不仅是一种强酸,还可以和许多物质发生反应,简直是个“化学万金油”。
3.2 硫酸的应用一旦硫酸生成,它的用途可就多得不得了。
从化肥到洗涤剂,再到电池里的电解液,处处都有它的身影。


化学必修一硫酸工业制备
1、硫酸工业制备:
硫酸工业制备是指以硫酸钾、硫酸铵、硫酸钠等为原料,经过反应、精制、冷却、粉碎、干燥等工序,制备出硫酸的工业化过程。
2、硫酸制备的原料:
硫酸制备的原料主要有硫酸钾、硫酸铵、硫酸钠等。
硫酸钾是由硫酸钙和氢氧化钾反应制备;硫酸铵是由硫酸钙和氨反应制备;硫酸钠是由硫酸钙和氢氧化钠反应制备。
3、硫酸制备的工艺步骤:
(1)加热原料:将硫酸钾、硫酸铵、硫酸钠等原料加入反应釜中,加热至反应温度;
(2)反应:在恒定温度下,将原料反应,生成硫酸;
(3)精制:将反应产物经过过滤、蒸馏、沉淀、洗涤等工序进行精制;
(4)冷却:将精制后的硫酸冷却至室温;
(5)粉碎:将冷却后的硫酸粉碎至要求的粒度;
(6)干燥:将粉碎后的硫酸置于常温下,进行干燥,以达到要求的水分。

硫酸工业制法流程宝子们!今天咱们来唠唠硫酸工业制法的流程呀。
一、原料准备。
咱得先说说原料,制取硫酸的主要原料有硫铁矿,还有硫磺呢。
就像做菜得先准备食材一样,这就是制取硫酸的“食材”。
硫铁矿长啥样呢?它是一种矿石,里面含有很多有用的东西哦。
硫磺呢,相对来说就比较纯净一些,像那种黄色的小颗粒或者块状的东西。
二、硫铁矿的焙烧。
要是用硫铁矿制取硫酸呀,那第一步就是焙烧硫铁矿。
这就好比是把食材放到锅里开始炒啦。
把硫铁矿放到专门的炉子里面,加热到很高的温度。
在这个过程中呢,会发生好多化学反应。
硫铁矿里面的硫化亚铁会和氧气发生反应,生成氧化铁和二氧化硫。
这二氧化硫可重要啦,它是制取硫酸的关键一步。
这个反应可热闹了,就像一场小派对,各种原子啊分子啊在高温下跳来跳去,重新组合。
三、二氧化硫的净化。
从焙烧炉里出来的二氧化硫可不是干干净净就能去制硫酸的哦。
它里面夹杂着好多杂质呢,像灰尘啊、砷的化合物之类的。
这就像咱们买的菜上可能带着泥,得洗干净一样。
要把这些杂质去掉,就需要经过一系列的净化过程。
先让二氧化硫通过除尘装置,把那些灰尘小颗粒都给拦住。
然后再用一些化学方法去除砷等有害物质。
这个过程就像是给二氧化硫做了个大扫除,让它变得干干净净、清清爽爽的。
四、二氧化硫的转化。
净化后的二氧化硫就要开始变身啦。
把它和氧气混合,然后通过一种叫做催化剂的神奇东西。
这个催化剂就像是一个魔法师,在它的作用下,二氧化硫和氧气反应就生成了三氧化硫。
这个反应可没有那么容易哦,得控制好温度、压力还有二氧化硫和氧气的比例这些条件。
就像烤蛋糕,各种配料的比例和烘焙的温度、时间都得刚刚好,蛋糕才能烤得又香又松软。
五、三氧化硫的吸收。
最后一步啦,生成的三氧化硫要被吸收才能变成硫酸。
通常是用浓硫酸来吸收三氧化硫。
三氧化硫一碰到浓硫酸,就像小朋友找到了妈妈一样,立马就结合在一起,形成了发烟硫酸。
然后再经过一些处理,把发烟硫酸变成我们平常使用的硫酸。
这个过程就像是把做好的蛋糕放进盒子里包装好,这样就可以拿出去卖啦,硫酸也就制取完成喽。


硫酸的工业制法制备流程硫酸在工业上那可是相当重要的东西呢。
它的工业制法主要是接触法哦。
这接触法呀,得先从原料说起。
原料主要有硫黄或者含硫矿石,像黄铁矿之类的。
要是用硫黄做原料啊,那相对来说就比较简单直接啦。
硫黄是黄色的固体,看起来就像那种很亮眼的小颗粒一样。
第一步呢,就是制取二氧化硫。
如果是用硫黄来制取的话,就把硫黄放在燃烧炉里燃烧,那反应可激烈啦,硫黄就像个小火球一样,“呼呼”地燃烧起来,生成二氧化硫气体。
要是用黄铁矿的话呢,把黄铁矿粉碎后再放进沸腾炉里煅烧,这个过程也很有趣呢,黄铁矿在里面就像是在开一场热热闹闹的小派对,发生反应后也会生成二氧化硫。
接下来呀,就到了很关键的一步喽。
要把制取出来的二氧化硫进行净化和干燥。
为啥要这么做呢?因为二氧化硫里面可能会夹杂着一些杂质呀,要是不把这些杂质去掉,后面的反应就可能会出岔子。
就好比要去参加一场很重要的比赛,得先把自己收拾得干干净净的一样。
净化的时候,会通过一系列的设备,把那些杂质像灰尘啊、砷啊之类的东西都给去除掉,然后再进行干燥,让二氧化硫变成干干净净、干干爽爽的气体。
再然后呢,就是二氧化硫的转化啦。
把净化干燥后的二氧化硫和空气按照一定的比例混合起来,然后通过一个叫转化器的东西。
在转化器里,有催化剂的帮忙呢,这个催化剂就像是一个神奇的小助手,在它的作用下,二氧化硫和氧气就会发生反应,变成三氧化硫。
这个反应就像是一场神奇的魔法表演,原本的二氧化硫就变成了另一种物质啦。
最后一步啦,就是三氧化硫的吸收。
三氧化硫可不能直接用水来吸收哦,不然会产生酸雾的,就像大雾天开车一样,视线会变得很模糊,这样可不好。
所以呢,一般是用98.3%的浓硫酸来吸收三氧化硫。
三氧化硫就会乖乖地跑到浓硫酸里,这样就得到了我们想要的硫酸啦。
硫酸的工业制法虽然看起来步骤挺多的,但是每一步都很有趣呢。
就像是搭积木一样,一块一块地把各个步骤组合起来,最后就得到了在工业上非常有用的硫酸。
它可以用来制造肥料呀,还能用于化工生产的好多方面呢。
硫酸的工业制备流程下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!硫酸是一种重要的化工产品,在工业生产中有着广泛的应用。
硫酸的工业制法制备流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!按照[硫酸的工业制法制备流程]为主题,以实际应用情况写一篇流程,回答要求步骤详细,回答字数不少于800字。
第一节接触法制硫酸●教学目标1.了解接触法制硫酸的化学原理、原料、生产流程和典型设备。
2.通过二氧化硫接触氧化条件的讨论,复习巩固关于化学反应速率和化学平衡的知识,训练学生应用理论知识分析和解决问题的能力。
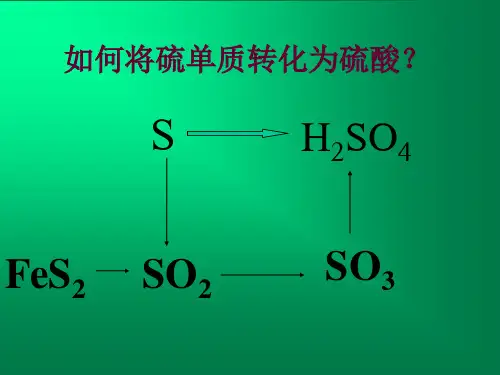
一、反应原理1.S+O2===SO23.SO3+H2O===H2SO4现阶段我国硫酸的生产原料以黄铁矿(主要成分为FeS2)为主,部分工厂用有色金属冶炼厂的烟气、矿产硫黄或从石油、天然气脱硫获得硫黄作原料。
4FeS2+11O2高温=====2Fe2O3+8SO2如以石膏为原料的第一步反应就是:2CaSO4+C∆====2CaO+2SO2↑+CO2二、工业制硫酸的生产流程。
工业上制硫酸主要经过以下几个途径:1、以黄铁矿为原料制取SO2的设备叫沸腾炉。
沸腾炉示意图矿石粉碎成细小的矿粒,是为了增大与空气的接触面积,通入强大的空气流为使矿粒燃烧得更充分,从而提高原料的利用率。
[设问]黄铁矿经过充分燃烧,以燃烧炉里出来的气体叫做“炉气”。
但这种炉气往往不能直接用于制取SO3,这是为什么呢?这是因为炉气中常含有很多杂质,如N2,水蒸气,还有砷、硒的化合物及矿尘等。
这些杂质有些是对生产不利的,如砷硒的化合物、矿尘能够使下一步氧化时的催化剂中毒,水蒸气对设备也有不良影响,因此炉气必须经过净化、干燥处理。
问题:1.N2对硫酸生产没有用处,为什么不除去?2.工业生产上为什么要控制条件使SO2、O2处于上述比例呢?[答案]1.N2对硫酸的生产没有用处,但也没有不利之处,若要除去,势必会增加生产成本,从综合经济效益分析没有除去的必要。
2.这样的比例是增大反应物中廉价的氧气的浓度,而提高另一种反应物二氧化硫的转化率,从而有利于SO2的进一步氧化。
三、生产设备及工艺流程2.接触室根据化学反应原理,二氧化硫的氧化是在催化剂存在条件下进行的,目前工业生产上采用的是钒催化剂。
二氧化硫同氧气在钒催化剂表面上与其接触时发生反应,所以,工业上将这种生产硫酸的方法叫做接触法制硫酸。
二氧化硫发生催化氧化的热化学方程式为:[提问]SO2的接触氧化在什么条件下反应可提高SO2的转化率?SO2的氧化为一可逆反应。
根据勒夏特列原理,加压、降温有利于SO2转化率的提高。
实际生产中反应条件:常压下400℃~500℃。
为什么??二氧化硫在接触室里是如何氧化成三氧化硫的呢?经过净化、干燥的炉气,通过接触室中部的热交换器被预热到400℃~500℃,通过上层催化剂被第一次氧化,因为二氧化硫的催化氧化是放热反应,随着反应的进行,反应环境的温度会不断升高,这不利于三氧化硫的生成。
接触室中部安装的热交换器正是把反应生成的热传递给接触室里需要预热的炉气,同时降低反应后生成气体的温度,使之通过下层催化剂被第二次氧化。
这是提高可逆反应转化率的一种非常有效的方法。
3.吸收塔二氧化硫在接触室里经过催化氧化后得到的气体含三氧化硫一般不超过10%,其余为N2、O2及少量二氧化硫气体。
这时进入硫酸生产的第三阶段,即成酸阶段。
其反应的热化学方程式为:SO3(g)+H2O(l)===H2SO4(l);ΔH=-130.3 kJ/mol从反应原理上看,硫酸是由三氧化硫跟水化合制得的。
事实上,工业上却是用98.3%的浓H2SO4来吸收SO3的,为什么要这样操作呢?从理论上讲,三氧化硫转化为硫酸有二种途径:一种是三氧化硫被硫酸水溶液吸收,与水溶液中的水发生反应生成硫酸。
SO3(g)+H2O(l)H2SO4(l),ΔH<0,这是一个可逆放热反应。
另一途径是用水吸收,但硫酸与水蒸气发生反应生成包含杂质气体的酸雾。
因此,实际生产中,用98.3%的浓硫酸作为吸收剂吸收三氧化硫。
[讨论]1.从吸收塔里排出的尾气有哪些成分,能直接排放到空气中吗?2.尾气应如何处理?[回答]从吸收塔排出的气体主要有N2、O2,少量二氧化硫,若直接排放到空气中,会造成严重的污染,同时也会造成原料的浪费。
因此应将上述气体再次通入接触室进行二次氧化,然后进一步吸收。
也可用NH3吸收SO2以生产亚硫酸铵,或用碱吸收后,再通过加酸生产高浓度二氧化硫和硫酸铵。
●综合能力训练题1.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧B.从沸腾炉出来的炉气需净化,因为炉气中SO 2会与杂质反应C.SO 2氧化为SO 3时需使用催化剂,这样可以提高SO 2的转化率D.SO 3用98.3%的浓H 2SO 4吸收,目的是防止形成酸雾,以便使SO 3吸收完全2.固体A 、B 都由两种相同的元素组成,在A 、B 中两元素的原子个数比分别为1∶1和1∶2,将A 、B 在高温时煅烧,产物都是C(s)和D(g)。
由D 最终可制得E ,E 是非金属元素显+6价的含氧酸,该非金属元素形成的单质通常是一种淡黄色晶体,E 的稀溶液和A 反应时生成G(g)和F(aq),G 通入D 的水溶液,有淡黄色沉淀生成。
在F 中滴入溴水后,加入KOH 溶液有红褐色沉淀生成,加热时又能转变为G 。
根据上述事实回答:(1)A 的化学式是_________,B 的化学式是_________。
(2)写出下列反应的化学方程式:①B 煅烧生成C 和D_________________________________________-②G 通入D 溶液中_____________________________________________③向F 中滴入溴水_______________________________________________1.D2.第一步:根据E 是非金属元素显+6价含氧酸且该非金属元素形成的单质,通常是一种淡黄色固体,所以E 是H 2SO 4。
第二步:A(或B) −−→−煅烧C +D ,D 最终制得E ,E +A −→−G ↑+F,G +D −→−淡黄色沉淀。
该淡黄色沉淀必为S ,进一步验证E 为H 2SO 4,A 和B 中均含S 元素。
第三步:F −−→−2Br−−−→−KOH 红褐色沉淀−→−∆C,该红褐色沉淀必为Fe(OH)3,因此C 为Fe 2O 3,F 为含Fe 2+的溶液,A 和B 中均含Fe 元素。
答案:A 为FeS,B 为FeS 2。
①4FeS 2+11O 2高温=====2Fe 2O 3+8SO 2②2H 2S +H 2SO 3===3S ↓+3H 2O ③6FeSO 4+3Br 2===2Fe 2(SO 4)3+2FeBr 3第二节关于硫酸工业综合经济效益的讨论●教学目标1.使学生常识性地了解化学科学实验与化工生产的区别。
2.使学生对于如何提高化工生产的综合经济效益有一个常识性的认识。
3.通过课堂讨论培养学生分析问题和解决问题的能力。
一、环境保护与综合利用原料在化工生产中某一生产部门产生的三废,即废气、废液、废渣,往往可能是其他生产部门有用的原料。
[提问]硫酸工业生产中产生哪些废物?这些废物又如何处理呢?[回答]硫酸生产的第三阶段,即三氧化硫的吸收阶段从吸收塔中排出含少量二氧化硫的废气。
黄铁矿矿粉在沸腾炉中燃烧后产生大量废渣。
炉气的净化、干燥过程中产生废液。
1、硫酸生产中尾气的处理①氨水吸收,再用硫酸处理SO2+2NH3+H2O===(NH4)2SO3(NH4)2SO3+H2SO4===(NH4)2SO4+SO2↑+H2O②用Na2SO3溶液吸收,然后加热吸收液SO2+Na2SO3+H2O===2NaHSO32NaHSO3∆====Na2SO3+SO2↑+H2O③用NaOH溶液吸收,再用石灰乳和O2处理SO2+2NaOH===Na2SO3+H2ONa2SO3+Ca(OH)2===CaSO3↓+2NaOH2CaSO3+O2===2CaSO4Ca(OH)2+H2SO4===CaSO4+2H2O二、能量的充分利用1.S(s)+O 2(g)===SO 2(g);ΔH =-297 kJ/molFeS 2(s)+411O 2(g) 高温 21Fe 2O 3(s)+2SO 2(g);ΔH =-853 kJ/mol3.SO 3(g)+H 2O(l)===H 2SO 4(l);ΔH =-130.3 kJ/mol很明显,上述反应均为典型的放热反应,假如我们能把这些热量充分利用,有什么重要的意义呢?若充分利用“废热”,则不仅不需要由外界向工厂供能,而且还可以由工厂向外界供能。
三、生产规模和厂址选择现代化工生产一般要求有较大的规模。
因为大型化生产可以降低单位产量投资,便于热能的综合利用和提高劳动生产率,因而总的经济效益较大。
化工厂厂址选择是一个复杂的问题,它涉及原料、水源、能源、土地供应、市场需求、交通运输和环境保护等诸多因素。
●综合能力训练题1.据《中国环境报》报道:从一份科技攻关课题研究结果显示,我国酸雨区已占国土面积的40%以上。
研究结果还表明,我国农业每年因遭受酸雨而造成的经济损失高达15亿多元。
为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)你认为减少酸雨产生的途径可采取的措施是①不用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源。
A.①②③B.②③④⑤C.①③⑤D.①③④⑤(2)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO 2浓度。
在20世纪的60年代~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建造高烟囱的结果,地面浓度降低了30%之多。
请你从全球环境保护的角度,分析这种方法是否可取?并简述其理由。
(3)用传统的煤、石油作燃料,其主要缺点是什么?与传统的煤、石油燃料相比,哪种物质可作为新的能源?主要优点又是什么?(4)目前一座中等城市每年用煤约300万吨,其含硫量如按1%计算,则每一年排放SO2吨,若此SO2有60%转化为H2SO 4,相当于生成吨98%的H2SO4。
(5)为了防止酸雨,降低煤燃烧时向大气排放的SO2,工业上常将生石灰和含硫煤混合使用,请写出燃烧时,有关“固硫”(不使硫化物进入大气)反应的化学方程式,并比较此法与将“石灰石粉末与含硫煤混合”防止酸雨的方法,哪个更好些? (填“生石灰法”或“石灰石法”)(6)国际上最新采用“饱和亚硫酸钠溶液吸收法”,请写出有关反应的化学方程式_____________________________________________2.某空气污染监测仪是根据SO2和Br2的定量反应来测定空气中SO2含量的。
参加反应的溴,来自一个装满酸性(H2SO4)KBr溶液的电解槽阳极上的氧化反应,电解槽的阳极室与阴极室是隔开的。
当测量某地区空气中SO2含量时,空气(经过除尘)以1.5×10-4 m3·min-1的流速进入电解槽的阳极室,电流计显示每分钟通过电子是5.136×10-9 mol,此条件下能保持溴浓度恒定并恰好与SO2完全反应。