第三节__电解池
- 格式:ppt
- 大小:368.00 KB
- 文档页数:15




第三节电解池一、电解原理1、电解池:把电能转化为化学能的装置叫做电解池或电解槽。
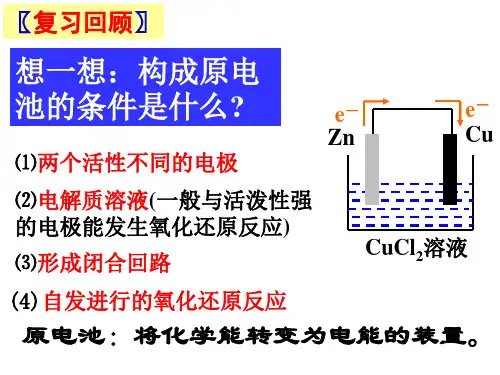
2、电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程3、放电:当离子到达电极时,失去或获得电子,发生氧化还原反应的过程。
反应条件:①连接直流电源②阴阳两极阴极:与电源负极相连;极:与电源正极相连。
③两极处于电解质溶液或熔融电解质中④两电极形成闭合回路4、电子流向:电源负极一电解池阴极一离子定向运动(电解质溶液)一电解池阳极一电源正极5、电极名称及反应:阳极:与直流电源的正极相连的电极,发生氧化反应失去电子;阴极:与直流电源的负极相连的电极,发生还原反应得到电子。
7、电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程8、反应规律:阳极:活泼金属一电极失电子6“ Pt除外);惰性电极一溶液中阴离子失电子阴离子失电子能力:活泼金属(除Pt, Au)>S2->|->Br->Cl->OH->含氧酸根(NO3->SO42-)>F-阳离子得电子能力:Ag+>Hg2+>Fe3+>Cu2+>H+ (酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+ (水)>Al3+>Mg2+>Na+>Ca2+>K+ (即金属活泼性顺序表的逆向)规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件。
9、四类电解型的电解规律(当阳极为惰性电极时)①电解水型(强碱,含氧酸,活泼金属的含氧酸盐),pH由溶液的酸碱性决定,溶液呈碱性则pH增大,溶液呈酸性则pH减小,溶液呈中性则pH不变。
电解质溶液复原一加适量水。
②电解电解质型(无氧酸,不活泼金属的无氧酸盐),无氧酸pH变大,不活泼金属的无氧酸盐pH不变。
电解质溶液复原一加适量电解质。
③放氢生碱型(活泼金属的无氧酸盐),pH变大。


第三节电解池--教学设计与反思一、教材分析(一)教材分析本课时内容是人教版选修教材《化学反应原理》第四章第三节,教材主要介绍了电解原理以及电解原理的应用。
电解属于电化学知识范畴,是中学化学理论体系不可缺少的一部分,是氧化还原反应、原电池、电离等知识的综合运用。
本节教材可分为三个部分:电解原理、电解原理的应用、电镀。
把握教材意图后,我把本节内容安排为两课时完成。
本设计为第一课时。
(二)内容分析具体内容:体验化学能与电能相互转化的探究过程,了解电解池的工作原理。
活动建议:探究电能和化学能的相互转换。
(三)学生分析学生的认知发展水平和知识基础都是我们要考虑的学情。
学生对于电化学较为陌生,生活中电化学相关知识接触较少。
学生求知欲较强,合作意识与探究精神逐渐形成。
二、教学目标知识与技能:了解电解池工作原理,能写出电极反应式和电池反应方程式,初步了解溶液中微粒放电顺序。
过程与方法:利用惰性电极电解水和氯化铜的实验,探究电解原理。
通过观察、实验、阅读资料获取信息,运用科学方法对信息进行加工,提高科学探究能力。
情感态度价值观:学会在思考分析过程中相互讨论,相互启发,体会到合作交流的重要性。
通过电解在生产、生活中的应用实例,感受化学学科的实际应用价值。
三、教学重、难点及其突破策略教学重点:理解电解原理,惰性电极作阳极时电解的一般规律。
教学难点:理解电解原理,电极反应式书写。
突破策略:本教学设计使用启发式教学法和问题探究法,有目的地层层设疑,创设问题情境,通过熟悉的电解水来推导新知,引导学生进行思路探究,将感性认识提升到理性认识,培养和发展学生的抽象思维、归纳推理、演绎推理能力。
有利于学生理解电解质导电的过程和电解原理相关的知识。
四、教学过程教学环节教师活动学生活动设计意图情境引入氢能源是21世纪最有发展潜力的能源。
氢气的制取、储存、运输是科学家研究的重点。
制取氢气的一种方法是电解水。
本次课我们共同研究电解。
观察课件回忆旧知感受新知创设问题情景激起求知欲揭示课题原理讲解1.播放电解水课件。


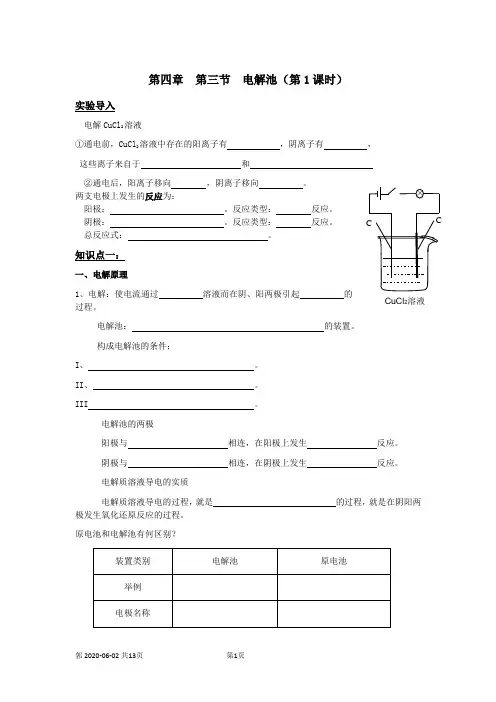
第四章 第三节 电解池(第1课时)实验导入电解CuCl 2溶液①通电前,CuCl 2溶液中存在的阳离子有 ,阴离子有 , 这些离子来自于 和 ②通电后,阳离子移向 ,阴离子移向 。
两支电极上发生的反应为:阳极: 。
反应类型: 反应。
阴极: 。
反应类型: 反应。
总反应式: 。
知识点一:一、电解原理1、电解:使电流通过 溶液而在阴、阳两极引起 的过程。
电解池: 的装置。
构成电解池的条件:I 、 。
II 、 。
III 。
电解池的两极阳极与 相连,在阳极上发生 反应。
阴极与 相连,在阴极上发生 反应。
电解质溶液导电的实质电解质溶液导电的过程,就是 的过程,就是在阴阳两极发生氧化还原反应的过程。
原电池和电解池有何区别?CuCl 2溶液稀H 2SO 4稀H 2SO 4 稀H 2SO 4稀H 2SO 4 练一练:1、判断下列装置是否属于电解池:2、原电池与电解池的比较装置类别原电池 电解池举例(图)电极名称反应类型能量转变 反应是否自发进行知识点二、离子的放电阴极上:由于阴极上要 电子,不管阴极材料是金属还是石墨,此时都不能得电子,因此只能是溶液中的得电子。
阳离子氧化性越强就越得电子。
因此阴极上氧化性强的离子得电子。
金属越不活泼,对应阳离子氧化性越,越得电子。
离子的放电顺序阴极:(阳离子在阴极上的放电顺序(得e-))Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电离的)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+、、、等活泼金属阳离子在水溶液中电解时不得电子。
小结:质量增加,或有氢气产生的电极一定是极。
阳极上:电解池中阳极上要电子,而与溶液中的都可失电子,因此阳极上的电极反应与有关。
由于一般的比阴离子更容易失去电子,因此如果用一般的金属材料做阳极,电解时阳极上是失去电子。
第四章第三节电解池教学目标:1.理解电解原理,初步掌握一般电解反应产物的判断方法2.了解氯碱工业,电镀,电冶金的原理3.掌握电解电极反应式的书写。
教学重点:电解原理及应用教学过程:我们知道化学能可以转变为热能,即反应热。
化学能也能转变为电能,用原电池装置。
今天这节课我们来学习电能如何转化为化学能。
第三节电解池一、电解原理[讲]:首先我们来比较金属导电和电解质溶液导电的区别。
[过渡]:电解质溶液导电的实质是什么呢?一起看实验。
[实验]:现象—一极有气泡,检验为氯气;另一极有红色的物质析出,分析为铜。
[讲]:要分析此现象我们得研究此装置,首先看电极。
1.电极阳极—与电源正极相连阴极—与电源负极相连惰性电极—只导电,不参与氧化还原反应(C/Pt/Au)活性电极—既导电又可参与氧化还原反应(Cu/Ag)问:通电前和通电时分别发生了怎样的过程?通电前:CuCl2=Cu2++2Cl- H2O H++OH-通电中:阳离子(Cu2+,H+)向阴极移动被还原;阴离子(Cl-,OH-)向阳极移动被氧化[讲]:即在电极上分别发生了氧化和还原反应,称电极反应。
2.电极反应( 阳氧阴还 )阳极:2Cl- -2e-=Cl2(氧化)阴极:Cu2++2e-=Cu(还原)总电解方程式:___________________放电:阴离子失去电子或阳离子得到电子的过程叫放电。
3.电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程叫电解。
讲:所以电解质溶液导电的过程,就是电解质溶液的电解过程。
电解池:借助电流引起氧化还原反应的装置,即把电能转化为化学能的装置叫电解池或电解槽。
问:构成电解池的条件是什么?电源、电极、电解质溶液构成闭合回路。
[思考]:电解CuCl2水溶液为何阳极是Cl-放电而不是OH-放电,阴极放电的是Cu2+而不是H+?4.离子的放电顺序阴极:(阳离子在阴极上的放电顺序(得e-))Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电离的)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+阳极(1)是惰性电极时:阴离子在阳极上的放电顺序(失e-)S2->I->Br->Cl->OH->NO3->SO42-(等含氧酸根离子)>F-(2) 是活性电极时:电极本身溶解放电[问]:电解水时为了增强水的导电性常常需加入氢氧化钠或稀硫酸,而不能加食盐原因何在?[练习]:写出电解碘化汞、硝酸铜、氯化锌、盐酸、硫酸、氢氧化钠溶液的电极反应式。