第三节 电解池(上课1)
- 格式:ppt
- 大小:689.00 KB
- 文档页数:29






第三节电解池(第一课时)【学习目标】1.了解原电池与电解池的区別。
2.理解电解池的工作原理。
3.掌握电解池的电极反应式的书写。
【学习重点】原电池的工作原理。
[学习难点】非惰性电极作阳极对电解产物的判断,【温故知新】1.电解质是指在_ __能够导电的化合物。
2.电离是指电解质在_____________ 或_________ 状态下离解成____________ 的过程。
3.原电池是________________________ 的装置°【实验探究】观察实验42,填写下表:一.电解原理1.电解:使电流通过 _ 溶液而在阴、阳两极引起__________ 的过程。
2.电解池:将__________ 能转化为 __________ 能的装豊,也叫 _______________ .3.两个电极,阴极:_________________________ :阳极:_________________________ .4.电解的本质:电解质溶液的导电过程就是电解质溶液的电解过程思考:CuCl:溶液中存在哪些离子?电解时,英他离子为何不放电?二.离子放电顺序阳极:用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易)是:S 2->1 ->Br ->C1 ->0H ->含氧酸根离子〉F-阴极:A計>Fe3+〉Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+) > A13+>Mg2+>Na+>Ca2+>K+ 三.电极反应式的书写: 例:电解NaCl溶液:【练习】:完成下列溶液的电极反应及总反应式。
(以石墨为电极电解)硫酸溶液:盐酸:NaOH溶液:CuBr2溶液:KC1溶液:CuSO4溶液:Na2SO4溶液:四.电解规律1.电解质分解型:无氧酸、不活泼金属的无氧酸盐溶液的电解,水不参加反应2.电解水型:强碱、活泼金属的含氧酸、含氧酸等溶液的电解,只有水参加3.放氢生碱型:电解活泼金属的无氧酸盐时,电解质的阴离子和水电离的H'放电,溶质和水都参加反应,pH增大放氧生酸型:电解不活泼金属的含氧酸盐时,电解质电离的阳离子和水电离的0H离子放电,溶质和水都参加反应,pH减小。



第三节电解池(第1课时电解原理)教学设计一、教学目标1.通过实验探究知道电解池装置的基本构造,能够从电极名称、电极反应、能量转化等方面理解电解池的原理,会正确书写电解池的电极反应式和总反应式;2.通过实验探究建构电解池模型,培养学生观察、分析、推理、归纳等能力,学会运用“宏观-微观-符号”三重表征来解决问题;3.通过实验探究和化学家戴维的介绍,培养学生对化学的学习热情和求知欲,感受科学家的精神品质,培养科学精神与社会责任意识。
二、教学重点、难点教学重点:电解原理思维模型的构建和初步应用及电极反应式的书写。
教学难点:电解原理的微观本质的认识,电解问题思维模型的理解和应用。
三、教学方法实验探究法、分析归纳法、理论联系实际。
四、教学创新点1.本节课采用“宏观-微观-符号”三位体的设计思路,将宏观现象、微观探析、反应式书写融为一体,使学生自主建构电解池模型,使学生逐步深入认识电解过程中的物质及其变化,帮助学生树立正确的世界观,形成科学的方法论。
2.创新实验,采用自己设计微型实验装置电解氯化铜溶液和饱和食盐水,既绿色环保、操作简单快速,又有明显现象,实现更好的学生实验效果。
特别是实验探究过程,先引导学生推理假设,然后进行探究,根据证据推理,构建电解池模型,这样的教学策略很好的培养了学生化学核心素养。
五、教学过程家戴维发现电解的科学一起探究电解的原理。
【展示学习目标】展示学习目标,明确学习内容。
立即引起学生的学习兴趣,增强他们学习的主动性。
问题展示合作探究探究活动一电解池模型的初建【前置作业】下图是水的电解实验,回答下列问题:1.在右图的方框内标出电源的正、负极,并书写该反应化学方程式。
2.书写水的电离方程式,并思考未通电前纯水中有哪些离子?如何运动?3.在接通电源时,纯水中的离子如何运动?为什么会发生这样的运动?4.根据氧化还原反应的知识,H2是怎么产生的?O2又是如何产生的?H2与O2的电极上分别发生了什么反应?5.用能量转化的观点思考,电解水这一过程中存在哪种能量转化?【每课一题】下图中哪一个是原电池装置?图A装置与图B装置有何区别?【归纳总结】引导学生根据电解水的实验归纳总结下列内容:1.电解装置的特点:2.电极名称:3.电极反应:4.电解过程中能量转化:书写电解水的电极反应式和化学方程式概括归理一:通电可以使水电离出的H+和OH-定向移动两极,发生还原反应和氧化反应,将电能转化为化学能。

探究案课题:第三节电解池(第一课时)【学习目标】1. 理解电解的基本原理,初步掌握一般电解反应产物的判断方法;2. 掌握电解、电解池及形成条件;3.【学习重、难点】电解原理、离子放电实质。
【实验探究】1.电解CuCl2溶液如图所示:与电源正极相连的电极叫极,与电源负极相连的电极叫极。
给CuCl2溶液通电时现象:CuCl2溶液阴极上:,经检验该物质是。
阳极上:,经检验该物质是。
【过程分析】CuCl2溶液能导电是因为存在的离子,通电后这些自由移动的离子,在电场作用下作发生移动,带负电的氯离子移向极,在阳极,氯离子失去电子被为氯原子,并两两结合成氯分子,从阳极放出,带正电的铜离子移向极,在阴极铜离子获得电子被成铜原子,覆盖在阴极上。
两电极上的电极反应为阳极:反应类型:反应。
阴极:反应类型:反应。
总反应式:。
2.电解:使电流通过溶液而在阴、阳两极引起的过程。
【合作探究】探究一:电解池:将能转化为能的装置。
构成电解池的条件:①②③④探究二:电解池的工作原理:(以电解CuCl2溶液为例分析)①在CuCl2的电解池装置中,电子从电源的极沿着导线到达电解池的极,从电解池的极沿着导线回到电源的极。
②溶液中的离子在电场作用下到达阴极,得到电子,发生反应;溶液中的离子在电场作用下到达阳极,失去了电子,发生反应;失去了电子流向电源的正极。
就是说:在电解质溶液中依靠的定向移动而形成闭合回路。
【思考】CuCl2溶液存在的离子有Cu2+ 、Cl-、H+和OH-。
通电时,溶液中的Cu2+ 和H+都要移向阴极,但只有Cu2+得电子,发生还原反应;溶液中的Cl-、OH-离子都要移向阳极,但只有Cl-失电子,发生氧化反应。
这说明了什么呢?【知识链接】放电顺序①阴极上:阴极上要得电子,不管阴极材料是金属还是石墨,此时都不能得电子,因此只能是溶液中的阳离子得电子。
阳离子氧化性越强就越容易得电子。
金属越不活泼,对应阳离子氧化性越强,越容易得电子。
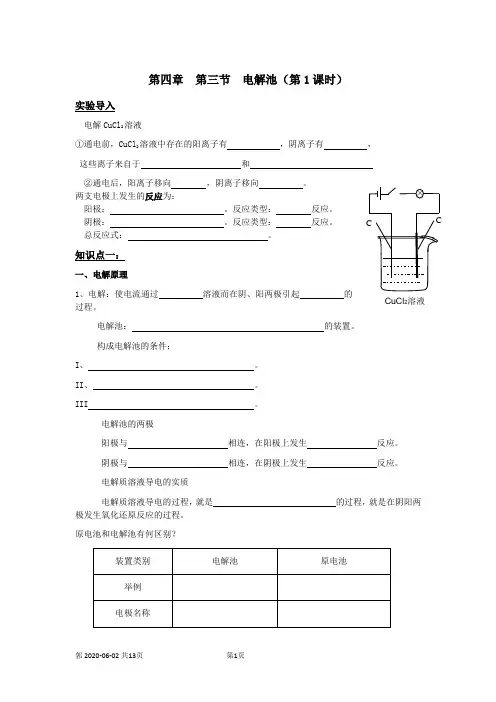
第四章 第三节 电解池(第1课时)实验导入电解CuCl 2溶液①通电前,CuCl 2溶液中存在的阳离子有 ,阴离子有 , 这些离子来自于 和 ②通电后,阳离子移向 ,阴离子移向 。
两支电极上发生的反应为:阳极: 。
反应类型: 反应。
阴极: 。
反应类型: 反应。
总反应式: 。
知识点一:一、电解原理1、电解:使电流通过 溶液而在阴、阳两极引起 的过程。
电解池: 的装置。
构成电解池的条件:I 、 。
II 、 。
III 。
电解池的两极阳极与 相连,在阳极上发生 反应。
阴极与 相连,在阴极上发生 反应。
电解质溶液导电的实质电解质溶液导电的过程,就是 的过程,就是在阴阳两极发生氧化还原反应的过程。
原电池和电解池有何区别?CuCl 2溶液稀H 2SO 4稀H 2SO 4 稀H 2SO 4稀H 2SO 4 练一练:1、判断下列装置是否属于电解池:2、原电池与电解池的比较装置类别原电池 电解池举例(图)电极名称反应类型能量转变 反应是否自发进行知识点二、离子的放电阴极上:由于阴极上要 电子,不管阴极材料是金属还是石墨,此时都不能得电子,因此只能是溶液中的得电子。
阳离子氧化性越强就越得电子。
因此阴极上氧化性强的离子得电子。
金属越不活泼,对应阳离子氧化性越,越得电子。
离子的放电顺序阴极:(阳离子在阴极上的放电顺序(得e-))Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电离的)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+、、、等活泼金属阳离子在水溶液中电解时不得电子。
小结:质量增加,或有氢气产生的电极一定是极。
阳极上:电解池中阳极上要电子,而与溶液中的都可失电子,因此阳极上的电极反应与有关。
由于一般的比阴离子更容易失去电子,因此如果用一般的金属材料做阳极,电解时阳极上是失去电子。