~ 第二辅线系: sn
~ 第一辅线系: dn
R R ,n =3,4,5… 2 2 (2 D p ) (n D s )
R R ,n =3,4,5… 2 2 (2 D p ) (n D d )
柏格曼系:
~ fn
R R , n =4,5,6… (3 D d ) 2 (n D f ) 2 Na原子的?
s
=0 6 5 6 5 4 4
p =1 6 5 4
d =2 6 5 4
柏 格 曼 系
f
=3 H 6 5 4
3 3
3
3
图3.3 Na原子能级图
四、原子实的极化和轨道的贯穿
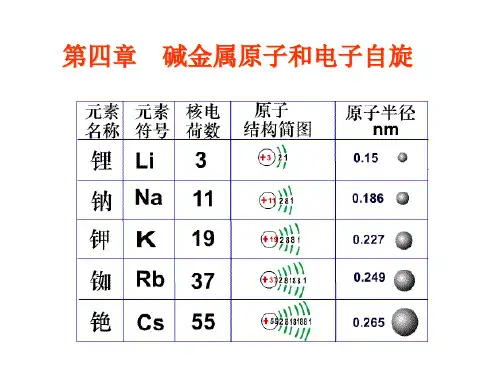
1、原子实模型
碱金属原子= 原子实(有效核电荷数Z*=1)+1个价电子 原子的化学性质及光谱决定于价电子。
Rhc Rhc Enl hcTnl *2 2 n (n D )
能级特点:
1、能量由(n, l)两个量子数决定,主量子数n 相同、角 量子数 l 不同的能级的高低差别很明显; 2、特别是n 较小时,如 n =2, 3,不同l 的能级差别大:
对于相同的n不同l 的能级, l 越小则能级位置越低, 与 氢原子相应能级的差别越大;
3、n相同时,能级的间隔随 l 的增大而减小,
l相同时,能级的间隔随 n 的增大而减小;
4、n很大时,能级与氢的很接近,少数光谱线的波数几 乎与氢的相同。
2、锂原子的能级跃迁
主线系:从l=1的p态→n=2, l=0的2s态, n=2,3,4… 锐线(二辅)系:从l=0的s态→n=2, l=1的2p态, n=3,4,5… 漫线 (一辅)系:从l=2的d态→n=2, l=1的2p态, n=3,4,5… 基线(柏格曼)系:从l=3的f态→n=3, l=2的3d态, n=4,5,6…