共聚焦显微镜简介及免疫荧光染色
- 格式:ppt
- 大小:9.86 MB
- 文档页数:20




一、实验目的1. 熟悉共聚焦显微镜的基本原理和操作方法。
2. 利用共聚焦显微镜观察细胞结构、细胞器和细胞内分子的分布情况。
3. 掌握共聚焦显微镜在生物学研究中的应用。
二、实验原理共聚焦显微镜(Confocal Microscopy)是一种利用激光光源、共聚焦光学系统和计算机图像处理技术进行细胞和组织结构观察的显微镜。
其基本原理是利用激光光源在样品上形成点光源,通过物镜聚焦到样品的焦平面上,激发荧光物质发出荧光。
由于照明针孔与探测针孔相对于物镜焦平面是共轭的,只有焦平面上的光才能通过探测针孔,从而实现对焦平面的荧光信号采集,同时抑制了背景光的干扰。
三、实验材料与仪器1. 实验材料:细胞样品(如酵母细胞、植物细胞等)、荧光染料(如DAPI、FITC 等)、荧光标记抗体等。
2. 实验仪器:共聚焦显微镜、激光光源、物镜、扫描模块、探测器、计算机等。
四、实验步骤1. 样品制备:将细胞样品固定、染色,并进行适当处理,使其适合共聚焦显微镜观察。
2. 设定共聚焦显微镜参数:包括激光光源的波长、扫描速度、扫描范围等。
3. 观察细胞结构:使用共聚焦显微镜观察细胞的结构,如细胞核、细胞质、细胞器等。
4. 观察细胞器:使用荧光染料和荧光标记抗体对细胞器进行染色,观察其分布和形态。
5. 观察细胞内分子:使用荧光标记抗体对细胞内分子进行染色,观察其分布和动态变化。
6. 图像采集与处理:使用共聚焦显微镜采集图像,并通过计算机图像处理技术进行图像分析和三维重建。
五、实验结果与分析1. 观察到细胞核、细胞质、细胞器等细胞结构清晰可见,荧光染料和荧光标记抗体在细胞内分布均匀。
2. 观察到线粒体、内质网、高尔基体等细胞器在细胞内的分布和形态,为细胞器功能研究提供依据。
3. 观察到细胞内分子在细胞内的分布和动态变化,为细胞信号传导和分子调控研究提供线索。
六、实验讨论1. 共聚焦显微镜具有较高的分辨率和信噪比,能够观察细胞内部精细结构,为生物学研究提供有力工具。
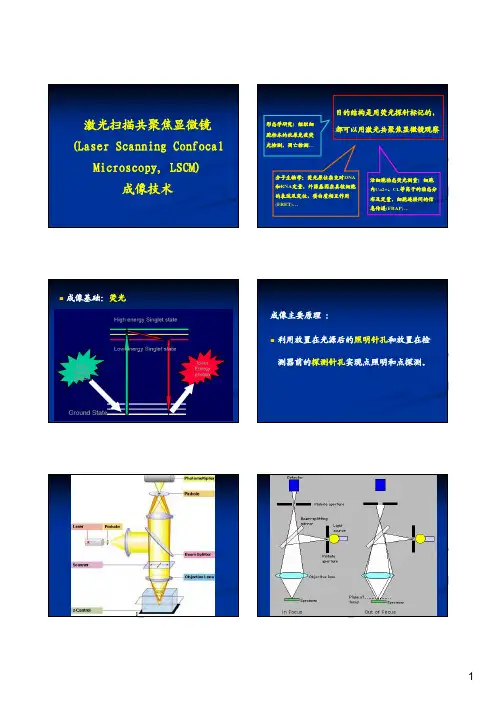
激光扫描共聚焦显微镜(Laser Scanning Confocal Microscopy, LSCM)成像技术目的结构是用荧光探针标记的,都可以用激光共聚焦显微镜观察形态学研究:组织细胞标本的抗原免疫荧光检测,凋亡检测…分子生物学:荧光原位杂交对DNA和RNA定量,外源基因在真核细胞的表达及定位,蛋白质相互作用(FRET)…活细胞动态荧光测量:细胞内Ca2+、Cl-等离子的动态分布及定量,细胞连接间的信息传递(FRAP)…成像基础:荧光成像主要原理:利用放置在光源后的照明针孔和放置在检测器前的探测针孔实现点照明和点探测。
z sections = imagesyzx激光共聚焦显微镜的设计特点:Laser:经过照明针孔后形成点光源,光源方向性强、发散小、亮度高、颜色纯、单色性强Beamsplitter(光束分离器):将样品激发荧光与其他非信号光线分开。
Pinhole (照明针孔和探测针孔):最大限度的阻挡非聚焦平面以及聚焦平面上非焦点斑以外的散射光,以保证探测器针孔所接受到的荧光信号全部来自于样品焦点位置PMT (PhotoMultiplier Tube, 光电倍增管):检测设定范围内的光信号,并将光信号转换成电信号,相当于相机中的CCD或胶卷PMT只能检测到信号的强弱,不能记录信号的颜色,记录的结果通过信号强度和填充颜色表示PMT单位用电压值V表示,数值越大代表信号倍增越大,提高倍增会同时增加图像的正常信号强度和噪声信号强度,使图像的信噪比下降激光扫描共聚焦与传统荧光显微镜的主要区别: 激光扫描共聚焦显微镜只接收共焦点处荧光。
普通荧光显微镜不仅接收焦平面上的光,来自焦平面上方或下方的散射荧光也被物镜接收。
影响来自焦平面以外的荧光使观察到的图像反差和分辨率(焦平面以外的荧光结构模糊、发虚)。
CCDPMTFV1000 (Olympus):多个荧光通道(405, 458, 488, 515, 543, 633),可同时检测多个荧光标记一个透射光通道,透射光图像为非共焦图像激光扫描共聚焦显微镜的主要应用No.1 免疫荧光染色(单标、双标、多标)细胞浆、核、膜抗原的分布、半定量分析 几种抗原的共定位抗原与细胞器的共定位抗原转位No. 2 荧光标记活细胞内成分:氯离子荧光探针:MQAE[N -(Ethoxycarbonylmethyl)-6-methoxyquinolinium bromide]细胞内pH的荧光探针:BCECF AM[2’,7’-bis-(2-carboxyethyl)-5-(and-6)-carboxyfluorescein, acetoxymethyl ester]活性氧荧光探针:DCFH-DANO荧光探针:DAF-FM DA[3-Amino,4-aminomethyl-2’,7’-difluorescein, diacetateNo. 3 荧光标记各种亚细胞结构:细胞内微丝:荧光染料标记的毒蕈肽(phalloidin)细胞膜荧光探针:DiI 即DiIC18(3) [1,1’-dioctadecyl-3,3,3’,3’-tetramethylindocarbocyanine perchlorate,红]和DiO即DiOC18(3) [dioctadecyloxacarbocyanine perchlorate,绿] 内质网探针:荧光标记的glibenclamide高尔基体探针:荧光标记的C5-ceramide。

共聚焦显微镜
共聚焦显微镜,最常见的是共聚焦激光扫描显微镜(CLSM)或激光共聚焦扫描显微镜(LCSM),是一种光学成像技术,可通过使用空间针孔来阻挡散焦光来提高显微图像的光学分辨率和对比度。
在图像形成中。
捕获样品中不同深度的多个二维图像可重建三维结构(此过程称为光学切片)。
该技术广泛用于科学和工业界,典型的应用是生命科学、半导体检查和材料科学。
共聚焦显微镜利用照明点与探测点共轭特性,可有效yi 制同一焦点平面上非测量点的杂散荧光及来自样品中非焦平面的荧光,从而获得普通光镜无法达到的分辨率。
共聚焦显微镜是激光共聚焦扫描显微镜LCSM 的简称,它显微成像主要采用3D 捕获的成像技术,使其具有较高的三维图像分辨率。
这些都是通过构建显微照片来实现的。
在荧光显微镜使用过程中,由于需要高强度紫外光辅助成像,所以显微镜内的汞弧灯产生的强光可能会导致令人不安的背景噪音,甚至会导致光漂白。
共聚焦显微镜以一个微动步进马达控制载物台的升降,可以逐层获得高反差、高分辨率、高灵敏度的二维光学横断面图像,从而对活的或固定的细胞及组织进行无损伤的系列“光学切片”,得到各个层面的信息。
这种功能也被称为细
胞CT或显微CT。


激光扫描共聚焦荧光显微镜原理激光扫描共聚焦荧光显微镜原理一、概述激光扫描共聚焦荧光显微镜(LSCM)是一种高分辨率、高灵敏度的生物成像技术,它通过激光和荧光探针相互作用,实现对生物样品的高清晰成像。
本文将详细介绍LSCM的原理。
二、激发荧光信号的原理LSCM是基于荧光成像技术的,因此了解荧光信号的产生机制非常重要。
在LSCM中,通常使用的探针为有机染料或蛋白质标记物。
这些探针受到激发波长(通常为紫外线或蓝色激光)后会被“激发”到一个高能态,并在短时间内返回基态时释放出能量,即产生荧光信号。
三、扫描共聚焦显微镜系统结构1. 激光器:LSCM中通常使用的激光器为氩离子激光器和氦氖激光器。
它们可以提供不同波长的激发波长,以满足不同探针的需求。
2. 光学系统:光学系统包括激光束聚焦、激光扫描和探测系统。
其中,激光束聚焦是将激光束聚焦到样品上的过程,通常使用的是物镜;激光扫描是将激光束在样品表面移动的过程,通常使用的是振镜;探测系统用于收集荧光信号,并将其转化为数字信号。
3. 样品台和样品固定装置:样品台用于放置样品,通常可以进行XYZ三向移动。
样品固定装置可以确保样品不会在成像过程中移动或震动。
4. 计算机:计算机用于控制整个系统,并处理、分析和显示成像数据。
四、扫描共聚焦显微镜成像原理1. 感应体积:感应体积是指在LSCM中能够产生荧光信号的三维区域。
它由两个因素决定:一个是物镜的数值孔径(NA),另一个是激发波长。
感应体积越小,则分辨率越高。
2. 扫描方式:LSCM采用的是点扫描或线扫描方式。
点扫描方式是将激光束聚焦到样品上的一个点,然后在样品表面移动,重复这个过程直到整个样品成像完毕;线扫描方式是将激光束聚焦成一条线,然后在样品表面移动,重复这个过程直到整个样品成像完毕。
3. 探测方式:LSCM采用的是共聚焦探测方式。
共聚焦探测可以减少背景信号和散射信号的干扰,提高成像信噪比。
五、LSCM应用LSCM广泛应用于生物学研究中,如细胞生物学、神经科学、分子生物学等领域。



荧光显微镜及激光扫描共聚焦显微镜使用可以参照相关参考资料
荧光显微镜是一种放大显微镜,它可以用于观察单个细胞或多个细胞,甚至是单个分子。
它的工作原理是,激发光通过荧光技术和特定的滤色片
将被观察物体的荧光分子特定波长的光波吸收,然后通过精密的放大镜头
进行放大,并通过荧光镜板分别输出激发光和发射光,最后将多波长波段
的发射光通过摄像机捕捉,从而形成的荧光图像。
荧光显微镜的优势之一
是它可以用于检查细胞和其内部的结构,可以检测不同的细胞特性,包括
活性、基因型、蛋白质含量和其他蛋白质表达。
激光扫描共聚焦显微镜是一种表面观察技术,它通过光学系统将多束
激光(称为共聚束)聚合到一个点,从而使能量集中到一个空间仅仅几微
米的点上,引起形成激发光,它可以精确地显示表面的形貌、表面缺陷和
细节。
此外,它还可以在极低的功率下,提供精确的材料成分和表面化学
分析,包括成分的化学结构、光谱以及深度分析,同时还能提供室温下的
探针定量分析。
一、激光扫描共聚焦显微镜简介激光扫描共聚焦显微镜(Confocal laser scanning microscope,简称CLSM)是近代生物医学图像仪器。
它是在荧光显微镜成像的基础上加装激光扫描装置,使用紫外光或可见光激发荧光探针。
利用计算机进行图像处理,从而得到细胞或组织内部微细结构的荧光图像,以及在亚细胞水平上观察诸如Ca2+、pH值、膜电位等生理信号及细胞形态的变化。
二、激光扫描共聚焦显微镜原理在普通宽视野光学显微镜中,整个标本全部都被水银弧光灯或氙灯的光线照明,图像可以用肉眼直接观察。
同时,来自焦点以外的其他区域的荧光对结构的干扰较大,尤其是标本的厚度在2um以上时,其影响更为明显。
激光共聚焦显微镜脱离了传统光学显微镜的场光源和局部平面成像模式,采用激光束作光源,激光束经照明针孔,经由分光镜反射至物镜,并聚焦于样品上,对标本焦平面上每一点进行扫描。
组织样品中如果有可被激发的荧光物质,受到激发后发出的荧光经原来入射光路直接反向回到分光镜,通过探测针孔时先聚焦,聚焦后的光被光电倍增管(PMT)探测收集,并将信号输送到计算机,处理后在计算机显示器上显示图像。
在这个光路中,只有在焦平面的光才能穿过探测针孔,焦平面以外区域射来的光线在探测小孔平面是离焦的,不能通过小孔。
因此,非观察点的背景呈黑色,反差增加,成像清晰。
由于照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔与探测针孔,焦平面以外的点不会在探测针孔处成像,即共聚焦。
以激光作光源并对样品进行扫描,在此过程中两次聚焦,故称为激光扫描共聚焦显微镜。
三、激光扫描共焦显微镜的优点1.动态连续扫描及三维图像重组。
LSCM可以对对活细胞和组织或细胞切片样品的不同层面进行连续逐层扫描,来获得各个层面的图像,即所谓的“无损伤的光学切片”。
激光扫描共聚焦显微镜扫描的每个层面之间的间距可以达到0.1um甚至更小。
获得的图像通过计算机重组,可获得精细的细胞骨架、染色体、细胞器和细胞膜系统的三维图像。
免疫荧光共聚焦胞葬
免疫荧光共聚焦技术是一种结合了免疫荧光技术和激光共聚焦显微镜的技术,用于检测和分析细胞或组织中的蛋白质、抗原或其他生物分子。
胞葬是指细胞通过吞噬或胞吐等方式清除细胞外物质或细胞碎片的过程。
在一些情况下,免疫荧光共聚焦技术可以用于研究胞葬过程。
例如,研究人员可以使用荧光标记的抗体来标记参与胞葬过程的蛋白质,然后使用免疫荧光共聚焦显微镜观察这些蛋白质在细胞内的定位和动态变化。
如果你想了解更多关于免疫荧光共聚焦胞葬的信息,建议你补充相关背景信息后再次提问,或者向专业的生物学家咨询。
激光共聚焦显微镜技术绪论激光共聚焦显微镜技术(Confocal Lasers Scanning Miccruscope CLSM)是将显微镜技术与激光技术有效的结合,对具有荧光标记的物的形态及功能,通过计算机控制可以对其单层面进行快速扫描,也可以对多个层面进行连续光片层扫描。
逐层获得二维光学横断面图像,并可通过计算机三维重组软件支持,获得真三维图像。
激光共聚焦显微镜汇集了激光技术、显微镜技术、免疫荧光技术、计算机及图像处理技术、精密的机械技术等,高、精、尖细胞分析及工程技术于一体的新技术。
使其成为形态学、分子细胞生物学、神经科学、药理学、遗传学等领域中新一代强有力的研究工具。
我们大家知道,从人类制作的第一台显微镜到现在以有几百年的历史来了,随着人类对生命科学研究的不断深入,各种显微镜应运而生,使得研究细胞的手段以更加精密化和多样化。
共聚焦显微镜的理论是在1957年Marvin Minsky提出的,但共聚焦显微镜作为商品推出是在20世纪80年代初期,早期的激光共聚焦显微镜在技术上很不完善,其应用也受到限制。
至到20世纪80年代末,光学系统设计不断改进,成像的质量和灵敏度都有所提高,进入90年代初,激光共聚焦显微镜系统中逐步引入混合激光和紫外激光技术。
90年代末由美国Meridian公司推出的新型激光共聚焦显微镜系统,已具备完善的光学系统,模块化的仪器设计,灵活的软件和高配置的计算机硬件,从而使共聚焦显微镜系统的功能不断升级,应用的领域不断扩展。
随着生命科学研究的不断深入及荧光探针技术的迅速发展,共聚焦显微镜将推动生命科学研究的迅速发展,同时生命科学研究的进展也将使激光显微镜技术不断改进和完善。
激光共聚焦显微镜是现今最为先进的光学显微镜,其主要优点为:以激光为光源,在相应的荧光探针标记后,对样本进行逐点扫描,逐层获得二维光学横断面图像,具有“细胞CT”的功能,并可通过计算机三维重建软件支持,获得真三维图像,并可以任意角度旋转,观察细胞,组织立体形态和空间关系;可以对活细胞和组织进行无损伤的观察,动态测量细胞内的Ca离子浓度和pH值等活细胞生理信息;可对细胞膜的流动性,细胞间通讯,细胞融合,细胞骨架弹性测量等,可用作“光刀子”完成细胞内“外科手术”。
共聚焦显微拍摄的步骤及方法
一、技术简介
激光扫描共聚焦显微镜是在荧光显微镜成像基础上加装了激光扫描装置,利用计算机进行图像处理,把光学成像的分辨率提高了30%-40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察诸如Ca2+ 、PH值,膜电位等生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代强有力的研究工具。
激光扫描共聚焦显微镜以激光作为光源,激光器发出的激光通过照明针孔形成点光源,经过透镜、分光镜形成平行光后,再通过物镜聚焦在样品上,并对样品内聚焦平面上的每一点进行扫描。
样品被激光激发后的出射光波长比入射光长,可通过分光镜,经过透镜再次聚焦,到达探测针孔处,被后续的光电倍增管检测到,并在显示器上成像,得到所需的荧光图像,而非聚焦光线被探测针孔光栏阻挡,不能通过探测针孔,因而不能在显示器上显出荧光信号。
二、实验流程
1. 样品的固定(多聚甲醛固定法)。
2. 组织的冷冻包埋和切片(干冰冷冻包埋法)。
3. 免疫荧光标记。
4. 先在荧光显微镜下观察确认标记成功,然后移至共聚焦显微镜下进行观测。