化学教学:过渡金属元素
- 格式:ppt
- 大小:7.30 MB
- 文档页数:50

I.铁Fe一、铁的结构和性质1.铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:主要化合价:+2,+32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O42Fe+3Cl2==2FeCl3Fe+S= FeSFe+I2= FeI2②跟水反应: 3Fe+4H2O==(高温)== Fe3O4+4H2③跟酸作用:Fe+2H+=Fe2++H2↑(遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+3.生铁与钢的比较4.炼铁和炼钢的比较①还原剂的生成C+O2CO2CO2+C2CO ②铁的还原Fe2O3+3CO2Fe+3CO2③炉渣的生成CaCO3CaO+CO2①氧化:2Fe+O22FeOFeO氧化铁水里的Si、Mn、C等。
如C+FeOFe+CO②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。
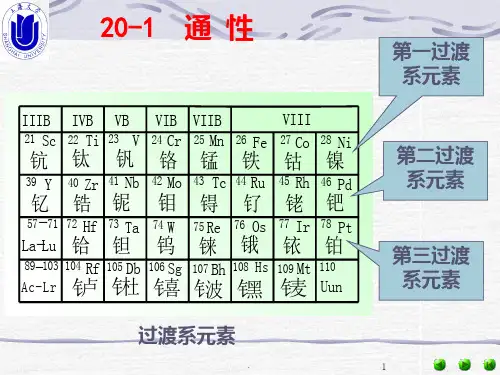
③脱氧,并调整Mn、Si含量2FeO+Si2Fe+SiO2CaO+SiO2CaSiO31.过渡元素位于周期表中中部从ⅢB~ⅡB族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。
过渡金属的密度一般比较大,熔沸点较高,有较高的硬度、较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能。
过渡元素的原子最外层电子数不超过两个,在化学反应中,最外层和次外层都容易失去电子,因此过渡元素有可变化合价。
所以当Fe与弱氧化剂反应时,只失去最外层上的2个电子,形成Fe2+;当Fe与强氧化剂反应时,还能进一步失去次外层上的一个电子,形成Fe3+。

高中化学过渡金属教案教学目标:1. 了解过渡金属的基本性质和特点;2. 掌握过渡金属的电子排布规律;3. 了解过渡金属的反应特点及应用。
教学重点:1. 过渡金属的电子排布规律;2. 过渡金属的反应特点及应用。
教学难点:1. 过渡金属的复杂电子排布规律;2. 过渡金属在化学反应中的角色。
教学准备:1. 实验器材:过渡金属元素样品、试管、试剂等;2. 教学资料:过渡金属相关的教材、PPT等;3. 教学环境:化学实验室或教室。
教学过程:一、导入(5分钟)通过展示过渡金属元素的化学性质和应用场景引入课题。
二、讲解过渡金属的基本性质和特点(10分钟)1. 介绍过渡金属的通用性质,如金属性、导电性等;2. 分析过渡金属元素的电子排布规律,引导学生了解过渡金属的复杂电子结构。
三、展示实验(15分钟)1. 展示过渡金属元素的实验现象,如溶解性、形成配合物等;2. 让学生根据实验现象尝试解释过渡金属的反应特点。
四、讨论与练习(15分钟)1. 针对过渡金属的反应特点开展讨论,引导学生归纳总结;2. 给学生提供练习题目,并指导学生思考过渡金属的应用场景。
五、总结与展望(5分钟)对本堂课的内容进行总结,并引导学生展望过渡金属在未来的研究和应用。
六、作业布置(5分钟)布置相关的作业,巩固学生对过渡金属的理解和应用。
教学反思:通过本节课的教学,学生对过渡金属的基本性质和反应特点有了更深入的了解,同时也培养了学生的实践能力和探究精神。
在未来的教学中,可以结合更多的实验案例和应用场景,提高学生对过渡金属的兴趣和理解深度。







过渡金属元素及其化合物
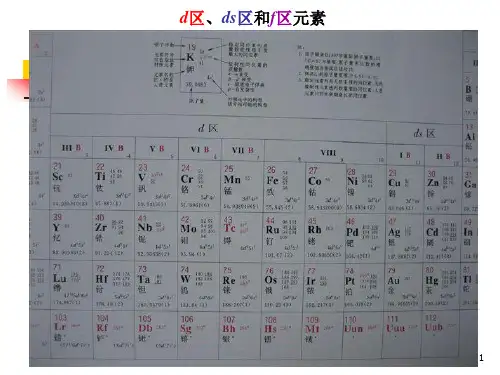
过渡金属元素是指元素周期表中3B~12B族元素,这些元素具有许多独特的性质,包括多种不同的化合价和合金形成能力。
过渡金属元素及其化合物在许多领域的应用广泛,如催化剂、电池材料、磁性材料等。
以下将针对几种常见的过渡金属元素及其化合物进行介绍。
铁(Fe)
铁是一种重要的过渡金属元素,其常见化合物包括氧化铁、碱式氧化铁、羟基氧化铁等。
氧化铁常用于制备磁性材料,如磁性记录材料和磁性试验棒等。
碱式氧化铁是一种具有半导体性质的化合物,在传感器和光电器件中有广泛的应用。
铜(Cu)
铜是另一种常见的过渡金属元素,其化合物包括氧化铜、硫化铜等。
氧化铜是一种重要的半导体材料,常用于制备光电器件和传感器。
硫化铜是一种重要的农药原料,也可用于制备颜料和电池。
铬(Cr)
铬是一种重要的过渡金属元素,其化合物包括氧化铬、硫化铬等。
氧化铬是一种重要的耐磨涂料材料,可用于保护金属表面免受腐蚀和磨损。
硫化铬是一种具有抗菌性能的化合物,常用于制备抗菌剂和防腐剂。
钼(Mo)
钼是一种重要的过渡金属元素,其化合物包括氧化钼、硫化钼等。
氧化钼是一种重要的催化剂材料,可用于制备燃料电池和制药中间体。
硫化钼是一种重要的润滑剂材料,常用于制备高温润滑脂和润滑油。
通过以上介绍,可以看出过渡金属元素及其化合物在各个领域具有重要的应用价值,对于推动科学技术的发展具有重要意义。
希望未来能有更多的研究和应用能够进一步发掘过渡金属元素及其化合物的潜力,为社会进步做出更大的贡献。
过渡元素的名词解释过渡元素,也称为过渡金属,是化学元素周期表中的一部分。
它们位于周期表的中间,处于主族元素和稀有气体之间。
过渡元素的特征是具有多种化学价态,并且具有良好的热和电导性能。
本文将通过对过渡元素的性质和应用的介绍,来深入解释这一概念。
1. 过渡元素的性质过渡元素具有许多独特的性质,使它们在化学和物理领域中具有广泛的应用。
首先,过渡元素的电子配置具有特殊性。
它们的电子填充在d轨道中,因此能够容纳更多的电子。
这也是为什么过渡金属能够形成多个氧化态的原因之一。
正因为这种电子配置的特殊性,过渡元素之间的相互作用和混杂非常复杂,导致它们具有丰富的化学性质。
其次,过渡元素的离子半径逐渐减小。
在周期表中,随着元素的原子序数的增加,过渡金属离子的半径逐渐减小。
这一性质使得过渡元素可以形成复杂的配合物,与其他离子或分子进行配位反应。
这也是过渡金属在催化剂和生物学中广泛应用的原因之一。
另外,由于过渡元素在周期表中的位置接近稀有气体,因此具有稳定的电子云分布和较高的原子核电荷。
这使得过渡元素具有良好的热和电导性能,并且能够形成稳定的化合物。
例如,许多过渡金属是良好的催化剂,它们能够加速化学反应的速率,提高产率和选择性。
2. 过渡元素的应用过渡元素在各个领域具有广泛的应用。
以下将介绍几个重要的领域。
首先是催化剂领域。
过渡金属催化剂被广泛应用于化学反应中。
在催化剂作用下,化学反应的速率可以被显著提高,反应条件也变得更加温和。
许多工业生产中的重要反应都依赖于过渡金属催化剂,如加氢反应、氧化反应和聚合反应等。
其次是生物学领域。
许多生物体内的重要酶活性中心含有过渡金属。
例如,血红蛋白中的铁离子能够与氧气结合,用于氧气的运输;叶绿素中的镁离子参与光合作用过程。
这些过渡金属离子在生物学中起着关键的作用,保证了生物体正常的新陈代谢和生命活动。
此外,过渡元素还被广泛应用于材料科学和电子工程领域。
过渡金属的合金和化合物具有良好的热和电导性能,使它们成为制造高温材料和半导体器件的重要原料。
高三化学教案:过渡元素高三化学教案:过渡元素1.NO3-与Fe2+在酸性条件下,不能共存。
2.过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
3.注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。
FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。
但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
4.忽视亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。
如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
5.忽视铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。
反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
【典型例题评析】例1久置于空气中的下列物质,因被氧化而呈黄色的是(2019年全国高考题)A.浓HNO3B.氯化亚铁溶液C.溴苯D.溴化银思路分析:本题考查的是常见的“黄色体系”有四种固体:本题考查了两个知识点:(1)NH4+在碱性受热条件下不稳定;(2)Fe2+易变质,特别在碱性条件下Fe(OH)2→Fe(OH)3速率极快。
例3将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是(2019年全国高考题)A.硫酸B.氯水C.硝酸锌D.氯化铜思路分析:本题考查Fe2+与Fe3+相互转化。
其中A项中加入硫酸,无任何反应;若加入B项中氯水,因2Fe2++Cl2=2Fe3++2Cl-,故有Fe3+生成;C项中加入Zn(NO3)2,因溶液中有H+,发生反应:3Fe2++4H++NO3-=3F e3++NO↑+2H2O,C正确;D项中加入CuCl2无反应发生。
答案:B、C方法要领:Fe2+有较强的还原性,易被氧化成Fe3+;对于NO3-的隐蔽氧化性,应用时应高度警惕;在离子共存、离子方程式正误判断,及还原性物质在酸性环境中遇NO3-时,往往要考虑其氧化性。