化学式大全
- 格式:doc
- 大小:46.00 KB
- 文档页数:6
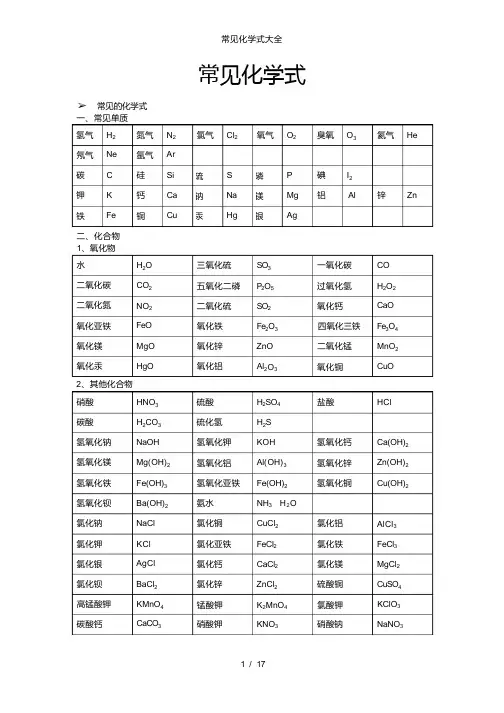
常见化学式➢ 常见的化学式一、常见单质二、化合物 1、氧化物水 H 2O 三氧化硫 SO 3 一氧化碳 CO 二氧化碳 CO 2 五氧化二磷 P 2O 5 过氧化氢 H 2O 2 二氧化氮 NO 2 二氧化硫 SO 2 氧化钙 CaO 氧化亚铁 FeO 氧化铁 Fe 2O 3 四氧化三铁 Fe 3O 4 氧化镁 MgO 氧化锌 ZnO 二氧化锰 MnO 2 氧化汞 HgO氧化铝Al 2O 3氧化铜CuO2、其他化合物硝酸 HNO 3 硫酸 H 2SO 4 盐酸HCl碳酸 H 2CO 3 硫化氢 H 2S氢氧化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌 Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜Cu(OH)2氢氧化钡 Ba(OH)2 氨水 NH 3 ·H 2O氯化钠 NaCl 氯化铜 CuCl 2 氯化铝 AlCl 3 氯化钾 KCl 氯化亚铁 FeCl 2 氯化铁 FeCl 3 氯化银 AgCl 氯化钙 CaCl 2 氯化镁 MgCl 2 氯化钡 BaCl 2 氯化锌 ZnCl 2 硫酸铜 CuSO 4 高锰酸钾 KMnO 4 锰酸钾 K 2MnO 4 氯酸钾 KClO 3 碳酸钙CaCO 3硝酸钾KNO 3硝酸钠NaNO 3臭氧 O 3 氦气 He氖气 碘 I 2铝 Al 锌 Zn铁氮气 氩气 硅 钙 铜H 2 Ne C K FeN 2 Ar Si Ca CuP Mg AgS Na Hg硫 钠 汞磷 镁 银碳 钾 氢气 氧气氯气Cl 2O 23、常见有机化合物初中化学方程式全(已配平) .一、化合反应1、镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO2、铁在氧气中燃烧: 3Fe +2O 2 点燃 Fe 3O 43、铝在空气中燃烧: 4Al+ 3O 2 点燃 2Al 2O 34、氢气在空气中燃烧: 2H 2 +O 2 点燃 2H 2O5、红磷在空气中燃烧: 4P +5O 2 点燃 2P 2O 56、硫粉在空气中燃烧: S+ O 2 点燃 SO 27、碳在氧气中充分燃烧: C +O 2 点燃 CO 28、碳在氧气中不充分燃烧: 2C +O 2 点燃 2CO9、二氧化碳通过灼热碳层: C +CO 2 高温 2CO 10、一氧化碳在氧气中燃烧: 2CO +O 2 点燃 2CO 211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液) : CO 2 +H 2O ===H 2CO 312、生石灰溶于水: CaO+ H 2O === C a (O H )213、无水硫酸铜作干燥剂: CuSO 4 +5H 2O ==== C u S O 4 ·5H 2O甲烷 CH 4 乙醇 C 2H 5OH 葡萄糖 C 6H 12O 6硝酸铁Fe(NO 3)3 硝酸亚铁 Fe(NO 3)2 硝酸铝 Al(NO 3)3 碳酸钠 Na 2CO 3 碳酸钙 CaCO 3 碳酸铵 (NH 4)2CO 3 碳酸氢钠 NaHCO 3 硫酸铁 Fe 2(SO 4)3 硫酸亚铁 FeSO 4 硝酸银 AgNO 3 硝酸钡Ba(NO 3)2硝酸铵NH 4NO 3硫酸钡BaSO 414、钠在氯气中燃烧: 2Na+ Cl 2 点燃 2NaCl二、 分解反应15、实验室用双氧水制氧气: 2H 2O 2 MnO 2 2H 2O +O 2 ↑ 16、加热高锰酸钾: 2KMnO 4 加热 K 2M nO4 + MnO 2 +O 2 ↑17、水在直流电的作用下分解: 2H 2O 通电 2H 2 ↑+O 2 ↑ 18、碳酸化学物理学报不稳定而分解: H 2CO 3 === H 2O +CO 2 ↑ 19、高温煅烧石灰石(二氧化碳工业制法) : CaCO 3 高温 CaO+ CO 2 ↑三、 置换反应20、铁和硫酸铜溶液反应: Fe+ CuSO 4 == F e S O 4 +C u21、锌和稀硫酸反应(实验室制氢气): Zn+ H 2SO 4 == Z n S O 4+ H 2 ↑ 22、镁和稀盐酸反应: Mg +2HCl === MgCl 2 +H 2 ↑23、氢气还原氧化铜: H 2 +Cu O 加热 Cu +H 2O 24、木炭还原氧化铜: C+ 2CuO 高温 2Cu +CO 2 ↑ 25、甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2+2H 2O 26、水蒸气通过灼热碳层: H 2O +C 高温 H 2 +C O 27、焦炭还原氧化铁: 3C +2Fe 2O 3 高温 4Fe +3CO2↑其他28 、氢氧化钠溶液与硫酸铜溶液反应: 2NaOH+ CuSO 4 == Cu(OH)2 ↓+N a 2SO429、甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2 +2H 2O 30、酒精在空气中燃烧: C 2H 5O H + 3O 2 点燃 2CO 2 +3H 2O31、一氧化碳还原氧化铜: CO +CuO 加热 Cu+ CO 232、一氧化碳还原氧化铁: 3CO+ Fe 2O 3 高温 2F e + 3C O 233、二氧化碳通过澄清石灰水(检验二氧化碳): Ca(OH)2+ CO 2 ====CaCO 3 ↓+ H 2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO 2 ==== N a 2CO 3+H 2O35 、石灰石(或小学音乐教案大理石) 与稀盐酸反应(二氧化碳的实验室制法): CaCO 3 +2HCl === CaCl 2 +H 2O +CO 2 ↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理) : Na2CO 3+ 2H C l ===2N a Cl +H 2O +CO 2 ↑ 一. 物质与氧气的反应: (1)单质与氧气的反应:1. 镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO2. 铁在氧气中燃烧: 3Fe+ 2O 2 点燃 Fe 3O 43. 铜在空气中受热: 2Cu+ O 2 加热 2CuO4. 铝在空气中燃烧: 4Al +3O 2 点燃 2Al 2O 35. 氢气中空气中燃烧: 2H 2 +O 2 点燃 2H 2O6. 红磷在空气中燃烧: 4P+ 5O 2 点燃 2P 2O 57. 硫粉在空气中燃烧: S +O 2 点燃 SO 28. 碳在氧气中充分燃烧: C+ O 2 点燃 CO 29. 碳在氧气中不充分燃烧: 2C+ O 2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧: 2CO+ O 2 点燃 2CO 211. 甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2 2H 2O 12. 酒精在空气中燃烧: C 2H 5O H +3O 2 点燃 2CO 2+ 3H 2O二. 几个分解反应:13. 水在直流电的作用下分新概念英语第一册解: 2H 2O 通电 2H 2 ↑+O 2 ↑14. 加热碱式碳酸铜: Cu 2 (OH)2CO 3 加热 2C u O +H 2O +CO 2 ↑ 15. 加热氯酸钾(有少量的二氧化锰): 2KClO 3 ==== 2K C l + 3O 2 ↑16. 加热高锰酸钾: 2KMnO4 加热 K 2M nO 4 +M n O 2 +O 2 ↑ 17. 碳酸不稳定而分解: H 2CO 3 === H 2O +CO 2 ↑ 18. 高温煅烧石灰石: CaCO 3 高温 CaO +CO 2 ↑ 三. 几个氧化还原反应:19. 氢气还原氧化铜: H 2+ C u O 加热 C u + H 2O 20. 木炭还原氧化铜: C+ 2CuO 高温 2Cu +CO 2 ↑2 初三化学方程式大合集21. 焦炭还原氧化铁: 3C+ 2Fe 2O 3 高温 4Fe+ 3CO 2 ↑ 22. 焦炭还原四氧化三铁: 2C +Fe 3O 4 高温 3F e + 2C O 2 ↑23. 一氧化碳还原氧化铜: CO +CuO 加热 Cu+ CO 224. 一氧化碳还原氧化铁: 3CO+ Fe 2O 3 高温 2F e +3C O 225. 一氧化碳还原四氧化三铁: 4CO +Fe 3O 4 高温 3Fe+ 4CO 2四. 单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气 (置换反应)26. 锌和稀硫酸 Zn+ H 2SO 4 = Z nSO 4+ H 2 ↑27. 铁和稀硫酸 Fe +H 2SO 4 = F e S O 4+ H 2 ↑28. 镁和稀硫酸 Mg +H 2SO 4 = M g S O 4 +H 2 ↑ 29. 铝和稀硫酸 2Al+ 3H 2SO 4 = Al 2 (SO 4)3 +3H 2 ↑30. 锌和稀盐酸 Zn +2HCl === ZnCl 2+ H 2 ↑ 31. 铁和稀盐酸 Fe+ 2HCl === FeCl 2+ H 2 ↑32. 镁和语文教案格式稀盐酸 Mg 2HCl === MgCl 2+ H 2 ↑33. 铝和稀盐酸 2Al+ 6HCl == 2AlCl 3 +3H 2 ↑(2)金属单质+ 盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应: Fe+ CuSO 4 === F e S O 4+ C u 35. 锌和硫酸铜溶液反应: Zn+ CuSO 4 === Z n S O 4+ C u 36. 铜和硝酸汞溶液反应: Cu +Hg(NO 3)2 === C u (N O 3)2 +H g(3)碱性氧化物+酸 -------- 盐+ 水37. 氧化铁和稀盐酸反应: Fe 2O 3+ 6HCl === 2FeCl 3+ 3H 2O 38. 氧化铁和稀硫酸反应: Fe 2O 3 +3H 2SO 4 === F e 2 (SO 4)3+ 3H 2O 39. 氧化铜和稀盐酸反应: CuO +2HCl ==== CuCl 2 +H 2O 40. 氧化铜和稀硫酸反应: CuO +H 2SO 4 ==== C u S O 4+ H 2O 41. 氧化镁和稀硫酸反应: MgO+ H 2SO 4 ==== M g S O 4+ H 2O 42. 氧化钙和稀盐酸反应: CaO +2HCl ==== CaCl 2 +H 2O (4)酸性氧化物+碱 -------- 盐+水43. 苛性钠暴露在空气中变质: 2NaOH +CO 2 ==== N a 2CO 3+H 2O 44. 苛性钠吸收二氧化硫气体: 2NaOH +SO 2 ==== N a 2SO 3 +H 2O 45. 苛性钠吸收三氧化硫气体: 2NaOH+ SO 3 ==== N a 2SO 4+ H 2O46. 消石灰放在空气中变质: Ca(OH)2+ C O 2 ==== C a C O 3 ↓+ H 2O47. 消石灰吸收二氧化硫: Ca(OH)2 +S O 2 ==== C a S O 3 ↓+H 2O (5)酸+碱 -------- 盐+水48. 盐酸和烧碱起反应: HCl+ NaOH ==== NaCl+ H 2O49. 盐酸和氢氧化钾反应: HCl+ KOH ==== KCl+H 2O50. 盐酸和氢氧化初中家长会课件铜反应: 2HCl+ Cu(OH)2 ==== C u C l 2+2H 2O51. 盐酸和氢氧化钙反应: 2HCl+ Ca(OH)2 ==== Ca C l 2 +2H 2O52. 盐酸和氢氧化铁反应: 3HCl+ Fe(OH)3 ==== FeCl 3 +3H 2O 53.氢氧化铝药物治疗胃酸过多: 3HCl +Al(OH)3 ==== AlCl 3 +3H 2O54.硫酸和烧碱反应: H 2S O 4 +2N a O H ==== N a 2SO 4 +2H 2O 55.硫酸和氢氧化钾反应: H 2S O 4 +2K O H ==== K 2SO 4 +2H 2O 56.硫酸和氢氧化铜反应: H 2SO4 +Cu(OH)2 ==== C u S O 4 +2H 2O 57. 硫酸和氢氧化铁反应: 3H 2SO 4 +2Fe(OH)3==== F e 2 (SO4)3+ 6H 2O 58. 硝酸和烧碱反应: H N O 3+ N a O H ==== N a N O 3 +H 2O(6)酸+盐 -------- 另一种酸+另一种盐59. 大理石与稀盐酸反应: CaCO 3 +2HCl === CaCl 2 H 2O +CO 2 ↑ 60. 碳酸钠与稀盐酸反应 : Na 2CO 3 +2H C l === 2N a Cl +H 2O+ CO 2 ↑ 61. 碳酸镁与稀盐酸反应 : MgCO 3 +2H C l === Mg Cl 2 +H 2O+ CO 2 ↑ 62. 盐酸和硝酸银溶液反应: HCl+ AgNO 3 === AgCl↓+ HNO 3 63.硫酸和碳酸钠反应: Na 2CO 3 +H 2SO 4 === N a 2SO 4 +H 2O +CO 2 ↑ 64.硫酸和氯化钡溶液反应: H 2S O 4 +BaCl 2 ==== B a S O 4 ↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65. 氢氧化钠与硫酸铜: 2NaOH CuSO 4 ==== C u (O H )2 ↓ N a 2SO 4 66. 氢氧化钠与氯化铁: 3NaOH FeCl 3 ==== Fe(OH)3 ↓ 3NaCl 67. 氢氧化钠与氯化镁: 2NaOH MgCl 2 ==== M g (O H )2 ↓ 2NaCl 68. 氢氧化钠与氯化铜: 2NaOH CuCl 2 ==== C u (O H )2 ↓ 2NaCl 69. 氢氧化钙与碳酸钠: Ca(OH)2 N a 2CO 3 === C a C O 3 ↓ 2N a O H (8)盐+ 盐 ----- 两种新盐70. 氯化钠溶液新概念英语第二册和硝酸银溶液: NaCl +AgNO 3 ====AgCl↓+ NaNO 371. 硫酸钠和氯化钡: Na 2SO 4+ BaCl 2 ==== B a S O 4 ↓+ 2NaCl五. 其它反应:72. 二氧化碳溶解于水: CO 2+ H 2O=== H 2CO 373. 生石灰溶于水: CaO+ H 2O === C a (O H )2 74. 氧化钠溶于水: Na 2O +H 2O ==== 2N a O H 75. 三氧化硫溶于水: SO 3 +H 2O==== H 2SO 4 76. 硫酸铜晶体受热分解: CuSO 4 ·5H 2O 加热 CuSO 4 5H 2O 77. 无水硫酸铜作干燥剂: CuSO 4+ 5H 2O ==== C u S O 4 ·5H 2 化学方程式 反应现象 应用2M g + O 2 点燃或 Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体 .放热.产生大量白烟 白色信号弹2H g +O 2 点燃或 Δ2HgO 银白液体、生成红色固体 拉瓦锡实验2C u + O 2 点燃或 Δ2CuO 红色金属变为黑色固体4Al+ 3O 2 点燃或 Δ2Al 2O 3 银白金属变为白色固体3F e + 2O 2 点燃 Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe+3O2 高温 2Fe 2O 3C+ O 2 点燃 CO 2 剧烈燃烧、白光、放热、使石灰水变浑浊S +O 2 点燃 SO 2 剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰 .氧气中蓝紫色火焰2H 2 O 2 点燃 2H 2O 淡蓝火焰、放热、生成使无水 CuSO 4 变蓝的液体(水)高能燃料4P +5O2 点燃 2P 2O 5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量C H 4+ 2O 2 点燃 2H 2O+ CO 2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水 CuSO 4 变蓝的液体(水) 甲烷和天然气的燃烧2C 2H 2+ 5O 2 点燃 2H 2O +4CO 2 蓝色火焰、放热、黑烟、生成使石灰水变 浑浊气体和使无水 CuSO 4 变蓝的液体(水) 氧炔焰、焊接切割金属 2KClO 3M n O 2 、 Δ2K C l +3O 2 ↑ 生成使带火星的木条复燃的气体 实验室 制备氧气2KMnO 4 Δ K2MnO 4 M nO 2 +O 2 ↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧论文气2H g O Δ2H g + O 2 ↑ 红色变为银白 、生成使带火星木条复燃的气体 拉瓦锡实验2H2O 通电 2H 2 ↑+ O 2 ↑ 水通电分解为氢气和氧气 电解水C u 2 (OH)2CO 3 Δ2Cu O +H 2O+ CO 2 ↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热N H 4HCO 3 ΔN H 3 ↑+ H 2O+ CO 2 ↑ 白色固体消失 、管壁有液体 、使石灰水变浑浊气体 碳酸氢铵长期暴露空气中会消失Z n + H 2SO 4=Z nSO 4 +H 2 ↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气F e +H 2SO 4=F e S O 4 +H 2 ↑ 有大量气泡产生、金属颗粒逐渐溶解M g +H 2SO 4 =M g S O 4 +H 2 ↑ 有大量气泡产生、金属颗粒逐渐溶解 2Al+ 3H 2SO 4=Al 2 (SO4)3+ 3H 2 ↑ 有大量气泡产生、金属颗粒逐渐溶解 Fe 2O 3+3H 2 Δ 2F e +3H 2O 红色逐渐变为银白色、试管壁有液体 冶炼金 属、利用氢气的还原性Fe 3O 4 +4H 2 Δ3Fe+ 4H 2O 黑色逐渐变为银白色英语翻译 、试管壁有液体 冶炼金属、利用氢气的还原性WO 3 +3H 2 Δ W +3H 2O 冶炼金属钨、利用氢气的还原性MoO 3 +3H 2 ΔM o +3H 2O 冶炼金属钼、利用氢气的还原性2Na+ Cl 2 Δ 或点燃 2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、 H 2 +Cl 2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的 形成、制备盐酸CuSO 4 +2N aO H =C u (O H )2 ↓+ N a 2SO 4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验2C +O 2 点燃 2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O 2 点燃 2CO 2 蓝色火焰 煤气燃烧C+ CuO 高温 2Cu+ CO 2 ↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属2Fe 2O 3+ 3C 高温 4Fe+ 3CO 2 ↑ 冶炼金属Fe 3O 4 +2C 高温 3Fe+ 2CO 2 ↑ 冶炼金属 C+ CO2 高温 2COCO 2+ H 2O = H 2CO 3 碳酸使石蕊变红 证明碳酸的酸性小学三语文教学论文H 2CO 3 ΔCO 2 ↑+ H 2O 石蕊红色褪去Ca(OH)2 +C O 2= Ca CO 3 ↓+ H 2O 澄清石灰水变浑浊 应用 CO2 检验和石灰浆粉刷墙壁CaCO 3 +H 2O+ CO 2 = Ca (HCO 3)2 白色沉淀逐渐溶解 溶洞的形成 , 石头的风化Ca(HCO 3)2 Δ CaCO 3 ↓+ H 2O +CO 2 ↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成2N aH CO 3 ΔNa 2CO 3+ H 2O +CO 2 ↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头CaCO 3 高温 CaO +CO 2 ↑ 工业制备二氧化碳和生石灰CaCO 3 +2HCl=CaCl 2+ H 2O +CO 2 ↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢 初中化学方程式汇总 一、 氧气的性质:(1)单质与氧气的反应: (化合反应) 1. 镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO2. 铁在氧气中燃烧: 3Fe+ 2O 2 点燃 Fe 3O 43. 铜在空气中受热: 2Cu+ O 2 加热 2CuO4. 铝在空气中燃烧: 4Al +3O2 点燃 2Al 2O 35. 氢气中空气中燃烧: 2H 2 +O 2 点燃 2H 2O6. 红磷在空气中燃烧(研究空气组成的实验) : 4P +5O 2 点燃 2P 2O 57. 硫粉在空气中燃烧: S +O 2 点燃 SO 2 8. 碳在氧气中充分燃烧: C +O 2 点燃 CO 29. 碳在氧气中不充分燃烧: 2C +O 2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧: 2CO+O 2 点燃 2CO 2 11. 甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2 +2H 2O 12. 酒精在空气中燃烧: C 2H 5O H +3O 2 点燃 2CO 2 +3H 2O(3)氧气的来源:13. 玻义耳研究空气的成分实验 2HgO 加热 Hg +O 2 ↑14. 加热高锰酸钾: 2KMnO 4 加热 K 2M nO 4+ M n O 2 +O 2 ↑(实验室制氧气原理 1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H 2O 2 M nO 22H 2O+ O 2 ↑(实验室制氧气原理 2)二、自然界中的水:16. 水在直流电的作用下分解(研究水的组成实验): 2H 2O 通电2H 2 ↑+O 2 ↑17. 生石灰溶于水英语六级作文: CaO +H 2O == Ca (O H )218. 二氧化碳可溶于水: H 2O+CO 2==H 2CO 3 三、质量守恒定律:19. 镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO20. 铁和硫酸铜溶液反应: Fe+ CuSO 4 === F e S O 4+ C u21. 氢气还原氧化铜: H 2 +C u O 加热 Cu +H 2O 22. 镁还原氧化铜: Mg+ CuO 加热 Cu +MgO 四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧: C + O 2 点燃 CO 224. 木炭还原氧化铜: C + 2CuO 高温 2Cu+ CO 2 ↑ 25. 焦炭还原氧化铁: 3C + 2Fe2O 3 高温 4Fe + 3CO 2 ↑(2)煤炉中发生的三个反应: (几个化合反应) 26. 煤炉的底层: C +O 2 点燃 CO 227. 煤炉的中层: C O 2+ C 高温 2CO28. 煤炉的上部蓝色火焰的产生: 2CO +O 2 点燃 2CO 2(3)二氧化碳的制法与性质:29. 大理石与稀盐酸反应(实验室制二氧化碳) :CaCO 3+ 2HCl == CaCl 2+ H 2O +CO 2 ↑ 30. 碳酸不稳定而分解: H 2CO 3 == H 2O +CO 2 ↑31. 二氧化碳可溶于水: H 2O +CO 2== H 2CO 332. 高温煅烧石灰石(工业制二氧化碳) : C aCO 3 高温 CaO+ CO 2 ↑ 33. 石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳) :Ca(OH)2 +C O 2 === C a C O 3 ↓+H 2O (4) 一氧化碳的性质:34. 一氧化碳还原氧化铜: CO+ CuO 加热 Cu +CO 235. 一氧化碳的可燃性: 2CO +O 2 点燃 2CO 2 其它反应:36. 碳酸钠与稀盐酸反应(灭火器的原理) : N a 2CO 3 2HCl == 2NaCl+ H 2O +CO 2 ↑ 五、燃料及其利用:37. 甲烷在空气中燃烧: CH 4 +2O 2 点燃 CO 2 +2H 2O 38. 酒精在空气中燃烧: C 2H 5OH +3O2 点燃 2CO 2 +3H 2O39. 氢气中空气中燃烧: 2H 2+ O 2 点燃 2H 2O 六、金属(1)金属与氧气反应:40. 镁在空气中燃烧: 2Mg+ O 2 点燃 2MgO 41. 铁在氧气中燃烧: 3Fe +2O 2 点燃 Fe 3O 4 42. 铜在空气中受热: 2Cu +O 2 加热 2CuO 43. 铝在空气中形成氧化膜: 4Al+ 3O 2 = 2Al 2O 3(2)金属单质 酸 -------- 盐 氢气 (置换反应)44. 锌和稀硫酸 Zn+ H 2SO 4 = Z nSO 4+ H 2 ↑ 45. 铁和稀硫酸 Fe +H 2SO 4 = F e S O 4 +H 2 ↑ 46. 镁和稀硫酸 Mg +H 2SO 4 = M g S O 4+ H 2 ↑ 47. 铝和稀硫酸 2Al+ 3H 2SO 4 = Al 2 (SO 4)3 +3H 2 ↑48. 锌和稀盐酸 Zn+ 2HCl == ZnCl 2+ H 2 ↑ 49. 铁和稀盐酸 Fe +2HCl == FeCl 2 +H 2 ↑ 50. 镁和稀盐酸 Mg +2HCl == MgCl 2+ H 2 ↑ 51. 铝和稀盐酸 2Al+ 6HCl == 2AlCl 3 +3H 2 ↑(3)金属单质 盐怎样学好高中物理(溶液) ------- 新金属 新盐 52. 铁和硫酸铜溶液反应: Fe +CuSO 4 == F e S O 4 +C u53. 锌和硫酸铜溶液反应: Zn +CuSO 4 ==Z n S O 4 +Cu 54. 铜和硝酸汞溶液反应: Cu +Hg(NO 3)2 == C u (N O 3)2 +H g(3)金属铁的治炼原理: 55. 3CO +2Fe 2O 3 高温 4Fe +3CO 2 ↑七、酸、碱、盐 1、酸的化学性质(1) 酸 金属 -------- 盐 氢气(见上)(2) 酸 金属氧化物-------- 盐 水56. 氧化铁和稀盐酸反应: Fe 2O 3 +6HCl ==2FeCl 3 +3H 2O 57. 氧化铁和稀硫酸反应: Fe 2O 3 +3H 2S O 4 == F e 2 (SO4)3 +3H 2O 58. 氧化铜和稀盐酸反应: CuO +2HCl ==CuCl 2 +H 2O59. 氧化铜和稀硫酸反应: CuO+ H 2S O 4 == C uS O 4+ H 2O (3) 酸 碱 -------- 盐 水(中和反应) 60. 盐酸和烧碱起反应: HCl +NaOH == NaCl+H 2O 61. 盐酸和氢氧化钙反应: 2HCl+ Ca(OH)2 == CaCl 2+2H 2O 62. 氢氧化铝药物治疗胃酸过多: 3HCl +Al(OH)3 == AlCl 3 +3H 2O63. 硫酸和烧碱反应: H 2SO 4+ 2N a O H == N a 2SO 4 +2H 2O(4) 酸 盐 -------- 另一种酸 另一种盐64. 大理石与稀盐酸反应: CaCO 3+ 2HCl == CaCl 2 +H 2O+ CO 2 ↑ 65. 碳酸钠与稀盐酸反应 : Na 2CO 3 +2H C l == 2N a Cl + H 2O+ CO 2 ↑ 66. 碳酸氢钠与稀盐酸反应: NaHCO 3 +HCl== Na Cl+H 2O+ CO 2 ↑ 67. 硫酸和氯化钡溶液反应: H 2SO 4 +BaCl 2 == B a S O 4 ↓+2HCl 2、碱的幼儿园小班音乐教案化学性质 (1) 碱 非金属氧化物 -------- 盐 水68. 苛性钠暴露在空气中变质: 2NaOH+CO 2 == N a 2CO 3+ H 2O 69. 苛性钠吸收二氧化硫气体: 2NaOH +SO 2 == N a 2SO 3 +H 2O 70. 苛性钠吸收三氧化硫气体: 2NaOH+ SO 3 == N a 2SO 4 +H 2O 71. 消石灰放在空气中变质: Ca(OH)2+ C O 2 == C a C O 3 ↓+H 2O 72. 消石灰吸收二氧化硫: Ca(OH)2 +S O 2 == C a S O 3 ↓+ H 2O (2)碱 酸-------- 盐 水(中和反应,方程式见上) (3)碱 盐 -------- 另一种碱 另一种盐73. 氢氧化钙与碳酸钠: Ca(OH)2 +N a 2CO 3 == C a C O 3 ↓+ 2N a O H3、盐的化学性质(1)盐(溶液) 金属单质------- 另一种金属 另一种盐74. 铁和硫酸铜溶液反应: Fe+ CuSO 4 == F e S O 4 +C u (2) 盐 酸-------- 另一种酸 另一种盐75. 碳酸钠与稀盐酸反应 : Na 2CO 3 +2H C l == 2N a Cl +H 2O+ CO 2 ↑碳酸氢钠与稀盐酸反应: NaHCO 3 +HC l == Na Cl + H 2O +CO 2 ↑点燃(3) 盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠: Ca(OH)2 +N a 2CO 3 == C a C O 3 ↓+ 2N a O H(4) 盐 盐 ----- 两种新盐77. 氯化钠溶液和硝酸银溶液: NaCl +AgNO 3 == AgCl↓+NaNO 3 78. 硫酸钠和氯化钡: Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中: CO 2 + Ca(OH)2 == CaCO 3 ↓+ H 2O2、氢氧化钠在空气中变质: CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫: SO 2 + 2NaOH ==Na 2SO 3+ H 2O 4 、一氧化碳还原氧化铜: CO + CuO C + CO 2 5、酒精燃烧: C 2H 5OH + 3O 2 点CO 2 + 3H 2O6、甲烷燃烧: CH 4 + 2O 2 CO 2 + 2H 2O。

化学式大全1.元素符号:HHeCNOFNeNaMgAlSiPSCl氢氦碳氮氧氟氖钠镁铝硅磷硫氯ArKCaMnFeCuZnAgBaPtAuHgI氩钾钙锰铁铜锌银钡铂金汞碘2.常见离子和化合物中元素的化合价:H+Na+K+Ag+NH4++1价氢离子钠离子钾离子银离子铵根离子Ca2+Mg2+Cu2+Ba2+Zn2+Fe2++2价钙离子镁离子铜离子钡离子锌离子亚铁离子Fe3+Al3++3价铁离子铝离子Cl-OH-NO3--1价氯离子氢氧根离子硝酸根离子O2-SO42-CO32--2价氧离子硫酸根离子碳酸根离子3.常见物质的化学式与名称:单质:C:碳S:硫P:磷Fe:铁Mg:镁Al:铝Hg:汞Zn:锌Cu:铜Ag:银O2:氧气H2:氧气N2:氮气O3:臭氧氧化物:CO:一氧化碳CO2:二氧化碳SO2:二氧化硫MnO2:二氧化锰SO3:三氧化硫H2O2:过氧化氢CuO:氧化铜CaO:氧化钙MgO:氧化镁HgO:氧化汞Fe2O3:氧化铁Al2O3:氧化铝H2O:水P2O5:五氧化二磷Fe3O4:四氧化三铁酸:HCl:盐酸H2SO4:硫酸HNO3:硝酸H2CO3:碳酸H2S亚硫酸CH3COOH:醋酸碱:NaOH:氢氧化钠Ca(OH)2:氢氧化钙KOH:氢氧化钾Mg(OH)2:氢氧化镁Cu(OH)2:氢氧化铜NH3.H2O氨水Fe(OH)3:氢氧化铁Al(OH)3:氢氧化铁盐酸盐:KCl:氯化钾NaCl:氯化钠KCl:氯化钾AgCl:氯化银CuCl2:氯化铜CaCl2:氯化钙MgCl2:氯化镁ZnCl2:氯化锌BaCl2:氯化钡FeCl2:氯化亚铁AlCl3:氯化铝FeCl3:氯化铁碳酸盐:CaCO3:碳酸钙Na2CO3:碳酸钠NaHCO3:碳酸氢钠BaCO3:碳酸钡K2CO3:碳酸钾NH4HCO3:碳酸氢铵硫酸盐:Na2SO4:硫酸钠ZnSO4:硫酸锌MgSO4:硫酸镁CaSO4:硫酸钙CuSO4:硫酸铜BaSO4:硫酸钡FeSO4:硫酸亚铁Fe2(SO4)3:硫酸铁Al2(SO4)3:硫酸铝(NH4)2SO4:硫酸铵Na2SO3:亚硫酸钠硝酸盐:AgNO3:硝酸银NaNO3:硝酸钠Cu(NO3)2:硝酸铜KNO3:硝酸钾NH4NO3:硝酸铵NaNO2:亚硝酸钠钾盐:KMnO4:高锰酸钾K2MnO4:锰酸钾KClO3:氯酸钾有机化合物:C2H5OH:乙醇C6H12O6:葡萄糖CH4:甲烷九年级化学方程式分类:1.碳充分燃烧:C+O22.碳不充分燃烧:2C+O3.一氧化碳燃烧:2CO+O24.产生一氧化碳:C+CO5.硫燃烧:S+O26.红磷燃烧:4P+5O2O57.氢气燃烧:2H2+O2点燃2O8.铁燃烧:3Fe+2O3O49.镁燃烧:2Mg+O10.铝燃烧:4Al+3O2O311.甲烷燃烧:CH4+2O2+2H2O12.酒精燃烧:C2H5OH+3O2点燃2+3H2O13.呼吸原理:C6H12O6+6O26CO2+6H2O14.高锰酸钾制氧气:2KMnO2MnO4+MnO2+O2↑215.氯酸钾制氧气:2KClO3MnO2KCl+3O2↑△16.过氧化氢制氧气:2H2O2MnO22O+O2↑17.水通电分解:2H2O2H2↑+O2↑18.氧化汞分解:2↑19.实验室制氢气的原理:Zn+H2SO4=ZnSO4+H2↑20.镁或硫酸性质:Mg+H2SO4=MgSO4+H2↑21.铁或硫酸性质:Fe+H2SO4=FeSO4+H2↑22.铝或硫酸性质:2Al+3H2SO4=Al2(SO4)3+H2↑23.镁或盐酸性质:Mg+2HCl=MgCl2+H2↑24.锌或盐酸性质:Zn+2HCl=ZnCl2+H2↑25.铁或盐酸性质:Fe+2HCl=FeCl2+H2↑26.铝或盐酸性质:2Al+6HCl=2AlCl3+3H2↑27.酸或碱的性质:NaOH+HCl=NaCl+H2O28.酸或碱的性质:Ca(OH)2+2HCl=CaCl2+H2O29.酸或碱的性质:2NaOH+H2SO4=Na2SO4+2H2O30.酸或碱的性质:Ca(OH)2+H2SO4=CaSO4+2H2O30.除铁锈的原理或金属氧化物与酸的性质: Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O31.制取CO2或CaCO3作补钙药剂:CaCO3+2HCl=CaCl2+CO2↑+H2O32.碳酸盐或酸的性质:Na2CO3+2HCl=2NaCl+CO2↑+H2O33.治疗胃酸过多症的原理:NaHCO3+HCl=NaCl+CO2↑+H2O34.氯化钠与硝酸银反应产生白色沉淀:NaCl+AgNO3=NaNO3+AgCl↓35.制取氢氧化钠的原理:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH36.氢氧化钠与硫酸铜反应产生蓝色沉淀:2NaOH+CuSO4=Na2SO4+Cu(OH)237.制取水煤气的原理:C+H2O2+CO38.氢气还原氧化铜:H2+2O39.碳还原氧化铜:C+2CuO2↑40.一氧化碳还原氧化铜:241.氢气还原氧化铁:Fe2O3+3H2O42.碳还原氧化铁:2Fe2O3+3C2↑43.工业炼铁的原理:Fe2O3+3CO244.铁置换硫酸铜中的铜:Fe+CuSO4=Cu+FeSO445.铜置换硝酸银中的银:Cu+2AgNO3=2Ag+Cu(NO3)246.铝置换硫酸铜中的铜:2Al+3CuSO4=3Cu+Al2(SO4)347.生石灰制熟石灰:H2O+CaO=Ca(OH)248.碳酸不稳定:H2CO3=H2O+CO2↑49.工业制生石灰的原理:CaCO2↑50.检验CO2或澄清石灰水变浑浊原理:CO2+Ca(OH)2=CaCO3↓+H2O51.烧碱变质的原理:CO2+2NaOH=Na2CO3+H2O52.碱与非金属氧化物的性质: SO2+2NaOH=Na2SO3+H2OSO3+2NaOH=Na2SO4+H2O53.非金属氧化物的性质:H2O+CO2=H2CO3H2O+SO2=H2SO3H2O+SO3=H2SO4三氧化二铁化学式H2OFe2O3Cu2(OH)2CO3C2H5OHCH3OHCH3COOHNa2CO3·10H2OCuSO4·5H2OFeS O4·7H2OCaCl2·6H2OCaSO4·2H2ONa2SO2H2N2Cl2NH3COCO2SO2SO3NO2CH4C2H2CaOMgOZnOCuOHgOAg2OMnO2Al2 O3Fe2O3式量描述18H2O是常见的碱,具有碱的通性,是一种不含金属离子的碱160 221也叫孔雀石;化学名:碱式碳酸铜;绿色固体4632木精(工业酒精)60CH3COO-:醋酸根离子。

非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2 2F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2 F2 +2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2 +2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3 Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 O2+K===KO2S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnSN2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2N2+6Na===2Na3N N2+6K===2K3N N2+6Rb===2Rb3NP2+6H2===4PH3 P+3Na===Na3P 2P+3Zn===Zn3P22.还原性S+O2===SO2 S+O2===SO2 S+6HNO3(浓)===H2SO4+6NO2+2H2O 3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO 4P+5O2===P4O10(常写成P2O5) 2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5 P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4 C+2Cl2===CCl4 2C+O2(少量)===2COC+O2(足量)===CO2 C+CO2===2CO C+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4 (SiCl4+2H2===Si(纯)+4HCl) Si(粉)+O2===SiO2Si+C===SiC(金刚砂) Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O 3S+6NaOH===2Na2S+Na2SO3+3H2O 4P+3KOH(浓)+3H2O===PH3+3KH2PO2 11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO43C+CaO===CaC2+CO 3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH 4Na+O2===2Na2O 2Na2O+O2===2Na2O2 2Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H2 2Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+Ti Mg+Cl2===MgCl2 Mg+Br2===MgBr2 2Mg+O2===2MgOMg+S===MgS Mg+2H2O===Mg(OH)2+H2 2Mg+TiCl4(熔融)===Ti+2MgCl2 Mg+2RbCl===MgCl2+2Rb 2Mg+CO2===2MgO+C 2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2 Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl3 4Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg4Al+3MnO2===2Al2O3+3Mn 2Al+Cr2O3===Al2O3+2Cr 2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe 2Al+6HCl===2AlCl3+3H2 2Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O 2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3 Fe+I2===FeI2 Fe+S===FeS 3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2 Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O 4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O2 2H2S+3O2(足量)===2SO2+2H2O 2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2O H2S+H2SO4(浓)===S+SO2+2H2O 3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2OH2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O 2NH3+3Cl2===N2+6HCl 8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O 4NH3+5O2===4NO+6H2O 4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H2 4NaH+TiCl4===Ti+4NaCl+2H2 CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O (此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2 H2S+CuCl2===CuS+2HCl H2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HCl H2S+Pb(NO3)2===PbS+2HNO3 H2S+FeCl2===2NH3+2Na==2NaNH2+H2 (NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4Cl NH3+HNO3===NH4NO3 2NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4,不稳定性:2H2O===2H2+O2 2H2O2===2H2O+O2 H2S===H2+S 2NH3===N2+3H2四,非金属氧化物低价态的还原性:2SO2+O2===2SO3 2SO2+O2+2H2O===2H2SO4 (这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HCl SO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HI SO2+NO2===SO3+NO2NO+O2===2NO2 NO+NO2+2NaOH===2NaNO2 (用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2 CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2 CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2O SO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH (不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O 2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C (CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2O SiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3 SO3+H2O===H2SO43NO2+H2O===2HNO3+NO N2O5+H2O===2HNO3P2O5+H2O===2HPO3 P2O5+3H2O===2H3PO4 (P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3 SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4 SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2O CO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O 2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3 SiO2+2NaOH===Na2SiO3+H2O (常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2 SiO2+CaCO3===CaSiO3+CO2五,金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4 FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O (此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应:BaO2+H2SO4(稀)===BaSO4+H2O2) MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4 Na2O+CO2===Na2CO3 Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2 Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4 MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物: Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2O Fe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2O Fe3O4+8HCl===FeCl2+2FeCl3+4H2O六,含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HCl HClO3+HI===HIO3+HCl 3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O 2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O 2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2O H2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H2 2H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O 6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O 6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O 30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O 36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4 H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HF H2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HCl H2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO4 2H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca (H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO3 2HNO3+CaCO3===Ca(NO3)2+H2O+CO2 (用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBr H3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O2 4HNO3===4NO2+O2+2H2O H2SO3===H2O+SO2H2CO3===H2O+CO2 H4SiO4===H2SiO3+H2O七,碱低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2O NaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O 2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2O NaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O 2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaCl NaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2O Mg(OH)2+2NH4Cl===MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O 2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2O Cu(OH)2===CuO+H2O八,盐1,氧化性:2FeCl3+Fe===3FeCl2 2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2 FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S 2FeCl3+2KI===2FeCl2+2KCl+I2 FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl3 3Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O 2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4Cl AlCl3+3NH3.H2O===Al(OH)3+3NH4Cl FeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaCl Na2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaCl Na2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO2 3Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2O NH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO2 2KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O2 2KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O2 2NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2 CaCO3===CaO+CO2 MgCO3===MgO+CO2。
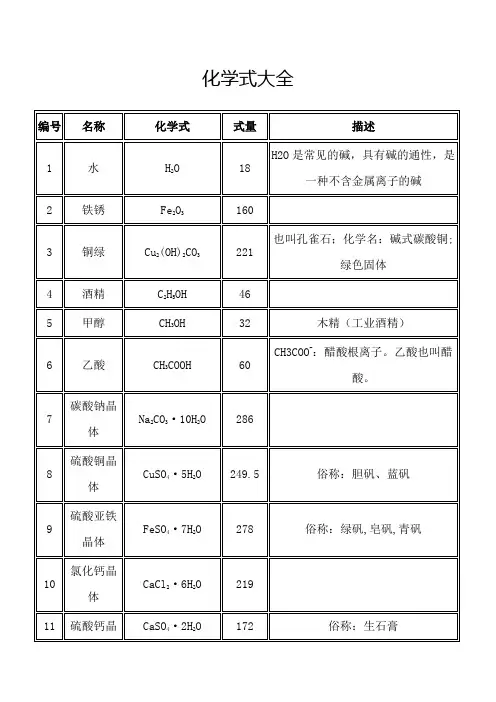

化学表达式大全一、单质的的化学式氦气He、氖气Ne、氩气Ar、氪气Kr、氙气Xe、氡气Rn金Au、银Ag、铜Cu、铁Fe、铝Al、钙Ca、钠Na、钾K碳C、磷P、硫S、硅Si、硼B、砷As、氢气H2、氧气O2、氮气N2、氟气F2、氯气Cl2、溴水Br2、碘I2臭氧O3、白磷P4二、氧化物的化学式一氧化碳CO、二氧化碳CO2、二氧化硫SO2、三氧化硫SO3水H2O、双氧水H2O2、五氧化二磷P2O5、一氧化氮NO、二氧化氮NO2氧化钠Na2O、氧化钾K2O、氧化银Ag2O氧化汞HgO、氧化铜CuO、氧化镁MgO、氧化钙CaO、氧化锌ZnO、氧化亚铁FeO氧化铁Fe2O3、氧化铝Al2O3二氧化钛TiO2、二氧化锰MnO2四氧化三铁Fe3O4三、酸的化学式盐酸HCl、硝酸HNO3氢硫酸H2S、亚硫酸H2SO3、硫酸H2SO4、碳酸H2CO3、磷酸H3PO4乙酸(醋酸)CH3COOH四、碱的化学式氢氧化钾KOH、氢氧化钠NaOH、氨水NH3·H2O氢氧化钙Ca(OH)2、氢氧化钡Ba(OH)2、氢氧化铜Cu(OH)2↓、氢氧化镁Mg(OH)2↓、氢氧化亚铁Fe(OH)2↓氢氧化铁Fe(OH)3↓、氢氧化铝Al(OH)3↓五、盐的化学式氯化银AgCl↓、氯化钾KCl、氯化钠NaCl氯化铜CuCl2、氯化镁MgCl2、氯化钙CaCl2、氯化锌ZnCl2、氯化钡BaCl2、氯化亚铁FeCl2氯化铁FeCl3、氯化铝AlCl3、氯化钴CoCl3硫酸钠Na2SO4、硫酸钾K2SO4硫酸钡BaSO4↓、硫酸铜CuSO4、硫酸锌ZnSO4、硫酸钙CaSO4、硫酸镁MgSO4、硫酸亚铁FeSO4硫酸铁Fe2(SO4)3、硫酸铝Al2(SO4)3碳酸钠Na2CO3、碳酸钾K2CO3、碳酸铵(NH4)2CO3碳酸钙CaCO3↓、碳酸镁MgCO3、碳酸钡BaCO3↓、碳酸铜CuCO3↓、碳酸锌ZnCO3↓、碳酸亚铁FeCO3碳酸铁Fe2(CO3)3、碳酸铝Al2(CO3)3硝酸钠NaNO3、硝酸银AgNO3、硝酸钾KNO3、硝酸铜Cu(NO3)2、硝酸镁Mg(NO3)2、硝酸钙Ca(NO3)2、硝酸锌Zn(NO3)2、硝酸钡Ba(NO3)2硝酸铁Fe(NO3)3、硝酸铝Al(NO3)3氯化铵NH4Cl、硝酸铵NH4NO3、碳酸铵(NH4)2CO3、硫酸铵(NH4)2SO4硫化钠Na2S、硫化亚铜Cu2S、碘化钾KI、溴化锌ZnBr、氯酸钾KClO3、高锰酸钾KMnO4、锰酸钾K2MnO4、甲烷(天然气)CH4、乙醇(酒精)C2H5OH铜锈Cu2(OH)2CO3、铁锈Fe2O3.nH2O氧气O2氢气H2氮气N2氯气Cl2氧化镁MgO二氧化碳CO2氯化氢HCl氢氧化钠NaOH碳酸钙CaCO3硫酸铜CuSO4硝酸银AgNO3氯化钠NaCl三氧化铝AlCl3碳酸氢钠NaHCO3碳酸氢铵NH4HCO3高锰酸钾KMnO4二氧化锰MnO2甲烷CH4乙醇C2H水H2O一、硫酸盐类:1.皓矾:ZnSO4.7H2O2.钡餐,重晶石:BaSO43.绿矾,皂矾,青矾:FeSO4.7H2O4.芒硝,朴硝,皮硝:Na2SO4.10H2O5.明矾:KAl(SO4)2.12H2O6.生石膏:CaSO4.2H2O熟石膏:2CaSO4.H2O7.胆矾、蓝矾:CuSO4.5H2O8.莫尔盐:(NH4)2SO4.FeSO4.6H2O二、矿石类:1.莹石:CaF22.光卤石:KCl.MgCl2.6H2O3.黄铜矿:CuFeS24.矾土:Al2O3.H2O、Al2O3.3H2O和少量Fe2O3、SiO25.磁铁矿石:Fe3O46.赤铁矿石:Fe2O37.褐铁矿石:2Fe2O3.3H2O8.菱铁矿石:Fe2CO39.镁铁矿石:Mg2SiO410.苏口铁:碳以片状石墨形式存在11.白口铁:碳以FeC3形式存在12.高岭石:Al2(Si2O5)(OH)4或(Al2O3.2SiO2.2H2O)13.正长石:KAlSi3O814.石英:SiO215.硼砂:Na2B4O7.10H2O16.脉石:SiO217.刚玉(蓝宝石.红宝石):天然产的无色氧化铝晶体18.黄铁矿(愚人金):FeS219.炉甘石:ZnCO320.智利硝石:NaNO321.滑石:3MgO.4SiO2.H2O22.大理石(方解石、石灰石):CaCO323.孔雀石:CuCO3.Cu(OH)224.白云石:MgCO3.CaCO325.冰晶石:Na3AlF626.高岭土:Al2O3.2SiO2.2H2O27.锡石:SnO228.辉铜矿:Cu2S三、气体类:1.高炉煤气:CO,CO2等混合气体2.水煤气:CO,H23.天然气(沼气):CH44.液化石油气:C3H8,C4H10为主5.焦炉气:CH4,CO,H2,C2H4为主6.裂解气:C2H4为主7.爆鸣气:H2和O28.笑气:N2O9.裂化气:C1~C4的烷烃、烯烃10.电石气:C2H2(通常含H2S、PH3等)四、有机类:1.福尔马林(蚁醛):HCHO2.蚁酸:HCOOH3.尿素:(NH4CNO)或CO(NH2)24.氯仿:CCl45.木精(工业酒精):CH3OH6.甘油:CH2OH-CHOH-CH2OH7.硬脂酸:C17H35COOH8.软脂酸:C15H31COOH9.油酸:C17H33OH10.肥皂:C17H35COONa11.银氨溶液:[Ag(NH3)2]+12.乳酸:CH3-CHOH-COOH13.葡萄糖:C6H12O614.蔗糖:C12H22O1115.核糖:CH2OH-(CHOH)3CHO16.脱氧核糖:CH2OH-(CHOH)2CH2-CH317.淀粉:(C6H10O5)n18.火棉,胶棉:主要成份都是[(C6H7O2)-(ONO2)3]n只是前者含N量高19.尿素:CO(NH2)2NH4CNO为氰酸铵(互为同分异构体)20.氯仿:CHCl321.油酸:C17H33COOH22.银氨溶液:[Ag(NH3)2]OH23.脱氧核糖:CH2OH-(CHOH)2CH2-CHO五、其他类:1.白垩:CaCO32.石灰乳、熟石灰:Ca(OH)23.熟石膏:2CaSO4.H2O4.足球烯:C605.铜绿:Cu2(OH)2CO36.纯碱(碱面):Na2CO37.王水:HCl,HNO3(3:1)8.水玻璃(泡火碱):Na2SiO39.小苏打:NaHCO310.苏打:Na2CO311.大苏打(海波):Na2S2O312.盐卤:MgCl2.6H2O13.雌黄:As2S314.雄黄:As4S415.朱砂:HgS16.石棉:CaO.3MgO.4SiO217.砒霜:As2O318.泻盐:MgSO4.7H2O19.波尔多液:CuSO4+Ca(OH)220.钛白粉:TiO2。
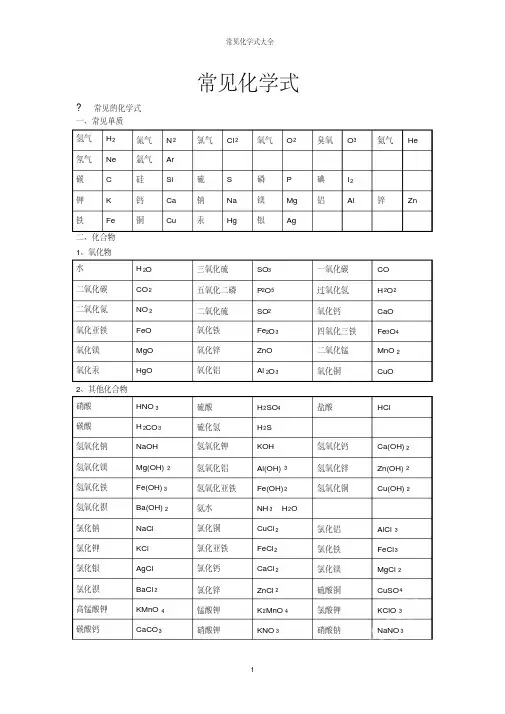
常见化学式?常见的化学式一、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He 氖气Ne氩气Ar碳C硅Si硫S磷P碘I2钾K钙Ca钠Na镁Mg铝Al锌Zn 铁Fe铜Cu汞Hg银Ag二、化合物1、氧化物水H2O三氧化硫SO3一氧化碳CO二氧化碳CO2五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化锰MnO2氧化汞HgO氧化铝Al2O3氧化铜CuO2、其他化合物硝酸HNO3硫酸H2SO4盐酸HCl碳酸H2CO3硫化氢H2S氢氧化钠NaOH氢氧化钾KOH氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化锌Zn(OH)2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2氢氧化钡Ba(OH)2氨水NH3·H2O氯化钠NaCl氯化铜CuCl2氯化铝AlCl3氯化钾KCl氯化亚铁FeCl2氯化铁FeCl3氯化银AgCl氯化钙CaCl2氯化镁MgCl2氯化钡BaCl2氯化锌ZnCl2硫酸铜CuSO4高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸钙CaCO3硝酸钾KNO3 硝酸钠NaNO3硝酸铁Fe(NO3)3硝酸亚铁Fe(NO3)2硝酸铝Al(NO3)3碳酸钠Na2CO3碳酸钙CaCO3碳酸铵(NH4)2CO3碳酸氢钠NaHCO3硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硝酸银AgNO3硝酸钡Ba(NO3)2硝酸铵NH4NO3硫酸钡BaSO43、常见有机化合物甲烷CH4乙醇C2H5OH 葡萄糖C6H12O6初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧: C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl2点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑ 16、加热高锰酸钾:2KMnO4加热 K2MnO4 + MnO2 +O2↑ 17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑ 18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑ 三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑ 22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑ 23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑ 其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== N a2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑ 36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑ 一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑ 14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑ 15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑ 16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑ 17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑ 18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑ 三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑ 22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑ 23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑ 27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑ 28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑ 29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑ 30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑ 31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑ 32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑ 33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑ (2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O (4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ C u(OH)2==== C uCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl 2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑ 64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O2点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O2点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+ C O2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O2点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ C O2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧: C +O2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑ 14.加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2 +O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+O2 ↑ 17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧: C + O2点燃 CO224.木炭还原氧化铜: C + 2CuO 高温 2Cu+ CO2↑ 25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑ (2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑ 31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO2 35.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O 38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O 39.氢气中空气中燃烧:2H2+ O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑ 45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑ 46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑ 47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑ 48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑ 49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑ 50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑ 51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑ (3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3 高温 4Fe +3CO2↑ 七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl 2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O (2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl +H2O+ CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+ H2O +CO2↑ (3)盐碱 -------- 另一种碱另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH(4)盐盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3== AgCl ↓+NaNO 378.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2== BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2CO 2 + 2H 2O△点燃点燃。
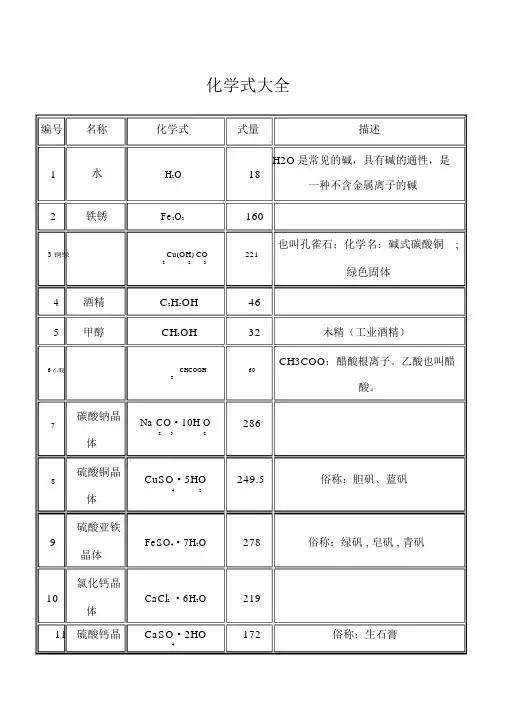
化学式大全编号名称化学式式量描述1H2O18H2O是常见的碱,具有碱的通性,是水一种不含金属离子的碱2铁锈Fe2O3160也叫孔雀石;化学名:碱式碳酸铜; 3铜绿Cu(OH) CO221223绿色固体4酒精C2H5OH465甲醇CH3OH32木精(工业酒精)-CH3COO:醋酸根离子。
乙酸也叫醋6乙酸CHCOOH603酸。
碳酸钠晶Na CO·10H O2867232体硫酸铜晶CuSO·5HO249.5俗称:胆矾、蓝矾842体硫酸亚铁9FeSO4·7H2O278俗称:绿矾 , 皂矾 , 青矾晶体氯化钙晶10CaCl2·6H2O219体11 硫酸钙晶CaSO·2HO172俗称:生石膏4体12硫化钠Na2S7813氧气O232无色无味的气体14氢气H2爆鸣气的主要成分: H2和 O2;无色无2味的气体15氮气N228无色无味的气体16氯气Cl 27117氨气NH317NH3是碱性气体 ; 无色,但有刺激性气味18一氧化碳CO28无色无味的气体19二氧化碳CO244无色无味的气体20二氧化硫SO264无色,但有刺激性气味21三氧化硫SO80322二氧化氮NO24623甲烷CH16天然气(沼气)的主要成分424乙炔CH26电石气: C2H2(通常含 H2S、PH3等)2225氧化钙CaO56白色固体26氧化镁MgO40白色固体27氧化锌ZnO8128氧化铜CuO79.5黑色固体29氧化汞HgO217红色固体30二氧化锰MnO231三氧化二Al O23铝32三氧化二Fe2O3铁33四氧化三Fe3O4铁34五氧化二P2O5磷35三氧化钨WO3 36过氧化氢H2O2 37盐酸HCl 38硝酸HNO3 39硫酸H2 SO4 40磷酸HPO34 41碳酸HCO23 42氢硫酸H2S 43火碱NaOH 44 氢氧化钾KOH87黑色固体102160俗称:赤铁矿石 ; 红色固体232俗称:磁铁矿石 ; 黑色固体142白色固体483436.5无色,但有刺激性气味 ;63具有刺激性气味的液体纯净的硫酸是没有颜色、粘稠、油状98的液体,不容易挥发。

1.元素符号:H He C N0F Ne Na Mg Al Si P S C1氢氨碳氮氧氟氤钠镁铝硅磷硫氮Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg I氧钾钙#铁铜锌银领铀金汞碘2.常见高子和化合杨中元素的化合价:H+Na+K+Ag+NH4++1价氢离子钠离子钾离子银离子铉根离子Ca2+Mg2+Cu2+Ba2+Zn2+Fe2++2价钙离子镁离子铜离子颔离子锌离子亚铁离子Fe3+A13++3价铁离子铝离子C1-0H-N03--1价氯离子氢氧根离子硝酸根离子02-SO42-CO32--2价氧离子硫酸根离子碳酸根离子3.常见物质的化学式与名称:单质:C:碳S:硫P:磷Fe:铁Mg:镁A1:铝Hg:汞Zn:锌Cu:铜Ag:银。
2:氧气板氧气阮氮气。
3:臭氧氧化物:CO:一氧化碳C02:二氧化碳S02:二氧化硫M”2:二氧化链SO3:三氧化硫倾2:过氧化氢CuO:氧化铜CaO:氧化钙MgO:氧化镁HgO:氧化汞Fe2O3:A化铁A03:氧化铝倾冰P2O5:五氧化二磷Fe3()4:四氧化三铁HC1:盐酸H2SO4:硫酸HNO3:硝酸H2CO3:碳酸H2S亚硫酸CHjCOOH:醋酸NaOH:氢氧化钠Ca(OH)2:氢氧化钙KOH:氢氧化钾NH3.H20氨水Mg(OH)2:氢氧化镁Cu(OH)2:氢氧化铜Fe(OH)3:氢氧化铁Al(OH)3:氢氧化铁盐酸盐:KC1:氯化钾NaCl:氯化钠KC1:氯化钾AgCl:氯化银CuCl2:<化铜CaCh:氮化钙MgCl2:<化镁ZnCl2:<化锌BaCl2<化领FeC12:氮化亚铁A1C13:氮化铝FeC13:氯化铁碳酸盐:CaCO3:碳酸钙Na2CO3:碳酸钠NaHCO3:碳酸氢钠BaCO3:碳酸领K2CO3:碳酸钾NH4HCO3:碳酸氢铉硫酸盐:Na2SO4:硫酸钠ZnSO4:硫酸锌MgSO4:硫酸镁CaS()4:硫酸钙C11SO4:硫酸铜BaSO4:<酸领FeSO4:硫酸亚铁Fe2(SO4)3:硫酸铁A12(SO4) 3:硫酸铝(NH4)2SO4:硫酸铉Na2SO3:亚疏酸钠硝酸盐:AgN()3:硝酸银NaN03:硝酸钠Cu(NO3)2:硝酸铜KNO3:硝酸钾NH4NO3:硝酸饺NaN02:亚硝酸钠钾盐:KMnOr高铉酸钾K2MnO4:#酸钾KCIO3:氮酸钾有机化合物:C2H5OH:乙醇。

一、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He氖气Ne 氩气Ar 碳 C 硅Si 硫S 磷P 碘钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 铜Cu 汞Hg 银Ag二、化合物1、氧化物水H2O 三氧化硫SO3一氧化碳CO二氧化碳CO 五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO 氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO 氧化锌ZnO 二氧化锰MnO3氧化汞HgO 氧化铝Al2O3氧化铜CuO2、其他化合物硝酸HNO3硫酸H2SO4盐酸HCl3、区分酸碱盐方法:酸氢离子+酸根离子的化合物碱金属离子+氢氧根离子的化合物(氨水除外盐金属离子+酸根离子的化合物4、基本反映类型(1单质与氧气的反应:1.镁在空气中燃烧:2Mg + O2点燃2MgO2.铁在氧气中燃烧:3Fe + 2O2 Fe3O43.铜在空气中受热:2Cu + O2 2CuO4.铝在空气中燃烧:4Al + 3O2 2Al2O35.氢气中空气中燃烧:2H2 + O2 2H2O6.红磷在空气中燃烧:4P + 5O2 2P2O57.硫粉在空气中燃烧:S + O2 SO28.碳在氧气中充分燃烧:C + O2 CO29.碳在氧气中不充分燃烧:2C + O2 2CO(2化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2 2CO211.甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2 2H2↑+ O2 ↑14.利用过氧化氢和二氧化锰的混合物制氧气 2H2O2 = 2H2O + O2 ↑15.加热高锰酸钾:2KMnO4K2MnO4 + MnO2 + O2↑16.碳酸不稳定而分解:H2CO3 = H2O + CO2↑17.高温煅烧石灰石:CaCO3高温CaO + CO2↑18.加热碳酸氢铵:NH4HNO加热H2O + CO2↑+NH3↑三.几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO Cu + H2O20.木炭还原氧化铜:C + 2CuO 2Cu + CO2↑21.焦炭还原氧化铁:3C + 2Fe2O34Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O43Fe + 2CO2↑23.一氧化碳还原氧化铜:CO + CuO Cu + CO224.一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO + Fe3O4高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1金属单质 + 酸 -------- 盐 + 氢气(置换反应26.锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑27.铁和稀硫酸反应:Fe + H2SO4 === FeSO4 + H2↑28.镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑29.铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO43 + 3H2↑30.锌和稀盐酸反应:Zn + 2HCl=== ZnCl2 + H2↑31.铁和稀盐酸反应:Fe + 2HCl=== FeCl2 + H2↑32.镁和稀盐酸反应:Mg + 2HCl=== MgCl2 + H2↑33.铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑(2金属单质 + 盐(溶液 ---另一种金属 + 另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液反应:Cu + Hg(NO32 === Cu(NO32 + Hg (3碱性氧化物 +酸 -------- 盐 + 水37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO43 + 3H2O39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O46.消石灰放在空气中变质:Ca(OH2 + CO2 == CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH2 + SO2 == CaSO3↓+ H2O(5酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH2 == CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH2 = CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH3 = FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH3 = AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH = K2SO4 + 2H2O56.硫酸和氢氧化铜:H2SO4 + Cu(OH2 = CuSO4+ 2H2O57. 硫酸和氢氧化铁:3H2SO4 + 2Fe(OH3= Fe2(SO43 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O59.氨水和硫酸反应:2NH3·H2O+H2SO4==(NH42SO4+2H2O(6酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑60.(灭火器原理: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸: MgCO3 + 2HCl = MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠:Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液:H2SO4 + BaCl2 = BaSO4↓+ 2HCl(7碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 = Cu(OH2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 = Fe(OH3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 = Mg(OH2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 = Cu(OH2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH2 + Na2CO3 = CaCO3↓+ 2NaOH附加:含氨根盐与碱反应放出氨气:NH4Cl + NaOH = NaCl + NH3↑(8盐 + 盐 ----- 两种新盐70.氯化钠和硝酸银:NaCl + AgNO3 = AgCl↓ + NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476. 硫酸铜晶体受热分解:CuSO4·5H2O CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O78.光合作用:6CO2 + 6H2O C6H12O6+6O2。

初三化学式大全
电解质:
1、NaCl 氯化钠:钠离子和氯离子的化学式,NaCl 氯化钠也常称为卤素。
2、KBr 碘化钾:钾离子和溴离子的化学式,KBr 碘化钾也称为碘盐。
3、CaCO3 碳酸钙:钙离子和碳酸根离子的化学式,CaCO3 碳酸钙大量存在于地球表面,它也是最重要的矿物质。
酸:
1、HCl hydrochloric acid:氢离子和氯离子的化学式,也被称为盐酸,在许多反应中常被用作一种强酸。
2、H2SO4 硫酸:氢离子、硫离子和氧离子的化学式,硫酸常用作工业反应的一种中间体。
3、HCOOH 甲酸:氢离子、碳离子和氧离子的化学式,它也被称为甲酸,是一种碳分子的酸性物质。
碱:
1、NaOH 氢氧化钠:钠离子和氢氧根离子的化学式,也被称为烧碱,是用于去除有机污染物和水族箱中病菌的常用消毒剂。
3、Ca(OH)2 碳酸钠:钙离子和氢氧根离子的化学式,Ca(OH)2 碳酸钠常被用来作为建筑物的化学防护剂,以防止空气中的有害物质侵蚀建筑物。
气体:
1、CO2 二氧化碳:一分子中含有一个碳原子和两个氧原子的化学式,二氧化碳是地球大气化学行为过程中起中和剂作用的重要气体。
2、NH3 氨气:一个氨分子由三个氢原子和一个氮原子组成的化学式,其中二氧化氮称为氨气,在农业、环境改善和水手等生活中也有重要作用。
3、H2 氢气:由一个氢分子组成的化学式,氢气是人类最重要的能源之一,也是推进火箭的主要原料。

初中常见化学式大全
初中常见化学式有一氧化碳CO、盐酸HCl、氯化钠NaCl、硫酸铝A12(S04)3、二氧化碳C02、硝酸HN03、氯化钾KCl、硫酸亚铁FeSO4等。
初中常见化学式
一氧化碳CO、盐酸HCl、氯化钠NaCl、硫酸铝A12(S04)3、二氧化碳C02、硝酸HN03、氯化钾KCl、硫酸亚铁FeSO4、二氧化硫S02、硫酸H2S04、氯化锌ZnCl2、硫酸铁Fe2(S04)3、三氧化硫 S03、碳酸H2CO3、氯化镁MgCl2、硫酸铜CuS04、水H20、氯化钙CaCl2、硝酸钾KN03、过氧化氢H202、氢氧化钠NaOH、氯化铁FeCl3、硝酸铜Cu(N03)2、五氧化二磷P205、氢氧化钾KOH、氯化亚铁FeCl2、硝酸铝Al(N03)3、氧化镁MgO、氢氧化镁Mg(OH)2、氯化铜CuCl2、硝酸铁Fe(N03)3、氧化铝A1203、氢氧化钙Ca(OH)2、氯化铝AlCl3、硝酸银AgN03、氧化铜CuO、氢氧化钡Ba(OH)2、氯化钡BaCl2、硝酸铵NH4NO3、二氧化锰Mn02、氢氧化亚铁Fe(OH)2、硫化钠 Na2S、硫酸铵(NH4)2S04、氧化钠Na20、氢氧化铁Fe(OH)3。
常见化学方程式
1.镁在空气中燃烧:2Mg+O2 点燃 2MgO
2.铁在氧气中燃烧:3Fe+2O2 点燃 Fe3O4
3.铜在空气中受热:2Cu+O2 加热 2CuO
4.铝在空气中燃烧:4Al+3O2 点燃 2Al2O3
5.氢气中空气中燃烧:2H2+O2 点燃 2H2O
6.红磷在空气中燃烧:4P+5O2 点燃 2P2O5
7.硫粉在空气中燃烧: S+O2 点燃 SO2
8.碳在氧气中充分燃烧:C+O2 点燃 CO2
9.碳在氧气中不充分燃烧: 2C+O2 点燃 2CO。
物质化学式大全表格
以下是一些常见的物质分类和它们的化学式:
1.酸:盐酸(HCl)、硫酸(H2SO4)、碳酸(H2CO3)、硝酸(HNO3)、亚硫酸(H2SO3)等。
2.碱:氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)、氢氧化铜(Cu(OH)2)等。
3.盐:氯化钠(NaCl)、氯化钾(KCl)、氯化银(AgCl)等。
4.氧化物:水(H2O)、一氧化碳(CO)、二氧化碳(CO2)、五氧化二磷(P2O5)等。
5.金属单质:钠(Na)、镁(Mg)、铝(Al)、钾(K)、钙(Ca)等。
6.非金属单质:氢气(H2)、碳(C)、氮气(N2)、氧气(O2)、磷(P)、硫(S)等。
这只是一部分常见的物质分类和它们的化学式,实际上还有许多其他类型的化合物和物质。
如果您有特定的物质或化学式需要了解,可以随时向我提问。
1。
初中化学化学式大全一、单质1. 金属单质-钾K、钙Ca、钠Na、镁Mg、铝Al、锌Zn、铁Fe、锡Sn、铅Pb、铜Cu、汞Hg、银Ag、铂Pt、金Au。
2. 非金属单质-氢气H₂、氧气O₂、氮气N₂、氯气Cl₂、氟气F₂、溴Br₂、碘I₂、碳C、硅Si、磷P、硫S。
二、氧化物1. 金属氧化物-氧化钠Na₂O、氧化镁MgO、氧化铝Al₂O₂、氧化钙CaO、氧化铜CuO、氧化铁Fe₂O₂(三氧化二铁,红棕色)、四氧化三铁Fe₂O₂(黑色)、氧化亚铁FeO、氧化锌ZnO。
2. 非金属氧化物-水H₂O、二氧化碳CO₂、一氧化碳CO、二氧化硫SO₂、三氧化硫SO₂、五氧化二磷P₂O₂、二氧化硅SiO₂。
三、酸1. 无氧酸-盐酸HCl(氢氯酸)、氢氟酸HF、氢溴酸HBr、氢碘酸HI。
2. 含氧酸-硫酸H₂SO₂、硝酸HNO₂、碳酸H₂CO₂、磷酸H₂PO₂。
四、碱1. 可溶性碱-氢氧化钠NaOH(火碱、烧碱、苛性钠)、氢氧化钾KOH、氢氧化钡Ba(OH)₂、氢氧化钙Ca(OH)₂(熟石灰、消石灰)。
2. 难溶性碱-氢氧化铜Cu(OH)₂(蓝色沉淀)、氢氧化铁Fe(OH)₂(红褐色沉淀)、氢氧化镁Mg(OH)₂、氢氧化铝Al(OH)₂。
五、盐1. 硫酸盐-硫酸钠Na₂SO₂、硫酸钾K₂SO₂、硫酸钡BaSO₂(不溶于水和酸的白色沉淀)、硫酸钙CaSO₂、硫酸镁MgSO₂、硫酸锌ZnSO₂、硫酸铜CuSO₂、硫酸亚铁FeSO₂、硫酸铁Fe₂(SO₂)₂。
2. 碳酸盐-碳酸钠Na₂CO₂(纯碱、苏打)、碳酸钾K₂CO₂、碳酸钙CaCO₂(大理石、石灰石的主要成分,白色沉淀)、碳酸钡BaCO₂(白色沉淀)。
3. 盐酸盐(氯化物)-氯化钠NaCl(食盐的主要成分)、氯化钾KCl、氯化钡BaCl₂、氯化钙CaCl₂、氯化镁MgCl₂、氯化锌ZnCl₂、氯化铜CuCl₂、氯化亚铁FeCl₂、氯化铁FeCl₂。
4. 硝酸盐-硝酸钠NaNO₂、硝酸钾KNO₂、硝酸钡Ba(NO₂)₂、硝酸钙Ca(NO₂)₂、硝酸镁Mg(NO₂)₂、硝酸锌Zn(NO₂)₂、硝酸铜Cu(NO₂)₂、硝酸银AgNO₂。
编号名称化学式式量描述1 水H2O 18 H2O是常见的碱,具有碱的通性,是一种不含金属离子的碱2 铁锈Fe2O31603 铜绿Cu2(OH)2CO3221 也叫孔雀石;化学名:碱式碳酸铜;绿色固体4 酒精C2H5OH 465 甲醇CH3OH 32 木精(工业酒精)6 乙酸CH3COOH 60 CH3COO-:醋酸根离子。
乙酸也叫醋酸。
7 碳酸钠晶体Na2CO3·10H2O 2868 硫酸铜晶体CuSO4·5H2O 俗称:胆矾、蓝矾9 硫酸亚铁晶体FeSO4·7H2O 278 俗称:绿矾,皂矾,青矾10 氯化钙晶体CaCl2·6H2O 21911 硫酸钙晶体CaSO4·2H2O 172 俗称:生石膏12 硫化钠Na2S 7813 氧气O232 无色无味的气体14 氢气H2 2 爆鸣气的主要成分:H2和O2;无色无味的气体15 氮气N228 无色无味的气体16 氯气Cl27117 氨气NH317 NH3是碱性气体;无色,但有刺激性气味18 一氧化碳CO 28 无色无味的气体19 二氧化碳CO244 无色无味的气体20 二氧化硫SO264 无色,但有刺激性气味21 三氧化硫SO38022 二氧化氮NO24623 甲烷CH416 天然气(沼气)的主要成分24 乙炔C2H226 电石气:C2H2(通常含H2S、PH3等)25 氧化钙CaO 56 白色固体26 氧化镁MgO 40 白色固体27 氧化锌ZnO 8128 氧化铜CuO 黑色固体29 氧化汞HgO 217 红色固体30 二氧化锰MnO287 黑色固体31 三氧化二铝Al2O310232 三氧化二铁Fe2O3160 俗称:赤铁矿石;红色固体33 四氧化三铁Fe3O4232 俗称:磁铁矿石;黑色固体34 五氧化二磷P2O5142 白色固体35 三氧化钨WO34836 过氧化氢H2O23437 盐酸HCl 无色,但有刺激性气味;38 硝酸HNO363 具有刺激性气味的液体39 硫酸H2SO498 纯净的硫酸是没有颜色、粘稠、油状的液体,不容易挥发。
常见的化学式100个1. 水 H₂O2. 氯 Cl₂3. 氢氧化钾 KOH4. 醋酸 CH₃COOH5. 氢氧化钠 NaOH6. 氯酸 HCl7. 碳酸钙 CaCO₃8. 硫酸 H₂SO₄9. 碳酸氢钠 NaHCO₃10. 焦磷酸 Na₃PO₄11. 盐酸 HClO₂12. 次氯酸 NaClO13. 稀硫酸 H₂SO₃14. 氧化铁(Ⅲ) Fe₂O₃15. 氧化铝 Al₂O₃16. 铁粉 Fe₃O₄17. 氯化锌 ZnCl₂18. 碳酸氢钙 Ca(HCO₃)₂19. 氯化钾 KCl20. 氢氧化钙 Ca(OH)₂21. 高锰酸钾 K₂MnO₄22. 亚硝酸 NaNO₂23. 氢氧化镁 Mg(OH)₂24. 氧化钠 Na₂O25. 氯酸钠 NaClO₃26. 氧化亚铁 FeO27. 氯化钙 CaCl₂28. 硝酸钾 KNO₃29. 氯化钛 TiCl₄30. 硅酸钙 CaSiO₃31. 硫酸铁 FeSO₄32. 硫酸钠 Na₂SO₄33. 硝酸氢钠 NaNO₂34. 硫酸钙 CaSO₄35. 氯酸钙 CaCl₂36. 氢氧化铝 Al(OH)₃37. 氢氧化镁 Mg(OH)₂38. 碳酸氢铵 NH₄HCO₃39. 氯化钛 TiCl₃40. 氧化钙 CaO41. 氧化钡 BaO42. 氧化锑 Sb₂O₃43. 氯化钒 VCl₃44. 硝酸钾 KNO₃45. 氯化钒 VCl₂46. 氧化钒 V₂O₅47. 氧化汞 HgO48. 氯氧化钠 NaClO49. 硫钾酸 KHSO₄50. 硫酸钙 CaSO₃51. 硫酸钾 K₂SO₄52. 硅酸钠 Na₂SiO₃53. 氢氧化硅 Si(OH)₄54. 硝酸钠 NaNO₃55. 亚铁氰化物 Fe(CN)₆56. 氯化汞 HgCl₂57. 氯硫酸 Na₂S₂O₃58. 氯硝酸 NaClO₂59. 氯汞酸 HgCl₃60. 磷酸铵 NH₄H₂PO₄61. 磷酸钙 Ca(H₂PO₄)₂62. 氯化钴 CoCl₂63. 苯二酚 C₆H₄OH64. 氯气 Cl₂65. 苯三醇 C₆H₈O66. 亚磷酸钠 NaH₂PO₄67. 氟酸 HF68. 氯氢化钠 NaHCl69. 氢氧化镁 Mg(OH)₂70. 硫酸锌 ZnSO₄71. 乙酸 C₂H₄O₂72. 氯片 Cl₂O73. 氧化锰 MnO₂74. 氯酸铜 CuCl₂75. 氢氧化钠 NaOH76. 乙烯 C₂H₄77. 氯乙酸 ClCH₂COOH78. 硅硫酸 Na₂Si₂O₅79. 溴 B₂80. 氯钠 NaCl81. 烯醇 C₂H₅OH82. 硫酸 CuSO₄83. 氯乙烯 ClC₂H₄84. PCL₃ PCl₃85. 氧化钙 Ca⁺₂O86. 氯化钆 GaCl₃87. 丙醇 C₃H₈O88. 二甲醚 CH₃OCH₃89. 水合硅胺 Si(NH₂)₄90. 氯化物 Cl⁻91. 铁磁性氧化物 Fe₃O₄92. 硫化钠 Na₂S93. 盐酸钙 CaCl₂O₄94. 氧化铜 CuO95. 氧化锆 ZrO₂96. 硝酸氢铜 Cu(NO₃)₂97. 硝酸铱 IrNO₃98. 氯化钙 CaCl₃99. 碳酸钙 CaCO₂100. 氯化乙醇 C₂H₅OCl。
常见化学式常见的化学式一、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He 氖气Ne氩气Ar碳C硅Si硫S磷P碘I2钾K钙Ca钠Na镁Mg铝Al锌Zn 铁Fe铜Cu汞Hg银Ag二、化合物1、氧化物水H2O三氧化硫SO3一氧化碳CO二氧化碳CO2五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化锰MnO2氧化汞HgO氧化铝Al2O3氧化铜CuO2、其他化合物硝酸HNO3硫酸H2SO4盐酸HCl碳酸H2CO3硫化氢H2S氢氧化钠NaOH氢氧化钾KOH氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化锌Zn(OH)2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2氢氧化钡Ba(OH)2氨水NH3·H2O氯化钠NaCl氯化铜CuCl2氯化铝AlCl3氯化钾KCl氯化亚铁FeCl2氯化铁FeCl3氯化银AgCl氯化钙CaCl2氯化镁MgCl2氯化钡BaCl2氯化锌ZnCl2硫酸铜CuSO4高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸钙CaCO3硝酸钾KNO3 硝酸钠NaNO3硝酸铁Fe(NO3)3硝酸亚铁Fe(NO3)2硝酸铝Al(NO3)3碳酸钠Na2CO3碳酸钙CaCO3碳酸铵(NH4)2CO3碳酸氢钠NaHCO3硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硝酸银AgNO3硝酸钡Ba(NO3)2硝酸铵NH4NO3硫酸钡BaSO43、常见有机化合物甲烷CH4乙醇C2H5OH葡萄糖C6H12O6初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl2点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O 46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3 === AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl (7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO4 66.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O2点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O2点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe +3O2高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4ΔK2MnO4MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2 +Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O2点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2ΔCaCO3↓+H2O +CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C +O2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑14.加热高锰酸钾:2KMnO4加热K2MnO4+ MnO2+O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+O2 ↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O39.氢气中空气中燃烧:2H2+ O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液)------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3 高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O(2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl +H2O+ CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+ H2O +CO2↑(3)盐碱 -------- 另一种碱另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH (4)盐盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO3 == AgCl↓+NaNO3 78.硫酸钠和氯化钡:Na2SO4 +BaCl2 == BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO2 + Ca(OH)2 == CaCO3↓+ H2O2、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3 + H2O3、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH==Na2SO3+ H2O△4、一氧化碳还原氧化铜:CO + CuO Cu + CO25、酒精燃烧:C2H5OH + 3O22CO2 + 3H2O6、甲烷燃烧:CH4 + 2O2CO2 + 2H2O。
初中化学必背化学式大全一.元素符号:氢H 、氦He、锂Li、铍Be、硼B、碳C、氮N、氧O、氟F、氖Ne、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氯Cl、氩Ar、钾K、钙Ca、锰Mn、铁Fe、铜Cu、锌Zn 、银Ag 、钡Ba、铂Pt 、金Au、汞Hg、碘I二.常见离子和化合物中元素的化合价:+1价:氢离子H+、钠离子 Na+、钾离子K+、银离子Ag+、铵根离子NH4++2价:钙离子Ca2+、镁离子Mg2+、铜离子Cu2+、钡离子Ba2+、锌离子Zn2+、亚铁离子Fe2++3价:铁离子Fe3+、铝离子Al3+-1价:氯离子Cl-、氢氧根离子OH- 、硝酸根离子NO3--2价:氧离子O2-、硫酸根离子 SO42-、碳酸根离子 CO32-三.常见物质的化学式与名称:(一)单质:上表中我们主要记住氢气、氧气、碳、铁、铜这几个就可以了,其他一般情况下会在试卷中直接告诉大家。
(二)化合物1.氧化物化学式(1)非金属氧化物:水H2O、二氧化碳CO2、一氧化碳CO、五氧化二磷P2O5、二氧化硫SO2、三氧化硫SO3、过氧化氢(双氧水)H2O2、二氧化氮NO2。
(2)金属氧化物:氧化铁Fe2O3(赤铁矿,铁锈的主要成分)、四氧化三铁 Fe3O4(磁铁矿的主要成分)、氧化铝 Al2O3(铝土矿的主要成分)、氧化铜CuO、氧化钙CaO、二氧化锰MnO2、氧化镁MgO、氧化汞HgO一般氧化物化学式的考察中会涉及到水、二氧化碳、一氧化碳、氧化铜、二氧化锰、二氧化硫等,这也是我们初中出现次数比较多的化学式,希望大家着重记忆。
2.酸的化学式酸:盐酸HCl(胃酸的主要成分)、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、乙酸CH3COOH(俗称醋酸)、H2S亚硫酸。
在酸中,盐酸、硫酸、硝酸是三种强酸,但我们一般考察最多的是盐酸和硫酸的化学式,因此一般情况下大家只要记住这两个即可。
3.碱的化学式碱:氢氧化钠NaOH(俗称火碱、烧碱、苛性钠,易溶于水)、氢氧化钡Ba(OH)2(易溶于水)、氢氧化钙 Ca(OH)2(俗称熟石灰、消石灰。
初中化学公式大全
一、【物质与氧气的反应】:
⑴单质与氧气的反应:
1、镁在空气中燃烧:2Mg + O₂点燃2MgO
2、铁在氧气中燃烧:3Fe + O₂点燃Fe₃O₄
3 、铜在空气中受热:2Cu + O₂加热2CuO
4 、铝在空气中燃烧:4Al + 3O₂点燃2A l₂O₃
5、氢气中空气中燃硗:2H₂ + O₂点燃2H₂O
6 、红磷在空气中燃烧:4P +SO₂点燃2P₂O₅
7 、硫粉在空气中燃烧:S + O₂点燃SO₂
8.、碳在氧气中充分燃烧:C + O₂点燃CO₂
9 、碳在氧气中不充分燃烧:2C + O₂点燃2CO
⑵化合物与氧气的反应:
10、一氧化碳在氧气中燃烧:2CO+ O₂点燃2CO₂
11、甲烷在空气中燃烧:CH₄+2O₂点燃CO₂+2H₂O
12、酒精在空气中燃烧:C₂H₅OH + 3O₂点燃2CO ₂+ ЗН₂О
二、【几个分解反应】:
13、水在直流电的作用下分解:2H₂O通电2Н₂↑+ O₂↑
14、加热碱式碳酸铜:Cu₂(OH)₂СО₃加热2CuO+ Н₂O+ СО₂↑
15、加热氯酸钾(有少量的二氧化锰):2KCIO₃ ===2KCl+3O₂↑
16、加热高锰酸钾:2KMnO₄加热K₂MnO₄+MnO₂+O₂↑
17、碳酸不稳定而分解:H₂CO₃ ===H₂O+CO₂↑
18、高温煅烧石灰石:CaCO₃高温CaO+CO₂↑
三、【几个氧化还原反应】:
19、氢气还原氧化铜:H₂+CuO加热Cu+H₂O
20、木炭还原氧化铜:C+2CuO高温2Cu+ CO₂↑
21、焦炭还原氧化铁:3C+ Fe₂O₃高温4Fe+3CO₂↑
22、焦炭还原四氧化三铁:2C+ Fe₃O₄高温3Fe+2CO₂↑
23、一氧化碳还原氧化铜:CO+CuO加热Cu+ CO₂
24、一氧化碳还原氧化铁:3CO+ Fe₂O₃高温2Fe+3CO₂
25、一氧化碳还原四氧化三铁:4CO+ Fe₃O₄高温3Fe+4CO₂
四、【单质、氧化物、酸、碱、盐的相互关系】
⑴金属单质+酸------------盐+氢气(置换反应)
26、锌和稀硫酸:Zn+H₂SO₄==ZnSO₄+H₂↑
27、铁和稀硫酸:Fe+ H₂SO₄== FeSO₄+ H₂↑
28、镁和稀硫酸:Mg+ H₂SO₄== MgSO₄+ H₂↑
29、铝和稀硫酸:2Al+3H₂SO₄== Al₂(SO₄)₃+3 H₂↑
30、锌和稀盐酸:Zn+2HCl== ZnCl₂+ H₂↑
31、铁和稀盐酸:Fe+2HCl== FeCl₂+ H₂↑
32、镁和稀盐酸:Mg+2HCl==MgCl₂+ H₂↑
33、铝和稀盐酸:2Al+6HCl==2AlCl₃+ 3H₂↑
⑵金属单质+盐(溶液)----------另一种金属+另一种盐
34、铁和硫酸铜溶液反应:Fe+CuSO₄== FeSO₄+Cu
35、锌和硫酸铜溶液反应:Zn+ CuSO₄== ZnSO₄+ Cu
⑶碱性氧化物+酸--------盐+水
37、氧化铁和稀盐酸反应:Fe₂O₃+6HCl==2FeCl₃+ЗН₂О
38、氧化铁和稀硫酸反应:Fe₂O₃+3H₂SO₄== Fe₂(SO₄)₃+ЗН₂О
39、氧化铜和稀盐酸反应:CuO+2HCl==CuCl₂+2Н₂О
40、氧化铜和稀硫酸反应:CuO+ H₂SO₄==CuSO₄+Н₂О
41、氧化镁和稀硫酸反应:MgO+H₂SO₄==MgSO₄+Н₂О
42、氧化钙和稀盐酸反应:CaO+2HCl==CaCl₂+Н₂О
⑷酸性氧化物+碱--------盐+水
43、苛性钠暴露在空气中变质:2NaOH+CO₂==Na₂CO₃+Н₂О
44、苛性钠吸收二氧化硫气体:2NaOH+SO₂==Na₂SO₃+Н₂О
45、苛性钠吸收三氧化硫气体:2NaOH+SO₃==Na₂SO₄+Н₂О
46、消石灰放在空气中变质:Ca(OH)₂+ CO₂== CaCO₃↓+Н₂О
47、消石灰吸收二氧化硫:Ca(OH)+SO₂== Ca SO₃↓+Н₂О
⑸酸+碱------盐+水
48、盐酸和烧碱起反应:HCl+NaOH==NaCl+Н₂О
49、盐酸和氢氧化钾反应:HCl+KOH==KCl+Н₂О
50、盐酸和氢氧化铜反应:2HCl+ Cu(OH)₂== CuCl₂+2Н₂О
51、盐酸和氢氧化钙反应:2HCl+ Ca(OH)₂== CaCl₂+2Н₂О
52、盐酸和氢氧化铁反应:3HCl+ Fe(OH)₃== FeCl₃+3Н₂О
53、氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)₃== AlCl₃+3Н₂О
54、硫酸和烧碱反应:H₂SO₄+2NaOH== Na₂SO₄+2Н₂О
55、硫酸和氢氧化钾反应:H₂SO₄+2 KOH== K₂SO₄+2Н₂О
56、硫酸和氢氧化铜反应:H₂SO₄+ Cu(OH)₂== CuSO₄+2Н₂О
57、硫酸和氢氧化铁反应:3H₂SO₄+2 Fe(OH)₃== Fe₂(SO₄)₃+6Н₂О
58、硝酸和烧碱反应:HNO₂+ NaOH==Na NO₂+Н₂О
⑹酸+盐---------另一种酸+另一种盐
59、大理石与稀盐酸反应:CaСО₃+2HCl==CaCl₂+Н₂О+ CO₂↑
60、碳酸钠与稀盐酸反应:Na₂CO₃+ 2HCl == NaCl+Н₂О+ CO₂↑
61、碳酸镁与稀盐酸反应:Mg CO₃+ 2HCl== MgCl₂+Н₂О+ CO₂↑
62、盐酸和硝酸银溶液反应:HCl+AgNO₃==AgCl↓+HNO₃
63、硫酸和碳酸钠反应:Na₂CO₃+ H₂SO₄== Na₂SO₄+Н₂О+ CO₂↑
64、硫酸和氯化钡溶液反应:H₂SO₄+BaCl₂==BaSO₄↓+ 2HCl
⑺碱+盐--------另一种碱+另一种盐
65、氢氧化钠与硫酸铜:2NaOH+ CuSO₄== Cu(OH)₂↓+ Na₂SO₄
66、氢氧化钠与氯化铁:3NaOH+ FeCl₃== Fe(OH)₃↓+3NaCl
67、氢氧化钠与氯化镁:2NaOH+ MgCl₂==Mg(OH)₂↓+2NaCl
68、氢氧化钠与氯化铜:2NaOH+ CuCl₂== Cu(OH)₂↓+2NaCl
69、氢氧化钙与碳酸钠:Ca(OH)₂+ Na₂CO₃== CaCO₃↓+2NaOH
⑻盐+盐--------两种新盐:
70、氯化钠溶液和硝酸银溶液:NaCl+ AgNO₃== AgCl↓+NaNO₃
71、硫酸钠和氯化钡:Na₂SO₄+ BaCl₂== BaSO₄↓+2NaCl
五、【其他反应】
72、二氧化碳溶于水:CO₂+Н₂О==Н₂CO₃
73、生石灰溶于水:CaO+Н₂О== Ca(OH)₂
74、氧化钠溶于水:Na₂O+Н₂О==2NaOH
75、三氧化硫溶于水:SO₃+Н₂О== H₂SO₄
76、硫酸铜晶体受热分解:CuSO₄·5Н₂О加热CuSO₄+5Н₂О
77、无水硫酸铜做干燥剂:CuSO₄+5Н₂О== CuSO₄·5Н₂O
六、化学方程式反应现象应用
78、CuSO₄+2NaOH== Cu(OH)₂↓+ Na₂SO₄蓝色沉淀生成,上部为澄清溶液,质量守恒定律实验
79、CO₂+Н₂О==Н₂CO₃碳酸使紫色石蕊溶液变红,证明碳酸的酸性;Н₂CO₃△CO₂↑+Н₂О紫色石蕊溶液红色褪去
80、Ca(OH)₂+ CO₂== CaCO₃↓+Н₂О澄清石灰水变浑浊,CO₂检验和石灰浆粉刷墙壁
81、Fe₂O₃+6HCl==2FeCl₃+ЗН₂О铁锈溶解、溶液呈黄色铁器除锈
82、3HCl+Al(OH)₃== AlCl₃+3Н₂О白色固体溶解治疗胃酸过多
83、HCl+AgNO₃==AgCl↓+HNO₃生成白色沉淀、不溶解与稀硝酸检验Cl¯的原理
84、H₂SO₄+BaCl₂==BaSO₄↓+ 2HCl 生成白色沉淀、不溶解于稀硝酸检验SO₄²¯的原理
85、2NaOH+SO₂==Na₂SO₃+Н₂О;2NaOH+SO₃==Na₂SO₄+Н₂О处理硫酸工厂的尾气(SO₂)
86、3NaOH+ FeCl₃== Fe(OH)₃↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成
87、CuSO₄+5Н₂О== CuSO₄·5Н₂O 蓝色晶体变为白色粉末
88、CuSO₄·5Н₂О加热CuSO₄+5Н₂О白色粉末变为蓝色检验物质中是否含有水。