122核外电子排布与元素周期表、原子半径
- 格式:ppt
- 大小:6.26 MB
- 文档页数:65

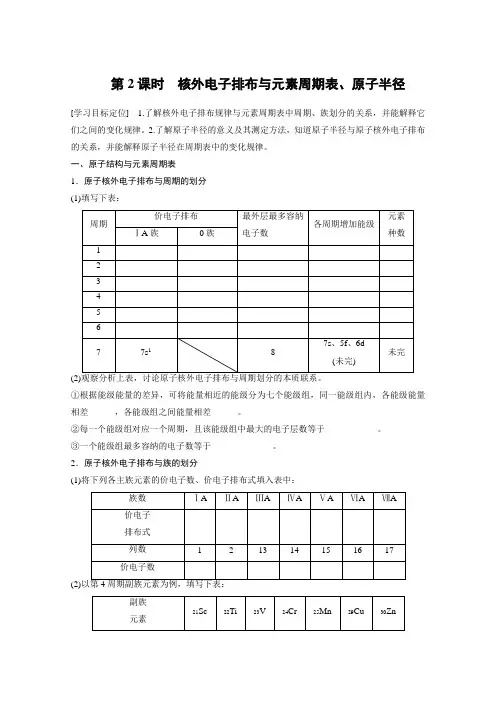
第2课时核外电子排布与元素周期表、原子半径[学习目标定位] 1.了解核外电子排布规律与元素周期表中周期、族划分的关系,并能解释它们之间的变化规律。
2.了解原子半径的意义及其测定方法,知道原子半径与原子核外电子排布的关系,并能解释原子半径在周期表中的变化规律。
一、原子结构与元素周期表1.原子核外电子排布与周期的划分(1)填写下表:①根据能级能量的差异,可将能量相近的能级分为七个能级组,同一能级组内,各能级能量相差______,各能级组之间能量相差______。
②每一个能级组对应一个周期,且该能级组中最大的电子层数等于____________。
③一个能级组最多容纳的电子数等于______________。
2.原子核外电子排布与族的划分(1)将下列各主族元素的价电子数、价电子排布式填入表中:(2)(3)族的划分依据与原子的__________和__________密切相关。
①同主族元素原子的价电子排布______,价电子全部排布在最外层的________________轨道上。
族序数与价电子数______。
②稀有气体的价电子排布为__________________。
③过渡元素(副族和Ⅷ族)同一纵行原子的价电子排布基本相同。
价电子排布式为___________________________,ⅢB~ⅦB族的族序数与价电子数______,第ⅠB、ⅡB族的族序数=______轨道上的电子数,第Ⅷ族的价电子数分别为8、9、10。
3.原子核外电子排布与区的划分1.(1)周期序数=电子层数;(2)周期元素数目=相应能级组最多容纳的电子数。
2.原子核外电子排布与族的关系族序数由该元素原子的价电子数决定。
(1)主族(ⅠA~ⅦA)的族序数=价电子数=原子最外层电子数。
(2)0族:原子最外层电子数等于8或2。
(3)ⅠB、ⅡB族:族序数=原子最外层电子数。
(4)ⅢB~ⅦB族:族序数=价电子数=原子最外层n s电子数+次外层(n-1)d电子数=最高正价。


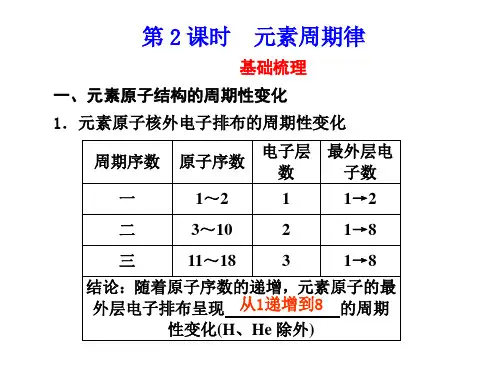

第一章 物质结构 元素周期表一、原子结构质子(Z个)原子核 注意:中子(N个) 质量数(A)=质子数(Z)+中子数(N)1.原子( A X ) 原子序数=核电荷数=质子数=原子的核外电子数Z核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P SCl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同的各元素从左到右排成一横行。
(周期序数=原子的电子层数)③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行。
主族序数=原子最外层电子数2.结构特点:核外电子层数 元素种类第一周期 1 2种元素短周期 第二周期 2 8种元素周期 第三周期 3 8种元素元 (7个横行) 第四周期 4 18种元素素 (7个周期) 第五周期 5 18种元素周 长周期 第六周期 6 32种元素期 第七周期 7 未填满(已有26种元素)表 主族:ⅠA~ⅦA共7个主族族 副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行) 第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族) 零族:稀有气体三、化学键化学键是相邻两个或多个原子间强烈的相互作用。
键,可能有共价键)共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。


元素周期表中的原子半径与电子亲和能的变化规律元素周期表是化学中非常重要的工具,它按照原子序数的递增顺序排列了所有已知元素。
周期表中的每个元素都具有一系列特征,其中包括原子半径和电子亲和能。
本文将探讨元素周期表中原子半径和电子亲和能的变化规律。
一、原子半径的变化规律原子半径指的是元素中心原子核至外层最外电子轨道的距离。
原子半径通常用皮克米(pm)或埃(Å)来表示。
1. 原子半径的变化趋势在元素周期表中,原子半径呈现出明显的变化趋势。
一般来说,随着元素的原子序数增加(从左至右以及从上至下),原子半径呈现出如下规律:a. 原子半径从左至右递减。
这是由于随着电子轨道的填充,外层电子与原子核的吸引力增强,导致原子半径减小。
b. 原子半径从上至下递增。
这是由于相邻周期的电子分布在不同的主能级上,外层电子与原子核的吸引力减弱,因此原子半径增大。
2. 原子半径的影响因素原子半径受多种因素的影响,主要包括电子层的填充和核电荷数:a. 电子层的填充:原子电子层的填充程度会影响原子半径的变化。
当电子填充在同一主能级上时,随着电子数量的增加,原子半径逐渐减小。
但当电子填充在不同主能级上时,原子半径会随着主能级的增加而增大。
b. 核电荷数:原子核的电荷数也会影响原子半径。
电子与原子核之间的吸引力与原子核的电荷数成正比,因此原子核电荷的增加会导致原子半径的减小。
二、电子亲和能的变化规律电子亲和能指的是一个原子获取一个外层电子并形成负离子时释放的能量。
它可以用来衡量原子对电子的亲和力。
电子亲和能通常用千焦耳/摩尔(kJ/mol)来表示。
1. 电子亲和能的变化趋势电子亲和能与原子半径的变化规律相反,即随着原子序数增加,电子亲和能呈现如下规律:a. 电子亲和能从左至右递增。
这是由于从左至右,原子半径减小,电子与原子核之间的吸引力增强,因此原子更容易接受外层电子,电子亲和能增加。
b. 电子亲和能从上至下递减。
这是由于从上至下,原子半径增加,电子与原子核之间的吸引力减弱,因此原子不太容易接受外层电子,电子亲和能降低。



元素周期表原子半径从左到右依次排序
周期表是化学中非常重要的工具,它按元素的周期性性质将元素排列在一起,
方便我们理解元素之间的关系。
元素周期表中的每一个元素都拥有不同的原子半径,而原子半径的大小受到原子核的构成以及电子排布的影响。
在周期表中,原子的半径通常会随着元素的原子序数增加而变化,而原子序数也是从左到右递增的。
在元素周期表中,从左到右依次排序的元素原子半径的变化规律是非常明显的。
一般来说,从左侧的碱金属到右侧的卤族元素,原子半径逐渐减小。
这是因为原子核对外层电子的吸引力会逐渐增大,导致电子云向原子核靠拢,原子半径变小。
碱金属的原子半径通常是周期表中最大的,而卤族元素的原子半径则相对较小。
以第一周期为例,从左到右依次是氢、氦两个元素。
氢原子比氦原子的原子半
径要大,这是因为氢的原子结构是一个电子绕着一个质子核旋转,而氦的原子结构是包含两个质子和两个中子的核,电子云更加向核靠拢,氦的半径较小。
随着原子序数的增加,元素的原子结构也会发生变化,这会影响到元素的原子
半径。
例如,在第二周期中,从左到右依次是锂、铍、硼、碳、氮、氧、氟、氖。
在这个周期中,原子核的电荷数不断增加,电子层数也在增加,这使得原子半径逐渐减小。
总的来说,元素周期表中原子半径从左到右依次排序是有规律可循的,随着元
素序数的增加,原子半径一般会逐渐减小。
这种规律的存在有助于我们更深入地理解元素之间的关系,为化学研究和实践提供理论基础。
Al3+/Al,-1.66V)。
②铍和铝经浓硝酸处理都表现钝化,而其它碱土金属均易与硝酸反应。
③铍和铝都是两性金属,既能溶于酸也能溶于碱。
④氢氧化物均为两性,而其它碱土金属氢氧化物均为碱性。
⑤BeO和Al2O3都有高熔点和高硬度。
⑥铝和铍的氯化物是共价分子,能通过氯桥键形成双聚分子,易升华、易聚合,易溶于有机溶剂。
3、硼和硅的相似性。
B和Si虽是不同族元素,在周期表中处于相邻族的对角位置,由于离子极化作用相近(Si4+电荷高一些,但半径大;B3+电荷低一些,但半径小),性质上有许多相似之处。
①单质晶体都是高熔点原子晶体;与键强度相关。
②在自然界均以含氧化合物存在。
③卤化物都彻底水解,生成含B─O,Si─O键的化合物(硅酸、硼酸)④都有一系列氢化物,氢化物均有挥发性,不稳定。
⑤含氧酸都是弱酸,含氧酸盐都易水解对角线规则是从有关元素及其化合物的许多性质中总结出来的经验规律;对此可以用离子极化的观点加以粗略的说明。
同一周期最外层电子构型相同的金属离子,从左至右随离子电荷的增加而引起极化作用的增强;同一族电荷相同的金属离子,自上而下随离子半径的增大而使得极化作用减弱。
因此,处于周期表中左上右下对角线位置上的邻近两个元素,由于电荷和半径的影响恰好相反,它们的离子极化作用比较相近,从而使它们的化学性质比较相似。
由此反映出物质的结构与性质之间的内在联系。
三. 周期表中的变化规律(一) 同一元素:r -离子>r原子>r+离子>r2+离子(二) 同一周期1. 短周期:每一个短周期从左到右,有效核电荷依次增大,所以原子半径依次递减.2. 长周期:过渡元素自左至右,电子逐一填入(n-1)d层,而它对核的屏蔽作用较小,所以自左向右半径减小的幅度不如主族元素那么大.3. 内过渡元素:电子填入再次外层的(n-2)f层,由于f电子对核的屏蔽作用更小,使得原子半径由左至右收缩的平均幅度更小.比较短周期和长周期,相邻元素原子半径减小的平均幅度大致是非过渡元素>过渡元素>内过渡元素(~10pm)(~5pm)(<1pm)(三) 同一族1. 主族:同一主族由上而下,原子半径一般是增大的.因为同族元素原子由上而下电子层数增多,所以半径由上至下依次增大.2. 副族:副族元素由上至下,原子半径增大的幅度较小,特别是五,六周期的同族元素原子半径非常接近,这是由于后面要提到的镧系收缩效应所造成的结果.特殊元素集锦1、最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯(Cs)。
元素周期表原子半径变化规律元素周期表是化学中的基础工具,其中的元素按照一定规律排列。
在元素周期表中,原子半径是一个重要的性质之一,它随着元素在周期表中的位置而变化。
原子半径变化规律受到原子结构和各周期性趋势的影响,下面将详细介绍元素周期表中原子半径的变化规律。
原子半径的定义原子半径是指原子核到外层电子轨道最外电子的平均距离。
通常采用皮肤效应法或者晶体半径测定法来确定原子半径。
原子半径的趋势在元素周期表中,原子半径的一般规律是向左下方增大。
这是因为随着元素周期号的增大,电子层的能级增加,电子云的半径也随之增大。
但是在同一周期内,原子半径随着原子序数的增加反而减小。
这是由于同一周期内电子层数相同,但核电荷增加,电子吸引力增强,使得原子半径减小。
原子半径变化规律1.向下一周期增大规律:从周期表上可以看到,元素周期表中,原子半径随着周期数增大而增大。
这是因为随着周期数的增大,电子层的数量增加,电子云的分布范围也相应增大。
2.向上一周期减小规律:相反地,从周期表上看,在同一周期内,原子序数递增时,原子半径却随之递减。
这是由于虽然同一周期内电子层数不变,但是核电荷增加,电子云受到核吸引力增强,电子云范围减小,在同周期内原子半径减小。
3.同族元素的原子半径趋势:同一族内的元素,原子半径随着周期数的增加而增大。
这是因为同一族内的元素具有相似的化学性质,拥有相同外层电子结构,因此随着周期数增加,电子层数增多,电子云范围变大,原子半径增大。
4.原子半径和离子半径的关系:原子失去或获得电子形成带电离子后,其半径会发生变化。
正离子半径小于原子半径,负离子半径大于原子半径。
结论元素周期表中,原子半径的变化规律主要受元素在周期表中的位置和电子结构的影响,一般原子半径随周期数的增加而增大,随原子序数的增加而减小。
同时,同族元素的原子半径具有一定的规律,正负离子半径也会受到原子半径变化的影响。
参考文献•Atkins, P., & De Paula, J. (2018). Atkins’ Physical Chemistry. OUP Oxford.•Silberberg, M. S. (2014). Chemistry: The molecular nature of matter and change. McGraw-Hill Higher Education.。
元素周期表中半径的变化规律
元素周期表是化学家们研究元素性质的一把有力工具。
其中,元素的原子半径是一个重要的物理性质,它代表了原子的大小。
原子的半径受到原子核电荷数和电子排布等因素的影响,因此在元素周期表中,原子半径呈现出一定的规律性变化。
主族元素的原子半径变化规律
主族元素位于元素周期表的A族,主要是1A、2A、3A、4A、5A、6A、7A族元素,它们的原子半径在周期表中呈现出明显的递增趋势。
这是因为主族元素的原子序数增大,电子层的能级逐渐增加,核电荷的增加不足以抵消电子屏蔽效应的增大,从而导致原子半径增大。
过渡元素的原子半径变化规律
过渡元素位于元素周期表的B族,主要是3B到12B族元素,它们的原子半径在周期表中并没有明显的变化规律。
过渡元素的原子半径受到电子排布、核电荷数和价电子数等多种因素的综合影响,因此在周期表中并不呈现出明显的递增或递减趋势。
稀有气体元素的原子半径
稀有气体元素位于周期表的最后一列,它们的原子半径相对较大且非常稳定。
稀有气体元素具有完整的电子层结构,它们的电子排布非常稳定,因此原子半径相对较大。
总体来说,元素周期表中的原子半径变化规律主要受到电子排布、核电荷数以及屏蔽效应等因素的综合影响。
主族元素的原子半径呈现出递增趋势,而过渡元素的原子半径变化不明显。
稀有气体元素的原子半径较大且稳定。
理解元素周期表中原子半径的变化规律,有助于我们更好地认识元素的性质和化学反应。