2020高中化学硼单质及其化合物
- 格式:ppt
- 大小:1002.00 KB
- 文档页数:27

第十五章 硼族元素Chapter 15 The Boron Family ElementsBoron (B) Aluminum (Al) Gallium (Ga) Indium (In)Thallium (Tl)Electron configuration :n s 2n p 1§15-1 硼及其化合物 Boron and its Compounds一、General Properties1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。
(1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似;(4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。
2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O ,四水硼砂(kernite ):Na 2B 4O 7·4H 2O ,天然硼酸 ( sassolite ):H 3BO 3存在。
3.硼在自然界中丰度之所以低,是因为Li He B 734210105+→+n ,所以硼材料可作为核反应堆的减速剂和生物防护。
二、The Simple Substance1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals ofboron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃)单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。

硼族元素及其化合物约公元前200年,古埃及、罗马、巴比伦曾用硼沙制造玻璃和焊接黄金。
法国化学家盖·吕萨克用金属钾还原硼酸制得单质硼。
硼在地壳中的含量为0.001%。
硼为黑色或银灰色固体。
晶体硼为黑色,硬度仅次于金刚石,质地较脆。
硼还由于其缺电子性造成其氢化物中硼原子拥有异常高的配位数,使之成为所有元素氢化物中结构最复杂的。
单质硼为黑色或深棕色粉末,熔点2076℃。
沸点3927℃。
单质硼有多种同素异形体,无定形硼为棕色粉末,晶体硼呈灰黑色。
晶态硼较惰性,无定形硼则比较活泼。
单质硼的硬度近似于金刚石,有很高的电阻,但它的导电率却随着温度的升高而增大,高温时为良导体。
硼共有14种同位素,其中只有两个是稳定的。
室温时为弱导电体;高温时则为良导体。
在自然界中主要以硼酸和硼酸盐的形式存在。
晶体结构晶态单质硼有多种变体,它们都以B12正二十面体为基本的结构单元。
这个二十面体由12个B原子组成,20个接近等边三角形的棱面相交成30条棱边和12个角顶,每个角顶为一个B原子所占据。
由于B12二十面体的连接方式不同,键也不同,形成的硼晶体类型也不同。
其中最普通的一种为α-菱形硼。
α-菱形硼是由B12单元组成的层状结构,α-菱形硼晶体中既有普通的σ键,又有三中心两电子键。
许多B原子的成键电子在相当大的程度上是离域的,这样的晶体属于原子晶体,因此晶态单质硼的硬度大,熔点高,化学性质也不活泼。
在α-菱形硼晶格中,每个二十面体通过处在腰部的6个B原子以三中心两电子键与在同一平面内的相邻的6个二十面体连接起来(其中虚线三角形表示三中心两电子键,键距203pm)。
这种二十面体组成的片层,层面结合靠的是二十面体的上下各3 个B原子以6个正常的B-B共价键(即两中心两电子键,键长171pm)同上下两层的6个附近的二十面体相连接,3个在上一层,3个在下一层。
在硼的二十面体结构单元中,B12的36个电子是如下分配的:在二十面体内有13个分子轨道,用去26个电子;每个二十面体同上下相邻的6个二十面体形成6个两中心两电子共价键,用去了6个电子;在二十面体腰部的6个B原子与同平面上周围相邻的6个三中心两电子键,用去了6×2/3=4个电子,结果总电子数是26+6+4=36。

第十五章 硼族元素Chapter 15 The Boron Family ElementsBoron (B) Aluminum (Al) Gallium (Ga) Indium (In)Thallium (Tl)Electron configuration :n s 2n p 1§15-1 硼及其化合物 Boron and its Compounds一、General Properties1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。
(1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似;(4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。
2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O,四水硼砂(kernite ):Na 2B 4O 7·4H 2O,天然硼酸 ( sassolite ):H 3BO 3存在。
3.硼在自然界中丰度之所以低,是因为Li He B 734210105+→+n ,所以硼材料可作为核反应堆的减速剂和生物防护。
二、The Simple Substance1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals ofboron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃)单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。



高考化学常考知识拓展:IIIA 族之硼及其化合物的性质1.硼硼单质有晶体硼和无定形硼两种,晶体硼相当稳定,无定形硼比较活泼,能发生如下反应:(1)高温下,与N 2、S 、X 2等单质反应,如2B +N 2=====高温2BN 。
(2)高温下同金属反应生成金属硼化物。
(3)赤热下,与水蒸气反应,2B +6H 2O(g)=====△2B(OH)3+3H 2。
(4)与热的浓硫酸或浓硝酸反应,2B +3H 2SO 4(浓)=====△2H 3BO 3+3SO 2↑,B +3HNO 3(浓)=====△H 3BO 3+3NO 2↑。
2.硼酸(H 3BO 3)(1)一元弱酸,H 3BO 3+H 2O H ++[B(OH)4]-。
(2)H 3BO 3受热时会逐渐脱水,首先生成偏硼酸(HBO 2),继续升温可进一步脱水生成四硼酸(H 2B 4O 7),更高温度时则转变为硼酸的酸酐(B 2O 3)。
3.硼氢化钠(NaBH 4)]硼氢化钠中的氢元素为-1价,具有还原性,故其可用作醛类、酮类和酰氯类的还原剂:。
4.硼砂(Na 2B 4O 7·10H 2O)(1)制备:将偏硼酸钠溶于水形成较浓溶液,然后通入CO 2调节pH ,浓缩结晶分离出硼砂:4NaBO 2+CO 2+10H 2O===Na 2B 4O 7·10H 2O +Na 2CO 3。
(2)将硼砂溶于水,用硫酸溶液调节pH ,可析出溶解度小的硼酸晶体:Na 2B 4O 7+H 2SO 4+5H 2O===4H 3BO 3↓+Na 2SO 4。
1.NaBH 4与FeCl 3反应可制取纳米铁:2FeCl 3+6NaBH 4+18H 2O===2Fe +6NaCl +6H 3BO 3+21H 2↑,下列说法正确的是( )A .该反应中氧化剂只有FeCl 3B .NaBH 4的电子式为C .NaBH 4不能与水发生反应D .该反应中每生成1 mol Fe 转移电子3 mol答案 B解析 反应2FeCl 3+6NaBH 4+18H 2O===2Fe +6NaCl +6H 3BO 3+21H 2↑中,FeCl 3中的Fe 由+3价降低到0价,水中部分H 由+1价降低到0价,所以该反应中氧化剂为FeCl 3和H 2O ,A 项错误;NaBH 4由钠离子与BH -4构成,为离子化合物,则其电子式为,B 项正确;NaBH 4中H 为-1价,水中H 为+1价,两者发生归中反应可生成氢气,C 项错误;题述氧化还原反应中,化合价升高的只有NaBH 4中的H ,由-1价升高到0价,可据此判断电子转移数目,每生成1 mol Fe ,消耗3 mol NaBH 4,转移电子12 mol ,D 项错误。


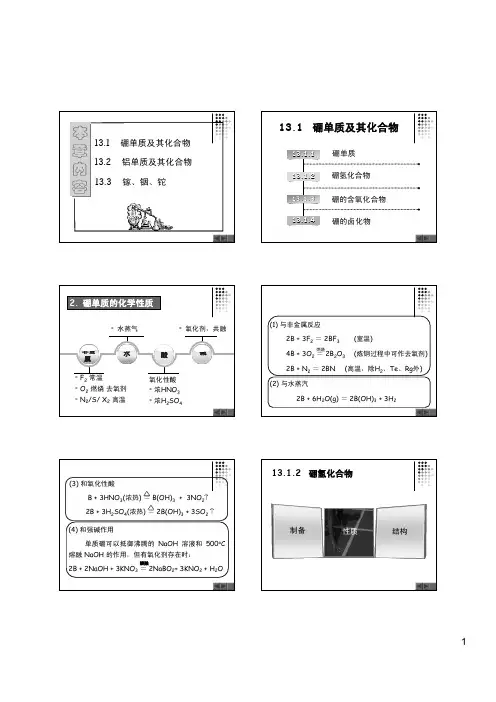

第五章 p 区元素(一)第二节硼族元素5.2.3 硼的化合物硼的氢化物硼烷分类:BnH n+4 和 B n H n+6(少氢硼烷)(多氢硼烷)例: B2H6 B4H10乙硼烷丁硼烷有CH4,但无BH3最简单的硼烷:B2H6其结构并非如右图所示:HHBBHHH H硼烷的结构B:利用 sp3 杂化轨道,与氢形成三中心两电子键。
(氢桥)记作:HH B BHH HH要点:B的杂化方式,三中心两电子键、氢桥。
B4H10分子结构硼烷的性质① 自燃 高能燃料,剧毒(可与氰化氢和光气相比) 空气中允许的最高浓度 0.1 ppm O(g)3H (s)O B (g)3O (g)H B 232262+−→−+含硼化合物燃烧火焰呈现绿色② 水解(g)H 6(s)BO 2H O(l)3H (g)H B 233262+−→−+水下火箭燃料③ 配位反应 263B H 2CO 2[H B CO]+−−→←④ 加合反应4622NaBH H B 2NaH −→−+4622LiBH H B 2LiH −→−+⑤ 与卤素反应 6HCl (l)2BCl (g)6Cl (g)H B 3262+−→−+硼的含氧化合物①三氧化二硼 B2O3原子晶体:熔点460︒C无定形体:软化结构:一般以无定形的状态存在,很难形成晶体,但在高强度退火后也能结晶。
B2O3(无定形)= B2O3(晶体)△r Hθ= - 19.2 kJ·mol-1制备:性质:(1) 溶于水形成HBO2 或H3BO3(2) 能被碱金属及镁铝还原成单质硼(3) 与金属氧化物共熔形成具有特征颜色的玻璃状偏硼酸盐,用于鉴别金属离子。
(4) 与非金属氧化物反应P2O5 + B2O3 = 2 BPO4(两性性质)②硼酸 H3BO3结构:层状结构层内:B sp2杂化有氢键。
层间:范德华力。
∴似石墨,有解离性。
硼酸晶体的片层结构24723324 Na B O2HCl5H O4H BO Na SO++−−→+制备:R.T.微溶于水,T↗,溶解度↗,可用重结晶方法提纯。
高考化学工艺流程中的新考点---硼及其化合物一、知识拓展单质硼的性质无定形和粉末状硼比较活泼,而晶态硼惰性较大。
(1)与非金属作用无定形硼在室温下与F 2反应得到BF 3,加热时也能与O 2 、Cl 2、Br 2、S 和N 2反应,分别得到BCl 3、BBr 3、B 2S 3和BN (在1473K 以上)。
它不与H 2作用。
2B + 3F 22BF 3 4B + 3O 2 2B 2O 3 (2)与酸的作用它不与盐酸作用,仅被氧化性酸,如浓HNO 3、浓H 2SO 4和王水所氧化:B + 3HNO 3H 3BO 3 + 3NO 2↑ 2B + 3H 2SO 42H 3BO 3 + 3SO 2↑ (3)与强碱作用无定形硼与NaOH 有类似硅那样的反应;有强氧化剂存在时与强碱共熔可得偏硼酸盐 : 2B + 6NaOH 2Na 3BO 3 + 3H 2↑2B + 2NaOH + 3KNO 32NaBO 2 + 3KNO 2+H 2O(4)赤热下,与水蒸气反应,2B +6H 2O(g) =====△B(OH)3+3H 2。
(5)高温下同金属反应生成金属硼化物。
2.硼的工业制法①用浓碱溶液分离硼镁矿:Mg 2B 2O 5·5H 2O+2NaOH=2NaBO 2+2Mg (OH )2↓+3H 2O ②通CO 2调节碱度,分离出硼砂:4NaBO 2+CO 2+10H 2O===Na 2B 4O 7·10H 2O +Na 2CO 3。
③用硫酸调节酸度,析出细溶解度更小的硼酸晶体:Na 2B 4O 7+H 2SO 4+5H 2O===4H 3BO 3↓+Na 2SO 4。
④加热、脱水:2H 3BO 3=====△B 2O 3+3H 2O 、⑤用镁或铝还原成粗硼:B 2O 3+3Mg=====△2B +3MgO另外,用硫酸和硼镁矿一步制得硼酸:Mg 2B 2O 5·5H 2O +2H 2SO 4=====△2MgSO 4+2H 3BO 33.氧化硼B2O3的熔点为72OK,沸点为2523K;易溶于水,形成硼酸:B2O3 + 3H2O2H3BO3但遇热的水蒸气可生成易挥发的偏硼酸:B2O3 + H2O(g)2HBO2(g)4.硼酸(1)硼酸H3BO3为白色片状晶体,微溶于水,在热水中溶解度明显增大。