F
最外层电子
原子序数 电子层数 原子半径 得电子能力 单质的氧化性 X-的还原性
Cl
Br
7个
依次增大 依次增多 依次增大 依次减弱 依次减弱 依次增强
I
体现元素的 非金属性
⑴卤族元素的物理性质 ⑵卤素的原子结构
⑶卤素的化学性质
①与氢气的反应(P8)
单质 反应条件
化学方程式
生成氢化物的 稳定性
F2 冷暗处爆炸 H2+F2=2HF
通过对同主族元素(以碱金属Li——Cs、卤素F——I) 的分析,可得以下结论:
同一主族元素,无论是金属还是非金属在性质方面 都具有一定的相似性和递变性。
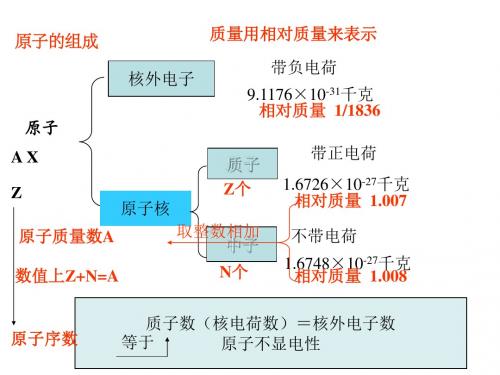
元元单单得失
素素质质电电
非金氧还子子
金属化原的的
属性性性能能
性逐逐逐力力
逐渐渐渐逐逐
渐增减增渐渐
减强弱强减增
弱
弱强
1、砹是原子序数最大的卤族元素,推测砹
铷 Rb 37 银白色,柔软 1.532 38.89 688
铯 Cs
55
略带金色光泽, 柔软
1.879 28.40 678.4
②碱金属单质的物理性质的相似性和递变性 相似性:银白色(铯略带金色) 柔软 密度小
熔沸点低 有延展性 导电和导热性强 递变性:密度增大(钾除外,钾密度比钠小)
熔点和沸点逐渐降低
第一节元素周期表第 三课时
二、元素的性质与原子结构
1.碱金属元素:Li Na K Rb Cs Fr ⑴碱金属的原子结构
最外层只有一个电子;电子层数依次增多应: 4 Li + O2 △ 2 Li2O(注意:不是生成过氧化锂) 2Na + O2 △ Na2O2 (淡黄色)