专题1 第二单元 第3讲 以物质的量为中心的计算
- 格式:docx
- 大小:410.76 KB
- 文档页数:13
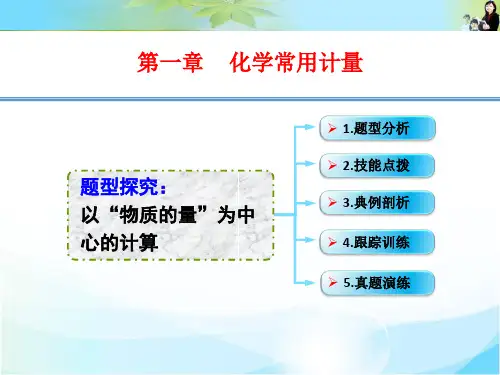
微专题02 以物质的量为中心的计算化学学科中的有关计算是以物质的量为中心进行的,化学计算是高考的必考点,更是重点。
本专题对“以物质的量为中心的有关计算”进行分类解析,并通过分层训练达成掌握,提升,灵活运用解题方法和技巧,从而实现较难化学计算题的解题突破。
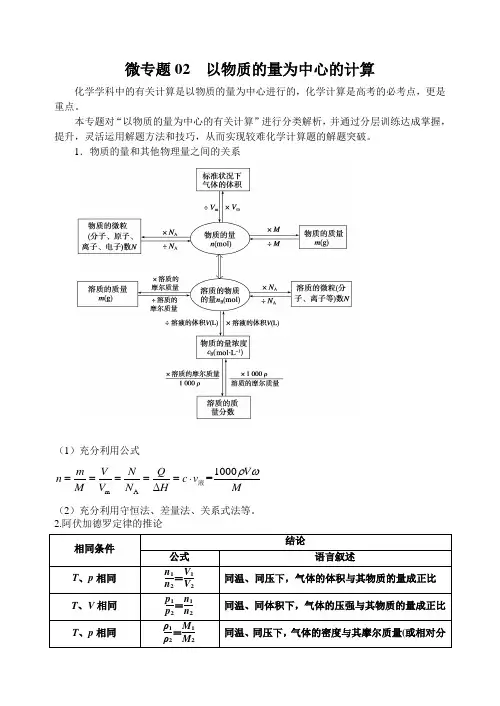
1.物质的量和其他物理量之间的关系(1)充分利用公式m A 1000=m V N Q V n c v M V N H Mρω=====⋅∆液 (2)充分利用守恒法、差量法、关系式法等。
2.阿伏加德罗定律的推论 相同条件结论 公式 语言叙述 T 、p 相同n 1n 2=V 1V 2 同温、同压下,气体的体积与其物质的量成正比 T 、V 相同p 1p 2=n 1n 2 同温、同体积下,气体的压强与其物质的量成正比 T 、p 相同 ρ1ρ2=M 1M 2 同温、同压下,气体的密度与其摩尔质量(或相对分3.解题要点(1)对气体来说,在解题时要特别注意气体所处的外界条件,因温度、压强不同,气体体积不同,注意运用阿伏加德罗定律的推论。
当涉及NO2气体时,还要考虑2NO 2N 2O 4的转化。
(2)对于混合物中各物质进行分析,既要考虑反应,还要考虑反应进行的程度和过量问题。
(3)影响因素:V m 的数值不是固定不变的,它决定于气体所处的温度和压强。
一、与物质的量有关的计算1.根据AN n N =进行相关的计算 【典例精析】下列叙述不正确的是A .1molH 2O 的质量为18g/molB .N A 个H 2SO 4分子的质量与H 3PO 4的摩尔质量在数值上相等C .3.01×1023个SO 2分子的质量为32gD .18gNH 4+含有电子数为10N A【答案】A【解析】A .1molH 2O 的质量为18g ,故A 错误;B .N A 个H 2SO 4分子的质量为98g ,H 3PO 4的摩尔质量为98g/mol ,两者在数值上相等,故B 正确;C .3.01×1023个SO 2分子的物质的量为23233.01106.0210⨯⨯=0.5mol ,质量为0.5mol×64g/mol=32g ,故C 正确;D .18gNH 4+的物质的量为1mol ,1个NH 4+中有10个电子,则1mol NH 4+中含有电子数为10N A ,故D 正确;【基础题】1.(2021学年广西象州县高一月考)1.6g 物质中含有3.01×1022个分子,该物质的相对分子量是A .16B .16gC .32D .32g/mol【答案】C【解析】 1.6g 物质中含有3.01×1022个分子,则其物质的量为22233.01106.0210⨯⨯mol=0.05mol ,所以摩尔质量为 1.6g 0.05mol=32g/mol ,则相对分子质量为32; 故答案为C 。

专题讲座(二) 以物质的量为中心的化学计算一、物质的量与相关物理量的计算关系应用上述关系可解决不同量之间的转化,计算时可把已知量先换算成物质的量,再利用物质的量去转化,即“见量化摩”,使计算变得简单。
二、气体的摩尔质量(相对分子质量)的计算 1.由单个分子真实质量m 0求:M =m 0×N A 。
2.由气体的摩尔体积V m 和密度ρ标求:在标准状况下,M =V m ·ρ标=22.4 L·mol -1×ρ标g·L -1。
3.由相对密度D 求:在同温同压下,若A 气体相对B 气体的密度为D ,M A =D ·M B 。
4.摩尔质量定义法:M =m n ,对于混合气体,M -=m (总)n (总)。
三、阿伏加德罗常数正误判断中的常见陷阱1.陷阱一:状况条件。
若给出的气体在非标准状况下,如已知常温常压下气体的体积,不能用22.4 L·mol -1进行计算。
2.陷阱二:物质状态。
已知在标准状况下非气态的物质(如水、酒精、三氧化硫等),不用能22.4 L·mol -1进行计算。
3.陷阱三:单质组成。
气体单质的组成除常见的双原子外,还有单原子分子(如He 、Ne 等)和多原子分子(如O 3等)。
4.陷阱四:粒子种类。
粒子种类一般有分子、原子、离子、质子、中子、电子等。
解答时要看准题目要求,防止误入陷阱。
四、多角度计算溶液的物质的量浓度1.万能公式:n =N N A =m M =V (气体)V m=cV (溶液)。
2.若已知某溶液的密度为ρ g·cm -3(该气体溶于1 L 水形成的溶液),c =nV (溶液)=V22.4MV 22.4+1 000ρ×1 000=1 000ρV MV +22 400mol·L -1。
3.已知溶质B 的摩尔质量为M g·mol -1,溶液密度为ρ g·mL -1,溶质的质量分数为w ,c (B)=n (B )V =ρ g·mL -1×1 000 mL ×wM g·mol -11 L =1 000ρw Mmol·L -1。


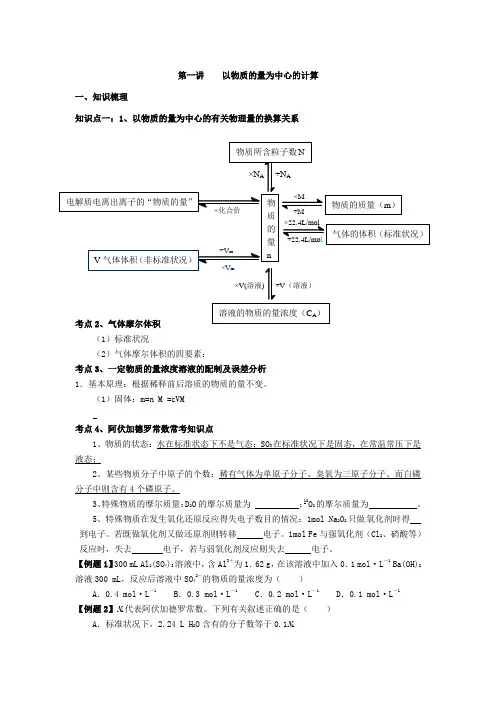
第一讲 以物质的量为中心的计算一、知识梳理知识点一:1、以物质的量为中心的有关物理量的换算关系考点2、气体摩尔体积(1)标准状况(2)气体摩尔体积的四要素:考点3、一定物质的量浓度溶液的配制及误差分析1.基本原理:根据稀释前后溶质的物质的量不变。
(1)固体:m=n M =cVM考点4、阿伏加德罗常数常考知识点1、物质的状态:水在标准状态下不是气态;SO 3在标准状况下是固态,在常温常压下是液态;2、某些物质分子中原子的个数:稀有气体为单原子分子、臭氧为三原子分子、而白磷分子中则含有4个磷原子。
3、特殊物质的摩尔质量:D 2O 的摩尔质量为 ;18O 2的摩尔质量为 。
5、特殊物质在发生氧化还原反应得失电子数目的情况:1mol Na 2O 2只做氧化剂时得 到电子。
若既做氧化剂又做还原剂则转移 电子。
1mol Fe 与强氧化剂(Cl 2、硝酸等)反应时,失去 电子,若与弱氧化剂反应则失去 电子。
【例题1】300 mL Al 2(SO 4)3溶液中,含Al 3+为1.62 g ,在该溶液中加入0.1 mol·L -1 Ba(OH)2溶液300 mL ,反应后溶液中SO 42-的物质的量浓度为( )A .0.4 mol·L -1B .0.3 mol·L -1C .0.2 mol·L -1D .0.1 mol·L -1【例题2】N A 代表阿伏加德罗常数。
下列有关叙述正确的是( )A .标准状况下,2.24 L H 2O 含有的分子数等于0.1N AB .常温下,100 mL1 mol·L -1Na 2CO 3溶液中钠离子总数为0.2 N AC .分子数为N A 的CO 、C 2H 4混合气体体积约为22.4 L ,质量为28 gD .标准状况下,22.4L 四氯化碳为1mol知识点二:计算气体相对分子质量的方法1. 已知标准状况下的气体密度:2. 非标准状况下的气体密度:3. 已知两种气体的相对密度D ,则气体的相对密度D= 例题3.某气体对空气的相对密度为1.52,则该气体的摩尔质量为多少?例题4.标准状况下,气体A 的密度约为1.51g/L ,则该气体的相对分子质量为多少? 若A 气体的化学式为H 2X,则X 的相对原子质量为多少?4. 混合物的平均相对分子质量 例如:空气的平均相对分子质量计算方法:例5.在标准状况下,8.96L 甲烷和一氧化碳的混合气体的质量为7.6g ,则混合气体的平均相对分子质量为多少?知识点三:十字交叉法求混合气体中各物质的物质的量之比例6:在标准状况下,11.2LCO 和CO 2的总质量为20.4g,求混合气体中CO 和CO 2的体积和质量之比?例7:CH 4和CO 2的混合气体的总物质的量为0.7mol ,平均相对分子质量为32,求二者的物质的量各为多少?课堂练习1.以下各组溶液中Cl -的物质的量浓度与300 mL 1 mol/L NaCl 溶液中Cl -的物质的量浓度相同的是( )A .100 mL 1mol/L AlCl 3溶液B .200 mL 1 mol/L MgCl 2溶液C .100 mL 0.5 mol/L CaCl 2溶液D .100 mL 2 mol/L KCl 溶液2.某物质A 在一定条件下加热分解,产物都是气体。


专题一以物质的量为中心的计算【专题要点】高考有关本部分内容的直接考察为选择题,通常以阿伏伽德罗常数为背景,涵盖知识点广泛,有微粒个数的考察,如氧化和还原反应中转移电子数目、溶液中离子的数目、共价键的数目;有物质的量浓度相关计算,有气体摩尔体积的换算等。
由于物质的量作为高中化学的基础间接考察也很普遍,在实验题,流程图题,填空题,计算题都有涉猎。
【考纲要求】了解物质的量的单位——摩尔( mol )、摩尔质量、气体摩尔体积(标准状况下) 、物质的量浓度、阿伏加德罗常数的含义。
并能进行有关计算(混合气体的平均相对分子质量的相关计算不作要求) 【学法指引】该部分知识点贯穿整个中学化学,考查方向主要有以下 2 种类型,在教学时要重点把握。
1.选择题:常考查物质的量、阿伏伽德罗常熟、物质的量浓度、阿伏伽德罗定律、气体摩尔体积的概念的理解;物质的量的计算在其它计算中的应用的简单计算;围绕物质的量为中心的简单计算的机械组合型选择题和利用物质的量在其它计算中的应用是两种常见类型。
2.主观题:很少有单独考查计算的试题,主要是利用物质的量作为工具进行简单计算或综合计算部分工具【知识网络】一.网络构建1. 基本概念和重要定律(1)物质的量: 物质的量实际上表示含有一定数目粒子的集体.物质的量的符号为n,其单位是摩尔,简称摩,符号为mol.lmol任何粒子的粒子数与0.012kg 12C中所含的碳原子数相同.这里的粒子指分子,原子,离子,电子,质子,中子以及它们的特定组合(2)阿伏加德罗常数:1mol任何粒子的粒子数叫做阿伏加德罗常数,其符号为N A,最23mol 1,通常使用 6.02 1023mol 1这个近似值常有新测定数据为 6.0221367 10用关(3)气体摩尔体积: 单位物质的量气体所占的体积叫做气体摩尔体积,其符号为V m. 计概单位为L ?mol 1,m3 ?mol 1 量念(4)摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量,其符号为M,单位为及g ?mol 1或kg ?mol 1.摩尔质量以克为单位时,在数值上与该粒子相对原子质量或相对其分子质量相等定(5)物质的量浓度:以单位体积溶液里所含溶质B 的物质的量来表示溶液组成的物理量律叫做溶质B的物质的量浓度,其符号为C(B),常用的单位为mol?L1或mol ?m 3重阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子要注意(1)使用范围:气体;(2)使用条件:同温,同压,同体积;(3)特例:气体摩尔体积定质量守恒定律:参加反应的各物质质量总和等于反应后生成物的质量总和(或反应前后律各种原子的种类及个数相同).此定律是书写化学方程式及进行计算的依据2.物质的量和其它物理量之间的关系:1 •物质的量与其他化学常用计量间的相互求算,是重要的基本化学计算。

专题一 以物质的量为中心的计算【专题要点】高考有关本部分内容的直接考察为选择题,通常以阿伏伽德罗常数为背景,涵盖知识点广泛,有微粒个数的考察,如氧化和还原反应中转移电子数目、溶液中离子的数目、共价键的数目;有物质的量浓度相关计算,有气体摩尔体积的换算等。
由于物质的量作为高中化学的基础间接考察也很普遍,在实验题,流程图题,填空题,计算题都有涉猎。
【考纲要求】了解物质的量的单位——摩尔(mol )、摩尔质量、气体摩尔体积(标准状况下)、物质的量浓度、阿伏加德罗常数的含义。
并能进行有关计算(混合气体的平均相对分子质量的相关计算不作要求)【学法指引】该部分知识点贯穿整个中学化学,考查方向主要有以下2种类型,在教学时要重点把握。
1.选择题:常考查物质的量、阿伏伽德罗常熟、物质的量浓度、阿伏伽德罗定律、气体摩尔体积的概念的理解;物质的量的计算在其它计算中的应用的简单计算;围绕物质的量为中心的简单计算的机械组合型选择题和利用物质的量在其它计算中的应用是两种常见类型。
2.主观题:很少有单独考查计算的试题,主要是利用物质的量作为工具进行简单计算或综合计算部分工具【知识网络】一. 网络构建1. 基本概念和重要定律⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎧∙∙∙∙∙∙⨯⨯--------式及进行计算的依据此定律是书写化学方程相同各种原子的种类及个数或反应前后的质量总和总和等于反应后生成物参加反应的各物质质量质量守恒定律气体摩尔体积特例同体积同压同温使用条件气体使用范围注意含有相同数目的分子相同体积的任何气体都在相同的温度和压强下阿伏加德罗定律律定要重或常用的单位为其符号为的物质的量浓度叫做溶质组成的物理量的物质的量来表示溶液溶质以单位体积溶液里所含物质的量浓度分子质量相等原子质量或相对在数值上与该粒子相对摩尔质量以克为单位时或单位为其符号为量具有的质量叫做摩尔质单位物质的量的物质所摩尔质量单位为其符号为积的体积叫做气体摩尔体单位物质的量气体所占气体摩尔体积这个近似值通常使用新测定数据为最其符号为阿伏加德罗常数任何粒子的粒子数叫做阿伏加德罗常数合中子以及它们的特定组质子电子离子原子这里的粒子指分子原子数相同中所含的碳任何粒子的粒子数与符号为简称摩其单位是摩尔物质的量的符号为有一定数目粒子的集体物质的量实际上表示含物质的量念概关有律定其及量计用常).(::)3(;,,:)2(;:)1(.,:),(,,:)5(,.,,:)4(,.,:)3(1002.6,100221367.6,,1:)2(,,,,,.012.01.,,,.:)1(311113112312312m m ol L m ol B c B B m ol kg m ol g M m ol m m ol L V m ol m ol N m ol C kg m ol m ol n m A2.物质的量和其它物理量之间的关系:二.关于阿伏加德罗常数的理解与综合应用阿伏加德罗常数问题主要有:(1)一定质量的物质中所含原子数、电子数,其中考查较多的是H 2O 、N 2、O 2、H 2、NH 3、P 4等。


专题2 化学计量化学物质及其变化第一单元化学计量第3讲以物质的量为中心的计算一、课程标准要求1.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
2.培养学生的实验探究能力和化学计算能力。
3.提升证据推理与模型认知及科学探究的学科核心素养。
二、在高中化学教材体系中的地位以物质的量为中心的计算贯穿整个高中化学,设题形式通常是第Ⅱ卷中的计算题。
计算题重点考察物质的量应用于化学(离子)方程式的有关计算,通常用来确定物质的组成、物质的含量。
三、思维导图四、课时安排建议第1课时以物质的量为中心的计算(1课时)第1课时以物质的量为中心的计算(1课时)一、教学流程活动一:构建知识体系问题1:运用哪些公式,实现其它物理量与物质的量的转换?[例题1](1)标准状况下11.2 L N2的物质的量为。
(2)28 g氮气所含的原子数为。
(3)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为mol·L-1。
(4)17 g -OH与17 g OH-所含电子数目分别为,。
[归纳总结]n=NN A=mM=VV m=c B V问题2:守恒思想是化学定量计算的重要考点和热点,化学计算中常见的守恒法有哪些?守恒法是一种整合的思维方法,运用守恒定律,不纠缠过程细节,只考虑反应体系中研究对象化学量的始态和终态(如反应中的原子守恒、得失电子守恒、电荷守恒、化合价升降守恒、能量守恒等)或相互间的关系(如化合物中的化合价规则,电解质溶液中的电中性原则等),从而达到速解、巧解化学试题的目的。
1.质量守恒(原子守恒)依据化学反应的实质是原子的重新组合,反应前后各原子的种类和数目保持不变。
2.得失电子守恒氧化还原反应中,元素原子化合价升高的总价数=元素原子化合价降低的总价数,即还原剂失电子的总数=氧化剂得电子的总数。
3.电荷守恒在离子反应方程式中,反应前后的阴、阳离子所带的电荷总数相等。
第3讲 以物质的量为中心的计算 复习目标 1.掌握物质的量、微粒数、气体摩尔体积、物质的量浓度之间的转化关系。
2.掌握“以物质的量”为中心的计算。
考点一 有关物质的量浓度的综合计算
1.物质的量浓度、质量分数、溶解度间的换算
由定义出发,运用公式:c =n V 、质量分数=溶质的质量溶液的质量
×100%进行推理,注意密度的桥梁作用,不要死记公式。
(1)物质的量浓度(c )与溶质质量分数(w )的换算
体积为V L ,密度为ρ g·cm -3的溶液,含有摩尔质量为M g·mol -1的溶质m g ,溶质的质量分
数为w ,则溶质的物质的量浓度c 与溶质的质量分数w 的关系是:c =n V =m M V =m MV =1 000ρw V MV
=1 000ρw M ,反之,w =cM 1 000ρ。
(2)物质的量浓度(c )与溶解度(S )的换算
若某饱和溶液的密度为ρ g·cm -3,溶质的摩尔质量为M g·mol -1,溶解度为S g ,则溶解度与
物质的量浓度的表达式分别为:S =100cM 1 000ρ-cM
,c =n V =S M 100+S 1 000ρ
= 1 000ρS M (100+S )。
2.溶液稀释和混合的计算
(1)溶液稀释定律(守恒观点)
①溶质的质量在稀释前后保持不变,即m 1w 1=m 2w 2。
②溶质的物质的量在稀释前后保持不变,即c 1V 1=c 2V 2。
③溶液质量守恒,m (稀)=m (浓)+m (水)(体积一般不守恒)。
(2)同溶质不同物质的量浓度的溶液的混合计算
①混合后溶液体积保持不变时,c 1V 1+c 2V 2=c 混×(V 1+V 2)。
②混合后溶液体积发生改变时,c 1V 2+c 2V 2=c 混V 混,其中V 混=m 混ρ混。
(3)溶质相同、质量分数不同的两溶液混合定律(教师用书独具)
①等质量混合。