《医用化学》第三章
- 格式:pptx
- 大小:3.32 MB
- 文档页数:28

《医用化学》理论教学大纲《医用化学》理论教学大纲(供四年制本科护理等专业使用)Ⅰ前言《医用化学》是护理等专业学生开设必修的专业基础课,根据专业的特点和需要,扼要地介绍无机化学和有机化学中的基础理论和基本知识。
为学习后续课程(生物化学、生理学和药理学等)打下基础。
使学生掌握各类有机化合物的系统命名原则和一些常见的有机物的俗名,能根据要求正确书写名称和结构式。
使学生掌握几种常用溶液浓度表示方法及计算,理解渗透现象、渗透压的概念及其在医学上的意义。
能理解简单的结构理论,并初步认识简单有机化合物结构与性质的关系。
掌握各类典型有机化合物官能团的结构特征和主要的化学性质,初步学会简单有机化合物的结构分析,能运用化合物官能团的性质,提出简单有机化合物的鉴别。
理解与医药有关的化合物的性质、来源及用途。
了解合成化学的基础知识和技能,了解基础化学与医学的联系及学科发展的动态,使学生基本具备后继专业课程的学习和从事医药、护理及临床合理用药等工作所需要的基础化学知识。
通过学习医用化学课程,使学生了解和掌握与医学有关的化学基本知识、基本原理及基本实验技能,了解这些知识、理论和技能在医学上的应用,培养学生能用相关知识分析和解决实际问题的能力。
本大纲适用于四年制本科护理学等专业学生使用,现将大纲使用中有关问题说明如下:一本大纲是根据国家高等医学院校教学的培养目标,结合我校专业设置而编写的。
可供与医学有关的各专业(少学时的医学本科)等使用。
教学内容中的核心内容用实线标示,重点内容用虚线标示,一般内容不作标示。
二教师在保证大纲核心内容的前提下,可根据不同教学手段,讲授重点内容和介绍一般内容。
有的内容可留给学生自学。
三总教学参考学时为48学时。
理论课40学时,实验课8学时,理论课/实验课为5:1四教材:《医用化学》,第四军医大学出版社,席晓岚,1版,2009年。
《医用基础化学实验》,第四军医大学出版社,胡庆红,1版,第5次印刷,2015年。

习 题 解 答第一章 溶 液1. 温度、压力如何影响气体在水中的溶解度?2. 何谓亨利定律?何谓气体吸收系数?3. 亨利定律适应的范围是什么?4. 20℃,10.00mL 饱和NaCl 溶液的质量为12.003g ,将其蒸干后,得到NaCl3.173g 。
求:(1)质量摩尔浓度;(2)物质的量浓度。
解:NaCl 的相对分子量为:58.5NaCl 的物质的量为:mol M m n B 05424.05.58173.3===(1) NaCl 的溶解度:)100/gNaCl (93.35100173.3003.12173.3水g =⨯-(2) 质量摩尔浓度:).(143.61000/)173.3003.12(5.58/173.31-=-==kg mol W n m B B (3) 物质的量浓度:).(424.51000/105.58/173.31-==L mol V n c B B 5. 将8.4g NaHCO 3溶于水配成1000mL 溶液,计算该物质的量浓度。
解:NaHCO 3相对分子量为:84 NaHCO 3的物质的量为:mol M m n B 1.0844.8===NaHCO 3的物质的量浓度:).(1.01000/10001.01-===L mol V n c B B 6. 欲配制10.5mol ·L -1 H 2SO 4 500mL ,需质量分数为0.98的H 2SO 4(密度为1.84)多少毫升?解:H 2SO 4的相对分子量为:98所需的H 2SO 4的物质的量为:mol V c n B B 25.51000/5005.10=⨯=⨯=设所需的0.98的H 2SO 4V (ml ),则H 2SO 4溶液的质量为V ×1.84(g ),所以含有的纯H 2SO 4为V ×1.84×0.98(g )。
25.59898.084.1=⨯⨯==V M m n B V =285.3ml7. 某病人需要补充钠(Na +)5g ,应补给生理盐水(0.154mol ·L -1)多少毫升? 解:设需要生理盐水Vml ,则含有NaCl 的物质的量为:V ×0.154/1000(mol ),所以含有的Na +的物质的量为:V ×0.154/1000(mol )。

《医用化学》教案李美芳《医用化学》辅导课(一)第一章溶液本章知识点与考核要求1.分散系掌握什么叫分散系、分散相和分散介质;分散系的分类。
了解分子分散系。
2.溶液的浓度重点掌握几种常用的浓度表示方法(质量浓度、物质的量浓度);质量浓度与物质的量浓度间的换算及溶液的稀释。
3.溶液的渗透压掌握渗透、半透膜、渗透压等概念,重点掌握渗透压定律及其计算;渗透浓度,掌握渗透浓度的计算及等渗、高渗和低渗溶液的概念。
了解晶体渗透压和胶体渗透压。
4.溶胶了解溶胶的光学性质、动力学性质和电学性质、溶胶的结构、溶胶的稳定因素和聚沉。
本章重难点教学内容1.物质的量浓度B的物质的量浓度是指B的物质的量除以混合物的体积。
通常我们所说的溶液浓度就是指溶液的物质的量浓度。
用符号表示,即式中为物质的量,SI单位为mol;V为混合物的体积,对溶液而言,就是溶液的体积,常用的非SI单位为L,故浓度的常用单位为。
根据SI规定,使用物质的量单位“mol”是,要注明物质的基本单元。
而溶液的浓度单位是由基本单位“mol”推导得到的,所以在使用浓度单位时也必须注明所表示物质的基本单元。
例如:与的两种溶液,它们浓度数值虽然相同,但是,它们所表示1L溶液中所含的质量是不同的,分别为15.8g与3.16g。
2.物质B的质量浓度物质B的质量浓度为物质B的质量除以溶液的总体积。
B的质量浓度为式中,为B的质量浓度,单位和密度单位相同,常用或等,V为溶液的体积,常用单位为L或mL,为B的质量,常用单位为kg或g。
3.物质的量浓度与质量浓度的关系根据质量浓度定义4.溶液的稀释在稀释时,溶液的体积由变到,但溶质的物质的量并不改变,他们的关系为:5.渗透压难挥发的非电解质稀溶液的渗透压与溶液的质量摩尔浓度(或物质的量浓度)成正比,而与溶质的本性无关。
应用溶液的渗透压与溶液的质量摩尔浓度的关系可以测定溶质的分子量。
或综合练习1.计算下列几种常用试剂的物质的量浓度。
(1)浓盐酸含HCl的质量分数为37%,密度为1.19。

《医用化学基础》复习题第一章溶液和胶体一种物质分别在另一种物质中形成的系统,称分别系。
被分别的物质,称分别相,容纳分别相的物质,称分别介质。
产生浸透现象的原由是什么?因为半透膜拥有只同意溶剂分子经过而不一样意其余物质分子经过的特征,当用半透膜将溶剂与溶液分开时,溶剂分子可向膜双侧自由浸透,而溶质分子通可是半透膜。
这时单位体积内溶剂分子数量多的溶剂将有许多的溶剂分子进入溶液,而溶液中只有较少量目的溶剂分子进入溶剂一侧。
综合作用的结果是造成溶剂分子进入溶液。
等渗以正常人血浆的浸透压280~320mmol·L-1为标准,低于280mmol·L-1为-1低渗溶液;高于320mmol·L的为高渗溶液。
医学知识:外科消毒用的乙醇浓度是75%?因为含有甲醇,工业酒精为何不可以做饮用酒?血糖往常指血液中的是葡萄糖?机体溶胀能力降落是老年人产生好多皱纹及血管硬化的原由之一;生物标本防腐剂“福尔马林”的成分为40%甲醛水溶液;溶液的浸透压是溶液的性质,不是半透膜存在时才存在;临床上常用的等渗溶液有-1N aCl,50g·L-1葡萄糖,·-1乳酸钠,·-1NaHCO3等等。
9g·L9gL L3.临床上大批输液的基来源则是应用等渗溶液。
溶血是指红细胞(红血球)因各样原由造成细胞膜破碎,细胞内容物溶出的现象。
惹起溶血的原由之一是浸透压的问题。
解说:临床为病人大批输液时,为何要用等渗溶液?答:血液拥有必定的浸透浓度,但在血液中注入大批的低渗溶液时,稀释了血液,使其浸透浓度大大降落,这时血液中的水分子将会经过细胞膜向红细胞内浸透,而使血红细胞膨胀,甚至破碎;反之,若向血液中注入大批的高渗溶液时,将使血液浸透浓度大大高升,这时红细胞内液的水分子又将会经过细胞膜向血液中浸透。
上述两种状况,严重时都可危及生命,因此临床为病人大批输液时,应当用等渗溶液。
第二章化学热力学与化学动力学基础1.一些基本观点:基元反响(元反响):一步能够达成的化学反响。

医⽤化学基础复习资料《医⽤化学基础》复习资料周纪2014年11⽉30⽇第三章溶液1. 物质的量是表⽰,单位是,⽤符号表⽰。
2. 阿伏伽德罗常数⽤符号表⽰,。
3.1摩尔任何物质都包含有。
4. 摩尔质量是表⽰,单位是,⽤符号表⽰。
5. 90 g H2O的物质的量是多少?6. 2.5 mol Fe原⼦的质量是多少?7. 4.9 gH2SO4分⼦⾥含多少个H2SO4分⼦?8. 某KOH溶液1000ml中含0.5mol的KOH,试问该KOH溶液的物质的量浓度是多少?9. 100ml正常⼈的⾎清中含10.0mg Ca2+,计算正常⼈⾎清中含Ca2+的物质的量浓度.10. 临床上纠正酸中毒使⽤的乳酸钠(NaC3H5O3)注射液,规格为每⽀20ml注射液中含乳酸2.24 g,求该注射液中乳酸钠的物质的量浓度.11. 我国药典规定,⽣理盐⽔的规格是500ml⽣理盐⽔中含有4.5 g NaCl,计算⽣理盐⽔的质量浓度.。
5O3)注射液,规格为每⽀20ml注射液中含乳酸钠2.24 g,求该注射液中乳酸钠的质量浓度.13. 9 g/L ⽣理盐⽔的物质的量浓度是多少?14. 临床上纠正酸中毒使⽤的乳酸钠(NaC3H5O3)注射液的物质的量浓度为1 mol/L,问该注射液的质量浓度是多少?15.配制0.2mol/L Na OH溶液100ml,需取2mol/L NaOH溶液多少ml?16. 临床上需61mol/L 乳酸钠溶液360mL ,现有1mol/L 的乳酸钠针剂(每⽀ 20 mL ),问需这样的针剂⼏⽀?17. 产⽣渗透现象必须具备两个条件:,。
18. ⽐较0.1 mol/L NaCl 溶液与0.1 mol/L CaCl 2溶液的渗透压⼤⼩。
19. ⼤量输液时,必须使⽤。
20. ⽤⾼渗溶液作静脉注射时,。
21. 静脉滴注 0.9 g/L 的NaCl 溶液,红细胞会。
练习题1、物质的量是表⽰()。
A 、物质数量的量B 、物质质量的量C 、物质粒⼦数⽬的量D 、物质单位的量 2.在0.5molNa 2SO 4中,含有的Na + 数是()A.3.01×1023B.6.02×10234、将12.5克葡萄糖溶于⽔,配成250毫升溶液,该溶液的质量浓度为()。

《医用化学》教学大纲建桥学院护理系2011年建桥护理护理系三年制专科护理专业《医用化学》课程教学大纲一、课程的性质与任务(一)本课程的性质本课程主要面向护理专业大一学生,属于专业基础课。
(二)本课程的任务在整个专业的培养计划中,本课程属于专业基础课。
本课程注重与中学化学的衔接,促使学生尽快完成从中学到大学学习方法的转变;注重与后续课程及相关学科的联系,大量增加与医学相关的化学知识,提高学生的学习兴趣。
具体实施时,理论课与实验课交替进行,使学生不但打好扎实的理论基础,还掌握基本的实验操作技能,养成良好的科学工作作风;同时培养学生分析问题、解决问题的能力,为今后的学习和工作打下良好的基础。
二、课程的基本要求通过本课程的学习,使学生明确化学基础理论和基本知识在本专业中的重要性;理解常用的溶液浓度、溶液的渗透压、缓冲溶液、配位化合物等对专业的意义;熟练地进行有关的化学计算;认识有机物的结构特点;运用命名原则进行命名;理解有关有机化合物的主要化学性质并书写化学反应式;掌握化学实验基本技能,正确使用常用仪器和试剂进行化学实验,并规范地书写实验报告;养成积极主动、严谨求实的学习习惯和遵守纪律、团结合作、爱护公物和良好品德。
三、课程内容(一)课程主要内容第一章绪论学习要点:化学的研究对象是物质、即研究物质的组成、结构、性质及其变化规律。
化学是医学的基础,医学的发展和进步离不开化学。
人和大自然具有相同的化学元素组成;人体是一个复杂的化学反应系统,每时每刻都在进行着各种形式的化学反应,只不过这些反应比体外反应更复杂、更高效、更精确。
医学化学是一门重要的公共基础课,包括无机化学、有机化学和化学实验三部分。
学习要求:掌握化学的研究对象熟悉化学和医学的关系,SI单位制和法定计量单位了解医学化学课程的地位和作用,有益的学习方法第二章溶液学习要点:1、溶液组成标度的表示方法2、溶液的渗透压3、渗透压在医学上的意义学习要求:掌握物质的量浓度、质量浓度、质量分数、体积分数及其有关计算,渗透现象产生条件,渗透压和渗透浓度的概念及计算。

医用化学答案第三版【篇一:医用化学课后习题答案】第一章溶液3.?pk??tfkf??tbkb??rt-19.342.411.34797-1-1-1第二章电解质溶液2.oh-、h2o、hco3-、s2-、nh2ch(r)coo-、[al(h2o)5(oh)]2+、cl-、hpo42- 3.h3o、nh4+、h2po4-、h2s、[al(h2o)6]3+、nh3+ch(r)cooh、hcn、hco3-4.酸:nh4+、h3o+、hcl;碱:ac-;两性物质:h2o、nh3+ch(r)coo-、hco3-、[al(h2o)5(oh)]2+ 5.酸性从强到弱的顺序依次为:h3o+,hac,h2po4-,nh4+,hco3-,h2o 碱性从强到弱的顺序依次为:oh,co3,nh3,hpo4,ac,h2o 6.ph=3.3 7.29~37倍 8.③;④;⑤9.①2.38;②4.02;③8.60;④9.94 10.6.0812.①naac;②5.70;③13.95-5-1-2-2--第三章缓冲溶液4.①9.73;②10.95;③4.45;④7.245;⑤4.275.①6.5.05~5.19;0.0714 7.17.3g 8.47.6ml9.甲:正常;乙:酸中毒;丙:碱中毒第四章原子结构与化学键理论3.1s22s22p63s23p64s2;n=4;=0;m=0;ms=+12或-12;10;3;6124.①m=0;②n=3;③l=1,2,3;④n=1,2,3……;ms=+或-128.bf3:sp2,平面三角形;ph3:sp3,三角锥;h2s:sp3,v形;hgbr2:sp,直线形;sih4:sp3,正四面体;9.①ch4:sp3;h2o:sp3;nh3:sp3;co2:sp;c2h2:sp第五章化学热力学基础3.不正确 4.④第六章化学反应速率4第七章胶体溶液1.s0=32.0.186j-+x-+9.①a;②b;③c;④b-1-1-1-1第八章滴定分析法2.①4;②3;③1;④2;⑤2;⑥不定 3.①2.099;②0.99;-49.0.7502;0.2219 10.0.006282 11.pk=5.5 12.①偏大;②偏小第九章配位化合物;sb3+;cl-1;6;②四羟合锌(Ⅱ)酸钾;zn2+;oh-;4;③二氯四氨合钴(Ⅱ)1.①六氯合锑(Ⅲ);co2+;nh3;cl-;6;④二氰合铜(Ⅰ)配离子;cu2+;cn-;2;⑤硫酸一氯一硝基四氨合铂(Ⅳ);nh3;no2-;cl-;6 pt(Ⅳ)2.①[zn(nh3)4]so4;②k[pt(nh3)cl5];③[co(nh3)3(h2o)cl2]cl;④(nh4)3[cr(scn)4cl2] 3.①能;②不能4.①向右;②向右;③向左5.①d2sp3;②sp3d2;③dsp2;④sp3-4-1-4-1第十章电极电势与电池电动势1.+5;+1;-1;+6;+2;+2 2.cl2;pb3+,h2o 3.还原型辅酶Ⅰ,二氢核黄素,乳酸,还原型fad,琥珀酸,细胞色素c(fe)10.①-0.4577v;向左;-21-35第十一章紫外-可见分光光度法-6-1-16.t=77.5%,a=0.111;t=46.5%,a=0.333第十二章基本有机化合物1.①1-戊烯;②2-甲基-1-丁烯;③4-甲基-4-己烯-1-炔;④二环[3,2,1]辛烷;⑤螺[3,4]辛烷;⑥甲基对苯二酚(或2-甲基-1,4-苯二酚);⑦苄甲醚(或苯甲甲醚);⑧3,4-二甲基戊醛;⑨1-苯基-2-丙酮;⑩2-甲基-2-丁醇 2.①3 3 ②ch3ch=chch=chch3ch32ch3ch3ch2ch2ch3o ho3o③④⑤ch32ch33ch3oh3.①3 ② ch coch c + coohh333clohoh③ ch 3 r 2ch 3④ ; cb ⑤och3ch2ch2cch3 ;no2⑥⑦ooho3nachi3ch3ch2ch2coona+ch3⑧ch3ch2chohch(ch3)cho;⑨(ch3)3ccoona+(ch3)3cch2oh4.①加溴的四氯化碳溶液不褪色者为己烷;另取剩下者加硝酸银的氨溶液,有白色沉淀生成者为1-己炔。


医用基础化学教学大纲(详情)医用基础化学教学大纲医用基础化学教学大纲一、教学目的通过本课程的学习,使学生掌握医用基础化学的基本理论、基本知识和基本技能,了解医用基础化学在医学中的应用,提高学生的科学素养和医学专业能力。
二、教学内容第一章溶液与胶体1.溶液的组成表示法2.溶液的渗透压3.胶体与胶体颗粒的大小和稳定性第二章化学反应的基本原理1.化学反应的方向和焓变2.化学反应的速率和速率方程3.化学平衡和影响平衡的因素4.分配定律和混合物的分离第三章电解质与离子平衡1.强电解质和弱电解质的概念和分类2.离子方程式的书写和意义3.水的离子积和溶液的酸碱性4.沉淀溶解平衡和溶度积常数第四章生物分子的结构与性质1.生物分子的一般性质和分类2.生物分子的结构基础(如蛋白质、核酸、糖类等)3.生物分子的结构和功能的关系4.生物分子在医学中的应用第五章有机化合物结构与性质1.有机化合物的一般性质和分类2.有机化合物的结构特征(如官能团、碳骨架等)3.有机化合物的反应类型(如取代、加成、消去等)4.有机化合物在医学中的应用第六章化学与医学的关系与应用1.医用化学在医学中的应用领域(如药物合成、生物分子分析等)2.化学在医学研究中的重要性及其发展趋势分析化学医学检验教学大纲分析化学和医学检验是两个不同的领域,但是它们之间有着密切的联系。
分析化学是一门研究物质的组成、含量、结构和形态等化学成分的学科,而医学检验则是医学领域中用于诊断、治疗和监测的重要手段。
分析化学教学大纲应该包括以下几个方面:1.基础知识:介绍分析化学的基本概念、原理和方法,包括物质的组成、元素分析、有机分析、定量分析、仪器分析等。
2.实验技能:通过实验操作,让学生掌握分析化学的基本实验技能,包括样品的采集、前处理、分析测试和结果报告等。
3.医学检验应用:介绍医学检验的基本概念、原理和方法,包括血液分析、尿液分析、生化分析、免疫分析等。
4.质量控制:介绍质量控制的基本概念和方法,包括质量控制计划、质量控制实验室的设置、质量控制数据的分析和处理等。

《医用化学》教学大纲(完整版)《医用化学》教学大纲《医用化学》教学大纲一、课程简介医用化学是医学院校一门重要的基础课程,主要内容包括无机及有机化学,涵盖了医学化学的基础理论和基本实验技能。
本课程的教学目标是帮助学生掌握医学化学的基本知识和实验技能,为后续医学课程的学习打下基础。
二、课程要求本课程要求学生掌握基本的化学理论和实验技能,包括无机和有机化学的基本概念、原理和实验方法。
学生需要具备一定的数学、物理和生物学基础知识,以便更好地理解和应用化学知识。
三、教学内容与目标要求本课程的教学内容包括无机和有机化学两大部分,具体内容如下:无机化学部分:1.溶液和胶体溶液2.电解质溶液3.化学反应速率和化学平衡4.原子结构和分子结构5.配位化合物有机化学部分:1.烃的性质和命名2.醇和酚的性质和命名3.醛和酮的性质和命名4.酸和碱的性质和命名5.碳水化合物的性质和命名6.脂类和氨基酸的性质和命名7.蛋白质的性质和命名8.核酸的性质和命名教学目标要求学生掌握无机和有机化学的基本理论和实验技能,能够运用化学知识解决医学领域中的相关问题。
学生需要具备数学、物理和生物学基础知识,以便更好地理解和应用化学知识。
四、教学方法与手段本课程采用多媒体教学,通过图片、视频和动画等形式展示教学内容,提高学生的学习兴趣和效果。
同时,教师采用课堂讲解、课堂讨论和学生实验等多种教学方法,帮助学生更好地理解和掌握教学内容。
五、课程评估本课程的评估方法包括平时作业、实验报告、期末考试和实验操作等环节。
平时作业主要考察学生对课堂知识的掌握情况;实验报告主要考察学生的实验技能和应用能力;期末考试主要考察学生对无机和有机化学的基本理论和实验技能的掌握情况;实验操作主要考察学生的实验技能和应用能力。
评估标准包括学生的出勤率、作业完成情况、实验报告质量和期末考试成绩等方面。
医药化学基础教学大纲医药化学基础教学大纲应由本人根据自身实际情况书写,以下仅供参考,请您根据自身实际情况撰写。
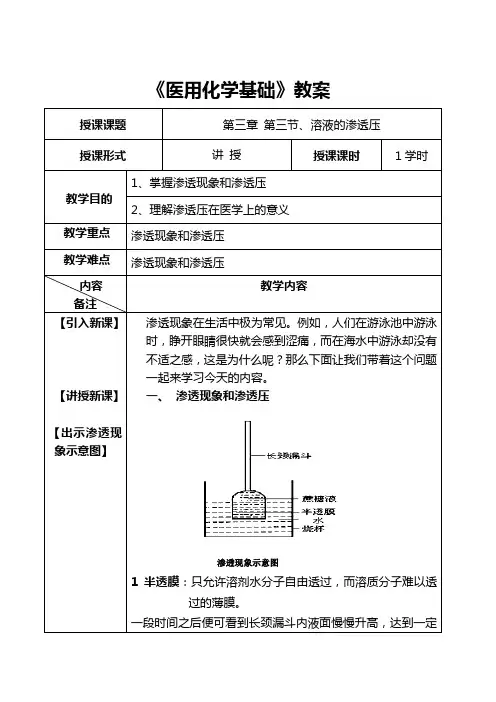
《医用化学基础》教案授课课题第三章第三节、溶液的渗透压授课形式讲授授课课时1学时教学目的1、掌握渗透现象和渗透压2、理解渗透压在医学上的意义教学重点渗透现象和渗透压教学难点渗透现象和渗透压内容备注教学内容【引入新课】【讲授新课】【出示渗透现象示意图】渗透现象在生活中极为常见。
例如,人们在游泳池中游泳时,睁开眼睛很快就会感到涩痛,而在海水中游泳却没有不适之感,这是为什么呢?那么下面让我们带着这个问题一起来学习今天的内容。
一、渗透现象和渗透压渗透现象示意图1半透膜:只允许溶剂水分子自由透过,而溶质分子难以透过的薄膜。
一段时间之后便可看到长颈漏斗内液面慢慢升高,达到一定【论讨将红细胞分别放入三种不同浓度NaCl溶液中所产生的现象】在相同温度下,渗透压相等的两种溶液称为等渗溶液。
对于渗透压不同的两种溶液,渗透压相对高的溶液叫做高渗溶液,渗透压相对低的溶液叫做低渗溶液。
医学上的等渗、低渗、高渗溶液是以血浆总渗透压为标准。
临床上规定渗透浓度在280~320m mol/L范围内的溶液为等渗溶液、低于280 m mol/L的溶液为低渗溶液、高于320 m mol/L的溶液为高渗溶液。
2、临床上常用的等渗溶液有:0.154 mol/L NaCL溶液,(生理盐水)0.278 mol/L葡萄糖溶液,0.149 mol/L 碳酸氢钠溶液3、临床上给病人大量输液时,必须使用与血浆等渗的溶液(如生理盐水)。
红细胞分别放入三种不同浓度NaCl溶液中所产生的现象:将红细胞放到0.068 mol/L NaCl溶液中,在显微镜下可以看到红细胞逐渐膨胀,最后破裂。
医学上称这种现象为溶血。
如将红细胞放到0.256 mol/L NaCL溶液中,在显微镜下可以看到红细胞逐渐皱缩,这种现象称为胞浆分离.如将红细胞放到生理盐水中,在显微镜下看到红细胞维持原状.见图1-3.图1-3 红细胞在不同浓度NaCl溶液中的形态示意图。
《医用化学》课程标准所属系部:XXX学院适用专业:三年制临床医学课程类型:专业基础课课程学时:72学时第一章课程定位一、课程性质《医用化学》是一门文化课,又是一门重要的专业基础课,本课程的内容分为基础化学和有机化学两大部分。
是介绍与医学密切相关的基本概念,原理,包括溶液和电解质溶液,胶体化学与配位化学和有机物。
这些内容有些将在医学工作中直接应用如配制溶液,有些则是后续课程如生物化学的必要基础知识。
因此它是一门医学专业基础课。
本课程的教学任务是根据专业培养目标,讲授《医用化学》的基础理论和基本知识,训练学生的基本操作技能,为今后学习相关专业知识和技能奠定坚实的基础。
二、课程设计理念以培养学生的职业能力为根本,贯彻工学结合:以医学中的常规工作如配制溶液、测定PH值等为基础进行课程设计。
三、课程设计思路1.以职业岗位为导向调整教学内容。
2.以精讲与自学、课内与课外、教学与科研、传授知识与培养能力相结合的综合素质教育模式。
3.强化实践教学。
第二章课程目标通过本课程的学习,使学生对《医用化学》的基础理论和基本知识,尤其是对物质的结构和性质有较深入的认识和理解,并能够利用所学的知识分析和解决相关医学中的化学问题,理解和分析专业课程中涉及到的化学理论和相关知识。
并使学生具备以下知识结构和能力:一、能力目标1.能够运用所学化学知识对有关医学上的化学问题进行分析与评价的能力(能用溶液的渗透压、缓冲溶液的原理解释医学中常见的现象)。
2.能进行基本的化学实验操作(能配制一定浓度的溶液;能正确使用pH试纸测定溶液的pH值;能制备配合物并验证配合物的组成和性质)二、知识目标1.掌握医用化学中相关物质的化学组成、结构与性质。
2.掌握医用化学的基础理论和基本知识,并具有归纳与总结能力。
三、素质目标1.具有较强的自学和查阅相关资料的能力。
2.具有团结协作精神和一丝不苟的工作作风。
1第三章课程内容与要求一、教学内容与具体标准序号学习情境(课程单元)学习子情境(学习单元)职业能力标准知识能力课时1溶液溶液的浓度和配制掌握各种浓度的表示方法和配制方法及渗透压的原理能配制一定浓度的溶液;能利用渗透压的原理解释2溶液电解质溶液缓冲溶液的概念、组成性质能配制缓冲溶液会验证其性质自学能力、团结的作风3溶液胶体溶液熟悉胶体的概念、性质能进行医学现象的解释4配位化合物配合物的性质和组成熟悉配合物的概念、性质能制备配合物并验证配合物的组成和性质一丝不苟的工作作风5医学中常见的有机物有机物概述了解有机物的组成、命名能给简单的有机物进行命名自学和查阅资料的素质6医学中常见的有机物常见的有机物了解常见的有机物的名称及组成性质能指出医学中常见的有机物并解释常见的现象自学和查阅资料的素质二、教学进程及学时分配学习子情境(学习单元)学时学生任务教师任务教学素材(案例、项目、课件、设备、工具等)学生提交作业或作品(报告、计划、实施情况)考核方法教学地点绪论4查阅相关资料,理解医用化学的研究对象及主讲清医用化学研究对象及主要内容相关课件课堂提问现场考核多媒体教2要内容室溶液的浓度和配制4掌握溶液浓度的表示方法和配制方法、渗透压讲清浓度的表示方法和配制方法配制生理盐水和75﹪酒精以组为单位,上交配制好的溶液实验考核教室和实验室溶液的渗透压4掌握渗透现象产生的条件和渗透压的计算及在医学上的意义讲清渗透现象产生条件及渗透压计算及意义相关课件解析在临床上输液为什么用等渗透溶液及脑水肿的原理?课堂提问现场考核多媒体教室电解质溶液4掌握缓冲作用和缓冲溶液的概念及组成;原理讲清、演示缓冲作用的实验缓冲溶液的配制及性质验证完成该次实验报告课堂提问现场考核教室和实验室胶体溶液4查阅相关资料胶体的概念及性质;相关课件说明医学中胶体多媒体教室物质结构8掌握原子核外电子运动状态,核外电子排布规律,共价键的形成及特点,σ键和π键,杂化轨道理论讲解核外电子运动状态,核外电子排布规律,共价键的形成及特点,σ键和π键,杂化轨道理论能分辨σ键和π键,辨析化合物采用什么样的杂化方式成键完成课后作业课堂提问现场考核多媒体教室配位化合物8掌握配合物的概念和组成演示配合物的性质实验能给配合物命名能举例说明配合物及意义课堂提问现场考核教室和实验室3有机物概述8学会有机物的命名方法举例讲解有机物的命名有机物命名实例命名题作业多媒体教室医学中常见的有机物28查阅医学中常见的有机物的资料列出医学常见的有机物相关课件作业多媒体教室三、能力(技能)训练项目设计学习单元(子情境)拟实现的能力目标相关知识训练方式手段及步骤结果(可展示)溶液在医学中的应用1.识记溶胶的概念及性质,溶液渗透现象、渗透压的概念,酸碱质子理论和缓冲溶液的概念2.能够用溶胶、渗透压和缓冲溶液的的知识解释医学中的现象并应用于医学中3.能够配制医学常用的生理盐水和医用消毒酒精溶液的浓度的表示方法和计算公式教师演示、组织、启发、学生讨论和操作;教师通过口头、书面作业考核配制好的生理盐水和消毒酒精物质的结构1.掌握原子核外电子运动状态,核外电子排布规律;2.共价键的形成及特点,σ键和π键,杂化轨道理论3.能运用杂化轨道理论判断共价键的成键核外电子排布图及1-20号元素的核外电子排布教师演示、组织、启发、学生讨论和操作;教师通过口头、书面作业考核1-20号元素的核外电子排布配位化合物学会配合物的制备,试验配离子的稳定配合物的概念,螯合教师演示、组织、启发,学生操作;该次实验报告45第四部分课程实施一、教材选用采用全国全国高职高专院校教材《医用化学》第八版供临床医学专业用(陈常兴主编)即可。
任课教师:学科:《医用化学》教材版本:主编出版社:2015年8月31日教学重点:溶液的酸碱性和pH教学难点:溶液的酸碱性和pH。
学时分配:2学时教学方法:讲授法,举例法,讨论法,练习法辅助手段:主要运用多媒体教学教学内容:一、水的电离(15min)1、水是弱电解质,水的电离平衡:H2O = H+ + OH–实验测得:在22度时,纯水中氢离子和氢氧根离子的浓度各等于10-72、水的离子积:在一定温度下,水中氢离子和氢氧根离子的浓度的乘积是一个常数,称为水的离子积常数,简称水的离子积。
水的离子积常数K W =[H+ ] [OH -]= 10-14二、溶液的酸碱性(55min)(一)中性溶液:[H+]= [OH-]= 10-7mol/L酸性溶液:[H+]> 10-7mol/L > [OH -]碱性溶液:[OH -]> 10-7mol/L >[H+](二)pH=-log[H+]三、溶液的PH值溶液的酸碱性与pH的关系中性溶液 pH=7酸性溶液 pH﹤7碱性溶液 pH﹥7三、pH在医学和生物学上的重要意义(10min)1、控制土壤的PH值可使植物生长的更好。
2、正常人体血液中的PH为,临床上把PH小于称为酸中毒,PH大于称为碱中毒。
PH变动范围为,PH低于时,就会引发多种疾病,如糖尿病、痛风、癌症等。
四、酸碱指示剂1、酸碱指示剂的概念:在不同PH溶液中能显示不同颜色的化合物。
2、在酸性溶液中加入石蕊指示剂,溶液变红色;在碱性溶液中加入石蕊指示剂,溶液变蓝色。
在碱性溶液中加入酚酞指示剂,溶液变红色。
小结:1、无论是中性、酸性、碱性溶液中,都同时含有H +和OH -,而且[H +][OH -]= 10-14。
[H +]越大,[OH -]越小,酸性越强;[OH -]越大,[H +]越小,碱性越强。
2、pH越小,酸性越强;pH越大,碱性越强。
复习思考题:1、 P36 问题4-72、溶液的pH相差三个单位,[H+]相差多少倍?。