第一类医疗器械备案 共30页
- 格式:ppt
- 大小:174.00 KB
- 文档页数:30

第一类医疗器械备案资料医疗器械备案是指根据国家相关法律法规的规定,对医疗器械的生产、销售和使用进行备案登记的行为。
医疗器械备案资料分为第一类医疗器械备案资料和第二、三类医疗器械备案资料。
本文将详细介绍第一类医疗器械备案资料的内容和要求。
第一类医疗器械是指对人体体表或体腔进行非侵入性的观察、检测、诊断、治疗和护理的医疗器械,如体温计、血压计、血糖仪等。
第一类医疗器械备案资料是企业根据相关法规和规范要求,向国家食品药品监督管理局提交的备案资料,以获得医疗器械备案的合法权益。
1.企业基本情况:包括企业名称、注册地址、法定代表人等基本信息。
2.产品基本信息:包括产品名称、规格型号、生产厂家、产品适用范围等。
3.产品质量管理体系:包括企业的质量管理体系文件、质量手册等。
4.产品生产工艺与工艺控制:包括产品生产工艺流程、原材料的选用与检验等。
5.产品检测与检验:包括产品研发过程中的检测与检验结果,以及产品出厂检验报告等。
6.产品临床试验:如果产品需要进行临床试验,需要提交临床试验机构的资质证明、试验结果报告等。
8.产品注册证或者产品备案证明文件:如果产品已经获得其他国家或地区的注册证或备案证明,需要提供相应的证明文件。
9.产品检验报告:包括产品的物理性能、生物相容性、安全性、有效性等检验结果。
10.产品经营许可证明文件:如果产品需要获得特殊的经营许可证明,需要提供证明文件。
除上述内容外,第一类医疗器械备案资料还需要根据具体产品的特性和相关法规的要求,提供其他相应资料,如电子产品的电磁兼容性测试报告、放射性产品的辐射卫生安全证书等。
需要注意的是,第一类医疗器械备案资料的编制需要遵守相关法律法规和规范要求,确保资料的真实、准确、完整和合规。
企业在备案过程中应严格按照规定的内容和格式进行资料的整理和提交。
医疗器械备案是保障医疗器械质量和安全的重要环节,只有通过备案,才能合法生产、销售和使用医疗器械。
企业在备案过程中要认真准备相关的资料,确保申报顺利进行,以获得合法的备案证明,为产品的质量和安全提供保障。

第一类医疗器械备案清单第一类医疗器械是指用于人体预防、诊断、治疗或者对疾病起作用,但不对人体构成器质性结构性改变的器械。
这类器械的备案管理是指在相关主管部门的监管下,对其进行备案登记,以确保其安全有效地使用。
下面是一些常见的第一类医疗器械备案清单:1.血压计:血压计是一种测量人体血压值的器械,常见的有听诊型血压计、半自动血压计和全自动血压计等。
2.心电图机:心电图机是一种用于检测人体心电活动的器械,通过记录心脏电位变化来评估心脏健康状况。
3.眼底相机:眼底相机是一种用于拍摄人眼底图像的器械,可以帮助医生检测眼部疾病,如青光眼、视网膜病变等。
4.糖尿病血糖仪:糖尿病血糖仪是一种用于测量血糖水平的器械,患者可以通过采集血液样本,用血糖仪进行测量并得到结果。
5.荧光显微镜:荧光显微镜是一种用于观察细胞和组织结构的器械,通过荧光染料或荧光标记物来增强显微镜图像。
6.输液泵:输液泵是一种用于精确输液的器械,通过控制液体流速和输液量,以确保药物或液体的准确输送。
7.器官透视机:器官透视机是一种用于放射性医学诊断的器械,通过透视的方式观察人体内部器官的形态和功能。
8.细菌培养箱:细菌培养箱是一种用于培养和繁殖细菌的器械,常用于微生物学实验室和临床实验。
9.电子胃镜:电子胃镜是一种用于内窥镜下检查胃部疾病的器械,通过引入光源和摄像机,医生可以观察到胃内的病变。
10.高频电刀:高频电刀是一种用于手术切割和止血的器械,通过高频电流产生高温切割组织并同时止血。
以上是一些常见的第一类医疗器械备案清单,备案登记可以确保医疗器械的安全使用和市场监管。
但需要注意的是,具体的备案要求和程序可能因不同地区、不同国家法规而有所不同,相关生产企业和经销商应根据实际情况进行备案登记。


第一类医疗器械备案资料一类医疗器械经营备案资
料
第一类医疗器械备案资料通常包括以下内容:
1. 产品说明书:包括器械名称、规格型号、主要组成成分、适用范围、性能指标等详细信息;
2. 产品注册证明文件:包括器械注册证书、批准文件等;
3. 技术评价报告:包括技术性能评价、临床试验报告等;
4. 质量管理体系文件:包括生产质量管理规范、质量保证文件等;
5. 生产许可证明文件:包括生产许可证、生产场所卫生安全证明等;
6. 销售许可证明文件:包括销售许可证、经营场所卫生安全证明等;
7. 进口医疗器械备案证明文件:包括进口备案证明、进口合同等。
而第一类医疗器械经营备案资料通常包括以下内容:
1. 经营者基本信息:包括经营者名称、注册地址、联系电话等;
2. 经营场所信息:包括经营场所名称、营业执照、场所面积等;
3. 经营范围:包括经营的医疗器械类别、名称、规格等;
4. 质量管理体系文件:包括质量管理规范、质量保证文件等;
5. 经营许可证明文件:包括经营许可证、经营场所卫生安全证明等;
6. 员工资质证明:包括员工的相关培训、职称证书等。
需注意,具体备案资料要根据相关法规和监管部门要求来确定。

第一类医疗器械生产备案表一、引言随着医疗技术的快速发展和公众对健康需求的不断提高,医疗器械的生产和使用已成为社会的重要议题。
第一类医疗器械作为医疗器械的重要组成部分,其生产和使用的管理显得尤为重要。
本文将详细解读第一类医疗器械生产备案表的相关内容。
二、第一类医疗器械生产备案表概述第一类医疗器械是指通过常规控制能够确保安全性和有效性的医疗器械,如普通诊察器械、物理治疗器械等。
根据《医疗器械监督管理条例》规定,从事第一类医疗器械生产的单位必须向食品药品监督管理部门提交第一类医疗器械生产备案表,方可从事生产活动。
三、第一类医疗器械生产备案表主要内容第一类医疗器械生产备案表主要包括以下内容:1、生产单位基本信息:包括单位名称、统一社会信用代码、住所、法定代表人、生产等。
2、生产产品信息:包括产品名称、注册证编号、规格型号、生产批量、生产工艺流程等。
3、原材料采购信息:包括主要原材料的种类、供应商、进货渠道等。
4、质量控制信息:包括质量控制标准、检验设备及人员资质、产品检验报告等。
5、销售及售后服务信息:包括销售渠道、售后服务承诺等。
四、第一类医疗器械生产备案表的填报注意事项在填报第一类医疗器械生产备案表时,需要注意以下几点:1、确保填写的信息真实、准确、完整,不得虚报、瞒报。
2、对于生产过程中的关键环节和质量控制点,应详细描述并附上相关证明材料。
3、对于涉及到的技术参数和性能指标,应严格按照相关标准填写。
4、提交的资料应当清晰明了,易于查阅和理解。
五、总结第一类医疗器械生产备案表是保证第一类医疗器械安全性和有效性的重要文件,也是监管部门对生产单位实施监督管理的依据。
各生产单位应认真填写备案表,遵守相关法规,确保医疗器械的质量和安全,为公众的健康提供有力保障。
监管部门也应加强对第一类医疗器械生产的监管力度,确保备案制度的落实和执行。
第一类医疗器械备案信息表一、概述第一类医疗器械备案信息表是用于记录和展示第一类医疗器械备案信息的表格。

关于第一类医疗器械备案有关事项的解答●第一类医疗器械备案●医疗器械备案是指食品药品监督管理部门对医疗器械备案人(以下简称备案人)提交的第一类医疗器械备案资料存档备查。
1.备案不同于许可。
备案是指向主管机关报告事由存案以备查考。
2.备案并不意味着门槛降低。
提交的资料是没有任何差异的,第一类医疗器械的备案主要是通过备案存档信息收集,并开展后续监督检查。
●实行备案的医疗器械为第一类医疗器械产品目录和相应体外诊断试剂分类子目录中的第一类医疗器械。
1.原来界定的第一类产品作废(除体外诊断试剂)。
对于本目录中未包含的产品,按照《医疗器械监督管理条例》(国务院令第650号)第十六条的规定执行。
●境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料。
进口第一类医疗器械备案,备案人向国家食品药品监督管理总局提交备案资料。
香港、澳门、台湾地区医疗器械的备案,参照进口医疗器械办理。
明确备案机关1. 境内→备案人注册地址的所在地设区的市级人民政府食品药品监督管理部门2.境外→国家局。
●办理备案的进口医疗器械,应当在备案人注册地或者生产地址所在国家(地区)获得医疗器械上市许可。
●备案人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,备案人需提供相关证明文件,包括备案人注册地或者生产地址所在国家(地区)准许该产品合法上市销售的证明文件。
对进口医疗器械的要求1.所在国家或者地区合法上市销售的(获得医疗器械上市许可、合法上市销售的证明文件)。
●境外备案人办理进口医疗器械备案,应当通过其在中国境内设立的代表机构或者指定中国境内的企业法人作为代理人办理。
1.境外企业不能直接提出备案,需指定代理人。
2.该代理人可以是备案人在中国境内设立的代表机构,可以是指定中国境内的企业法人,需要承担相应的责任。
3.代表机构是指外国企业依照本条例规定,在中国境内设立的从事与该外国企业业务有关的非营利性活动的办事机构。

第一类医疗器械备案资料要求及说明一、备案资料(一)第一类医疗器械备案表(二)安全风险分析报告医疗器械应按照YY 0316《医疗器械风险管理对医疗器械的应用》的有关要求编制,主要包括医疗器械预期用途和与安全性有关特征的判定、危害的判定、估计每个危害处境的风险;对每个已判定的危害处境,评价和决定是否需要降低风险;风险控制措施的实施和验证结果,必要时应引用检测和评价性报告;任何一个或多个剩余风险的可接受性评定等,形成风险管理报告。
体外诊断试剂应对产品寿命周期的各个环节,从预期用途、可能的使用错误、与安全性有关的特征、已知和可预见的危害等方面的判定及对患者风险的估计进行风险分析、风险评价及相应的风险控制的基础上,形成风险管理报告。
(三)产品技术要求产品技术要求应按照《医疗器械产品技术要求编写指导原则》编制。
(四)产品检验报告产品检验报告应为产品全性能自检报告或委托检验报告,检验的产品应当具有典型性。
(五)临床评价资料1. 详述产品预期用途,包括产品所提供的功能,并可描述其适用的医疗阶段(如治疗后的监测、康复等),目标用户及其操作该产品应具备的技能/知识/培训;预期与其组合使用的器械。
2. 详述产品预期使用环境,包括该产品预期使用的地点如医院、医疗/临床实验室、救护车、家庭等,以及可能会影响其安全性和有效性的环境条件(如温度、湿度、功率、压力、移动等)。
3. 详述产品适用人群,包括目标患者人群的信息(如成人、儿童或新生儿),患者选择标准的信息,以及使用过程中需要监测的参数、考虑的因素。
4. 详述产品禁忌症,如适用,应明确说明该器械禁止使用的疾病或情况。
5. 已上市同类产品临床使用情况的比对说明。
6. 同类产品不良事件情况说明。
(六)产品说明书及最小销售单元标签设计样稿医疗器械应符合相应法规规定。
进口医疗器械产品应提交境外政府主管部门批准或者认可的说明书原文及其中文译本。
体外诊断试剂产品应按照《体外诊断试剂说明书编写指导原则》的有关要求,并参考有关技术指导原则编写产品说明书。

第一类医疗器械备案常识一、问:什么是医疗器械?答:医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:(一)疾病的诊断、预防、监护、治疗或者缓解;(二)损伤的诊断、监护、治疗、缓解或者功能补偿;(三)生理结构或者生理过程的检验、替代、调节或者支持;(四)生命的支持或者维持;(五)妊娠控制;(六)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
二、问:医疗器械产品如何区分一类、二类、三类?答:国家对医疗器械按照风险程度实行分类管理。
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
比如手术刀、棉签、医用X射线胶片等。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
比如超声洁牙机、一次性使用医用口罩、红外额温计等。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
比如X射线计算机断层成像系统(CT)、医用磁共振成像系统(MRI)、血管支架等。
三、问:什么是第一类医疗器械备案?答:第一类医疗器械备案是指药品监督管理部门对医疗器械备案人(以下简称备案人)提交的第一类医疗器械备案资料存档备查。
四、问:第一类医疗器械备案的范围包括哪些?答:实行备案的包括第一类医疗器械产品目录和相应体外诊断试剂分类子目录中的第一类医疗器械。
五、问:第一类医疗器械备案资料向哪些部门提交?答:境内第一类医疗器械备案,备案人向设区的市级药品监督管理部门提交备案资料。
进口第一类医疗器械备案,备案人向国家药监局提交备案资料。
香港、澳门、台湾地区医疗器械的备案,参照进口医疗器械办理。
六、问:第一类医疗器械需要编制产品技术要求吗?答:备案人应当编制拟备案医疗器械的产品技术要求。

第一类医疗器械备案资料要求及说明第一类医疗器械备案是指符合国家监管要求并取得医疗器械注册证的医疗器械,在投入市场前需要进行备案。
备案是为了确保医疗器械的质量和安全性,保障患者的身体健康和生命安全。
下面是第一类医疗器械备案资料要求及说明。
1.申请材料要求:(1)医疗器械备案申请表。
包括申请人基本信息、产品信息、注册证信息等。
(2)医疗器械注册证复印件。
(4)产品质量管理体系文件。
包括产品质量标准、质量控制程序、生产检验记录等。
(5)产品生产许可证复印件。
(6)产品检验报告。
包括产品性能、安全性、有效性等方面的检验结果。
(7)其他相关资料。
2.资料要求及说明:(1)医疗器械备案申请表。
需要详细填写各项信息,确保准确性和完整性。
(2)医疗器械注册证复印件。
复印件必须清晰,包含完整的注册证内容,确保备案与注册证一致。
(4)产品质量管理体系文件。
包括产品的质量标准、质量控制程序、生产检验记录等。
这些文件能证明产品的质量管理体系健全、有效,并能提供产品质量的可追溯性。
(5)产品生产许可证复印件。
复印件要清晰,包含完整的生产许可证内容,能证明申请人具有生产该医疗器械的资质。
(6)产品检验报告。
包括产品性能、安全性、有效性等方面的检验结果。
检验报告要由合格的医疗器械检验机构出具,内容要真实有效。
(7)其他相关资料。
根据实际情况提供其他相关资料,如质量事故报告、召回证明等。
3.备案流程:(1)提交备案申请材料。
(2)备案机构审核。
对提交的申请材料进行审核,确认材料完整性和真实性。
(3)备案机构现场核查。
对申请人的生产、质量管理体系进行现场核查,确保申请人符合备案条件。
(4)备案机构评审。
对备案申请材料进行评审,评估申请人的产品质量和安全性。
(5)备案机构出具备案证书。
如果申请符合要求,备案机构会出具备案证书,确认该医疗器械已备案成功。
(6)备案机构监督。
备案机构定期进行备案产品的监督检查,确保产品质量和安全。
第一类医疗器械备案是重要的监管措施,对确保医疗器械的质量和安全具有重要意义。

第一类医疗器械备案凭证
瑞海博医疗科技南通有限公司:
根据相关法规要求,对你单位第一类医疗器械:上肢综合训练器予以备案,备案号:苏通械备20190025号。
南通市行政审批局
(盖章)
日期:2019年9月29日
第一类医疗器械备案信息表
备案号:苏通械备20190025号
第一类医疗器械备案凭证
南通罗伯特医疗科技有限公司:
根据相关法规要求,对你单位第一类医疗器械:下颌骨牵引装置予以备案,备案号:苏通械备20190014号。
南通市行政审批局
(盖章)
日期:2019年9月27日
第一类医疗器械备案信息表
备案号:苏通械备20190014号
第一类医疗器械备案凭证
如皋市恒康医疗器材有限公司:
根据相关法规要求,对你单位第一类医疗器械:引流袋予以备案,备案号:苏通械备20170047号。
南通市行政审批局
(盖章)
日期:2019年10月8日
第一类医疗器械备案信息表
备案号:苏通械备20170047号。
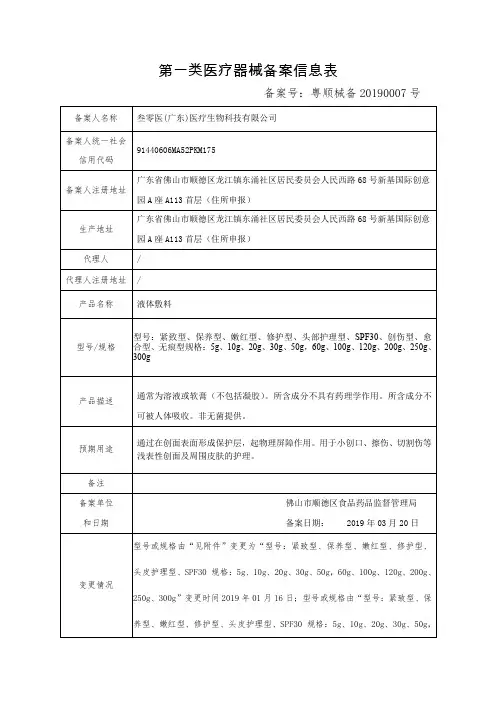
第一类医疗器械备案信息表备案号:粤顺械备20190007号备案人名称叁零医(广东)医疗生物科技有限公司备案人统一社会信用代码91440606MA52PKM175备案人注册地址广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)生产地址广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)代理人/代理人注册地址/产品名称液体敷料型号/规格型号:紧致型、保养型、嫩红型、修护型、头部护理型、SPF30、创伤型、愈合型、无痕型规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g产品描述通常为溶液或软膏(不包括凝胶)。
所含成分不具有药理学作用。
所含成分不可被人体吸收。
非无菌提供。
预期用途通过在创面表面形成保护层,起物理屏障作用。
用于小创口、擦伤、切割伤等浅表性创面及周围皮肤的护理。
备注备案单位和日期佛山市顺德区食品药品监督管理局备案日期: 2019年03月20日变更情况型号或规格由“见附件”变更为“型号:紧致型、保养型、嫩红型、修护型、头皮护理型、SPF30 规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”变更时间2019年01月16日;型号或规格由“型号:紧致型、保养型、嫩红型、修护型、头皮护理型、SPF30 规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”变更为“型号:紧致型、保养型、嫩红型、修护型、头部护理型、SPF30、创伤型、愈合型、无痕型规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”。
一类医疗器械备案整理版医疗器械备案是指根据相关法律法规和政府部门的要求,将医疗器械产品的生产、经营、使用等信息进行登记备案的行为。
医疗器械备案是确保医疗器械产品质量与安全的重要措施,同时也是保护消费者权益的必要手段。
根据医疗器械管理条例的规定,医疗器械备案分为两类:一类医疗器械备案和二类医疗器械备案。
一类医疗器械备案主要是指一些低风险的医疗器械,例如普通口罩、医用棉签、体温计等。
以下是一类医疗器械备案的整理版:1.普通口罩:普通口罩是一类医疗器械,用于阻挡飞沫、呼吸道分泌物等对呼吸道的物理性防护。
在备案时需要提供厂家名称、产品名称、产品型号、主要技术指标等信息。
2.医用棉签:医用棉签是一类常见的医疗器械,用于擦拭伤口、清洁器械等。
在备案时需要提供厂家名称、产品名称、产品规格、主要材料、灭菌方式等信息。
3.体温计:体温计是一类常用的医疗器械,用于测量人体的体温。
在备案时需要提供厂家名称、产品名称、产品型号、测量范围、精度等信息。
4.医用胶布:医用胶布是一类贴合肌肤的医疗器械,用于固定伤口敷料、固定导管等。
在备案时需要提供厂家名称、产品名称、产品规格、主要材料、适用范围等信息。
5.医用消毒棉球:医用消毒棉球是一类用于消毒的医疗器械,用于擦拭皮肤、消毒伤口等。
在备案时需要提供厂家名称、产品名称、产品规格、主要材料、灭菌方式等信息。
以上只是一类医疗器械备案中的几个例子,一类医疗器械备案还包括各类医用敷料、医用冷敷贴、一次性使用注射器等。
这些产品通常具有较低的风险,但也需要进行备案,以确保其质量安全和合法经营。
医疗器械备案的目的是加强医疗器械的监管,保障公众的健康和安全。
通过备案,可以确保医疗器械产品符合国家标准和技术规范的要求,提高产品的质量和安全性。
同时,备案也方便了政府监管部门对医疗器械市场的监管,加强对不合法经营和不合格产品的打击,保护消费者的权益。
总之,一类医疗器械备案是保障医疗器械产品质量和安全的重要环节,通过备案可以确保医疗器械的质量合格,提升公众健康水平。
2024第一类医疗器械产品目录2024年第一类医疗器械产品目录(备案制)是中国国家药监局发布的一份包含各类医疗器械产品的目录,用于管理和监督医疗器械市场。
本文将对该目录进行详细介绍。
首先,第一类医疗器械是指使用于人体皮肤或者黏膜表面,不贯通体腔,无创伤性的医疗器械产品。
它们被广泛应用于医疗和日常保健领域,如创可贴、口罩、一次性手套等。
这些产品多数属于低风险产品,但仍然需要严格管理和监督,以确保其质量和安全性能。
目录中包含了各类不同的第一类医疗器械产品。
其中,最常见的是敷料类产品,如创可贴、伤口敷料、防水敷料等。
这些产品主要用于创伤的包扎和保护,以促进伤口的愈合。
此外,还有一次性手术和检查用品,如手术帽、手术衣、一次性注射器、一次性手套等。
这些产品主要用于医院和诊所,用于医疗操作和病患护理。
此外,还有口腔护理用品,如牙刷、牙膏、漱口水等。
这些产品用于日常口腔保健,预防龋齿和口腔疾病的发生。
另外,目录中还包含了一些特殊用途的第一类医疗器械产品,如眼罩、耳塞、眼药水等。
备案制是指厂商在向国家药监局备案后,就可以正式销售和推广该医疗器械产品。
备案要求厂商提供与该产品相关的技术资料和质量证明文件,以证明产品的质量和性能符合规定。
备案后,厂商需要定期向药监局提交产品销售和安全监测的报告,以保证产品的质量和安全性能。
备案制的实施对医疗器械市场起到了积极的作用。
一方面,它提高了医疗器械产品的质量和安全性能,因为厂商需要提供相应的质量证明文件和技术资料。
另一方面,备案制也增加了管理和监督的难度,对于那些不合规的厂商和产品,可以进行及时的追踪和处理。
综上所述,2024年第一类医疗器械产品目录(备案制)是中国药监局发布的一份重要文件,用于管理和监督医疗器械市场。
该目录包含了各类第一类医疗器械产品,对其进行备案制管理。
备案制提高了产品的质量和安全性能,同时也增加了管理和监督的难度。
这一制度有助于保障医疗器械市场的稳定和有序发展。
附件1第一类医疗器械备案资料要求及说明一、备案资料(一)第一类医疗器械备案表(二)安全风险分析报告医疗器械应按照YY 0316《医疗器械风险管理对医疗器械的应用》的有关要求编制,主要包括医疗器械预期用途和与安全性有关特征的判定、危害的判定、估计每个危害处境的风险;对每个已判定的危害处境,评价和决定是否需要降低风险;风险控制措施的实施和验证结果,必要时应引用检测和评价性报告;任何一个或多个剩余风险的可接受性评定等,形成风险管理报告。
体外诊断试剂应对产品寿命周期的各个环节,从预期用途、可能的使用错误、与安全性有关的特征、已知和可预见的危害等方面的判定及对患者风险的估计进行风险分析、风险评价及相应的风险控制的基础上,形成风险管理报告。
(三)产品技术要求产品技术要求应按照《医疗器械产品技术要求编写指导原则》编制。
(四)产品检验报告产品检验报告应为产品全性能自检报告或委托检验报告,检验的产品应当具有典型性。
(五)临床评价资料1. 详述产品预期用途,包括产品所提供的功能,并可描述其适用的医疗阶段(如治疗后的监测、康复等),目标用户及其操作该产品应具备的技能/知识/培训;预期与其组合使用的器械。
2. 详述产品预期使用环境,包括该产品预期使用的地点如医院、医疗/临床实验室、救护车、家庭等,以及可能会影响其安全性和有效性的环境条件(如温度、湿度、功率、压力、移动等)。
3. 详述产品适用人群,包括目标患者人群的信息(如成人、儿童或新生儿),患者选择标准的信息,以及使用过程中需要监测的参数、考虑的因素。
4. 详述产品禁忌症,如适用,应明确说明该器械禁止使用的疾病或情况。
5. 已上市同类产品临床使用情况的比对说明。
6. 同类产品不良事件情况说明。
(六)产品说明书及最小销售单元标签设计样稿医疗器械应符合相应法规规定。
进口医疗器械产品应提交境外政府主管部门批准或者认可的说明书原文及其中文译本。
体外诊断试剂产品应按照《体外诊断试剂说明书编写指导原则》的有关要求,并参考有关技术指导原则编写产品说明书。
第一类医疗器械备案凭证陕西文锐医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:穴位医用冷敷贴予以备案,备案号:陕械备20180001号。
西咸新区市场服务与监督管理局(盖章)日期:2018年05月19日第一类医疗器械备案信息表备案号:陕械备20180001号备案人名称:陕西文锐医疗器械有限公司备案人组织机构代码 :91611104059664557F备案人注册地址 :陕西省西咸新区沣东新城三桥新街236号嘉宝星城国际11403号生产地址:陕西省西咸新区沣东新城三桥新街236号连腾地产办公大楼一楼代理人:/代理人注册地址:/产品名称:穴位医用冷敷贴型号/规格:寒/热腹泻型、肠炎型、寒/热咳嗽、清火型、寒/热感冒型、健胃消食型、晕车型、痔疮型、咽炎型、失眠型;80mm*80mm、70mm*70mm;特殊尺寸根据客户要求产品描述:由无纺布背衬层、凝胶层、聚乙烯薄膜覆盖层等部分组成。
预期用途:用于人体穴位的冷敷理疗。
适用于痔疮、寒/热腹泻、肠炎、寒/热咳嗽、寒/热感冒、积食、晕车、失眠、咽炎等的辅助治疗。
仅用于闭合性软组织。
备注:备案单位和日期:西咸新区市场服务与监督管理局备案日期:2018年05月19日变更情况:第一类医疗器械备案凭证陕西文锐医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:胆康医用冷敷贴予以备案,备案号:陕西械备20180002号。
西咸新区市场服务与监督管理局(盖章)日期:2018年05月22日第一类医疗器械备案信息表备案号:陕西械备20180002号备案人名称:陕西文锐医疗器械有限公司备案人组织机构代码 :91611104059664557F备案人注册地址 :陕西省西咸新区沣东新城三桥新街236号嘉宝星城国际11403号生产地址:陕西省西咸新区沣东新城三桥新街236号连腾地产办公大楼一楼代理人:/代理人注册地址:/产品名称:胆康医用冷敷贴型号/规格:胆囊炎型、胆结石型;80mm*80mm、70mm*70mm、特殊尺寸根据客户要求。
关于实施第一类医疗器械备案有关事项的通知各省、自治区、直辖市食品药品监督管理局:为做好第一类医疗器械备案工作,根据总局《关于第一类医疗器械备案有关事项的公告》(2014 年第 26 号,以下简称 26 号公告)、《关于发布第一类医疗器械产品目录的通告》(2014 年第 8 号)的有关规定,现就 有关事项通知如下:一、关于第一类医疗器械备案产品范围 列入第一类医疗器械产品目录的医疗器械及体外诊断试剂分类子目录中的第一类体外诊断试剂,或经分类 界定属于第一类医疗器械产品的,均应按 26 号公告的规定进行产品备案。
二、关于第一类医疗器械备案形式审查中应注意的问题 26 号公告明确规定了第一类医疗器械备案资料的要求、备案操作规范等内容,承担备案的食品药品监督管 理部门应按照备案资料形式审查的要求和备案操作规范的程序进行形式审查。
在形式审查中对第一类医疗器械 产品目录及体外诊断试剂分类子目录的使用,应注意以下问题:(一)关于第一类医疗器械产品目录的品名举例、产品描述和预期用途等相关内容 1.实施备案的医疗器械, 应首先根据其“产品描述”和“预期用途”的实际情况, 通过与目录中“产品描述”和“预 期用途”的内容综合判定产品的归属类别,包括所属子目录、一级及二级类别。
2.根据所属类别, 应直接使用目录中“品名举例”所列举的名称, “预期用途”的基本内容应与目录中的相应内1 / 12容一致,通常情况下对产品进行具体描述的,不应超出目录中“产品描述”相关内容的范围。
(二)关于目录中“除外”的和不属于第一类产品的情形 1.目录中有“除外”和特别注明的情形。
如 6820、 6822 中, “检查用光源”和“医用放大器具”类别项下明确“LE D 光源除外”, 是指这两个类别的产品如使用 LED 光源则不属于第一类医疗器械产品; “产品描述”中特别注明“无 源产品”、“手动”等,是对该类别下属于第一类产品的限定。
对于上述情形,企业在备案的产品描述中应予以说 明。