pH法测定乙酸的电离平衡常数
- 格式:ppt
- 大小:159.50 KB
- 文档页数:11

ph法测定醋酸电离常数实验报告实验目的:本实验旨在通过ph法测定醋酸电离常数,并掌握ph计的使用方法。
实验原理:醋酸是一种弱酸,其电离方程式为CH3COOH ⇌ CH3COO- + H+。
根据化学反应平衡常数的定义,有Kc=[CH3COO-][H+]/[CH3COOH]。
由于醋酸是弱酸,其电离程度较小,故可近似认为[H+]≈[CH3COO-]。
因此,Kc=[H+]^2/[CH3COOH]。
在水溶液中,pH值表示[H+]的负对数。
因此,Kc也可用pH来表示。
有pKa=-logKa=-log([H+][CH3COOH]/[CH3COO-])=pH-log([CH3COOH]/[CH3COO-])。
当溶液中[H+]=[A-]时,称为弱酸或弱碱的等摩尔点。
此时有pH=pKa。
实验步骤:1. 取一定量的已知浓度的NaOH溶液,在烧杯中加入适量去离子水稀释成所需浓度。
2. 将一定量的已知浓度的醋酸溶液加入到干净的烧杯中,并加入适量的酚酞指示剂。
3. 将NaOH溶液倒入醋酸溶液中,同时用磁力搅拌器搅拌,直到溶液颜色由红色变为淡粉色。
4. 记录NaOH溶液的体积V1和消耗的时间t1。
5. 重复以上步骤,取不同体积的NaOH溶液进行滴定,记录数据。
实验数据处理:根据NaOH与醋酸的反应方程式,有n(NaOH) = n(CH3COOH)。
因此,可得CH3COOH的摩尔浓度为n(CH3COOH)/V(CH3COOH) = n(NaOH)/V(NaOH)*C(NaOH)/C(CH3COOH)。
根据pH计测得的pH值和pKa值,可求得[H+]和[CH3COO-]浓度。
由于[H+]≈[CH3COO-],故Kc=[H+]^2/[CH3COOH] ≈[H+][CH3COO-]/[CH3COOH] = C(H+)/C(CH3COOH)。
实验结果:通过实验数据计算得到Kc值为1.8×10^-5。
结论:本实验通过ph法测定了醋酸电离常数,并掌握了ph计使用方法。
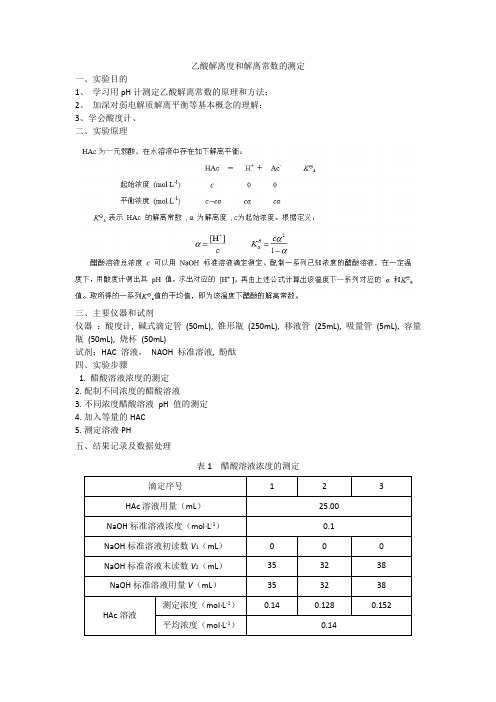
乙酸解离度和解离常数的测定
一、实验目的
1、学习用pH计测定乙酸解离常数的原理和方法;
2、加深对弱电解质解离平衡等基本概念的理解;
3、学会酸度计、
二、实验原理
三、主要仪器和试剂
仪器:酸度计, 碱式滴定管(50mL), 锥形瓶(250mL), 移液管(25mL), 吸量管(5mL), 容量瓶(50mL), 烧杯(50mL)
试剂:HAC 溶液,NAOH 标准溶液, 酚酞
四、实验步骤
1. 醋酸溶液浓度的测定
2.配制不同浓度的醋酸溶液
3.不同浓度醋酸溶液pH 值的测定
4.加入等量的HAC
5.测定溶液PH
五、结果记录及数据处理
表1 醋酸溶液浓度的测定
当加入等量的HAC后测定的溶液的PH值就是醋酸的电离平衡常数:如图:
取平均值后得:3.60
得:电离平衡常数3.60
推导式:
、六、实验误差分析:
1.仪器的洗涤不干净。
2.数据的读数不准确。
3.计算的误差。

实验三 醋酸电离度和电离平衡常数的测定一、实验目的1.测定醋酸的电离度和电离平衡常数。
2.学会正确地使用pH 计。
3.练习和巩固容量瓶、移液管、滴定管等仪器的基本操作。
二、实验原理醋酸CH 3COOH(简写为HAc)是一元弱酸,在溶液中存在下列电离平衡:2HAc(aq)+H O(l) +-3H O (aq)+Ac (aq)忽略水的电离,其电离常数:首先,一元弱酸的浓度是已知的,其次在一定温度下,通过测定弱酸的pH 值,由pH = -lg[H 3O +], 可计算出其中的[H 3O +]。
对于一元弱酸,当c /K a ≥500时,存在下列关系式:+3[H O ]cα≈+23a [H O ]K c = 由此可计算出醋酸在不同浓度时的解离度(α)和醋酸的电离平衡常数(a K )。
或者也可由2a K c α=计算出弱酸的解离常数(a K )。
三、仪器和试药仪器:移液管、吸量管、容量瓶、碱式滴定管、锥形瓶、烧杯、量筒、pHS-3C 型酸度计。
试药:冰醋酸(或醋酸)、NaOH 标准溶液(0.1mol·L -1)、标准缓冲溶液(pH = 6.86, 4.00) 酚酞溶液(1%)。
四、实验内容1.配置250mL 浓度为0.1mol·L -1的醋酸溶液 用量筒量取4mL 36%(约6.2 mol·L -1)的醋酸溶液置于烧杯中,加入250mL 蒸馏水稀释,混匀即得250mL 浓度约为0.1mol·L -1的醋酸溶液,将其储存于试剂瓶中备用。
2.醋酸溶液的标定用移液管准确移取25.00mL 醋酸溶液(V 1)于锥型瓶中,加入1滴酚酞指示剂,用标准NaOH 溶液(c 2)滴定,边滴边摇,待溶液呈浅红色,且半分钟内不褪色即为终点。
由滴定管读出所消耗的NaOH 溶液的体积V 2,根据公式c 1V 1 = c 2V 2计算出醋酸溶液的浓度c 1。
平行做三份,计算出醋酸溶液浓度的平均值。

乙酸解离度和解离常数的测定
一、实验目的
1、学习用pH计测定乙酸解离常数的原理和方法;
2、加深对弱电解质解离平衡等基本概念的理解;
3、学会酸度计、
二、实验原理
三、主要仪器和试剂
仪器:酸度计, 碱式滴定管 (50mL), 锥形瓶 (250mL), 移液管 (25mL), 吸量管 (5mL), 容量瓶 (50mL), 烧杯 (50mL)
试剂:HAC 溶液, NAOH 标准溶液, 酚酞
四、实验步骤
1. 醋酸溶液浓度的测定
2.配制不同浓度的醋酸溶液
3.不同浓度醋酸溶液 pH 值的测定
4.加入等量的HAC
5.测定溶液PH
五、结果记录及数据处理
表1 醋酸溶液浓度的测定
滴定序号
1
23 HAc溶液用量(mL)25.00
NaOH标准溶液浓度(mol×L-1)0.1
NaOH标准溶液初读数V1(mL)000
NaOH标准溶液末读数V2(mL)353238
NaOH标准溶液用量V(mL)353238 HAc溶液
测定浓度(mol×L-1)0.140.1280.152
平均浓度(mol×L-1)0.14
相对平均偏差
当加入等量的HAC后测定的溶液的PH值就是醋酸的电离平衡常数:如图:
取平均值后得:3.60
得:电离平衡常数3.60
推导式:
、六、实验误差分析:
1.仪器的洗涤不干净。
2.数据的读数不准确。
3.计算的误差。
友情提示:本资料代表个人观点,如有帮助请下载,谢谢您的浏览!。

⼄酸解离度和解离常数的测定实验报告
⼄酸解离度和解离常数的测定
⼀、实验⽬的
1、学习⽤pH计测定⼄酸解离常数的原理和⽅法;
2、加深对弱电解质解离平衡等基本概念的理解;
3、学会酸度计、
⼆、实验原理
三、主要仪器和试剂
仪器:酸度计, 碱式滴定管(50mL), 锥形瓶(250mL), 移液管(25mL), 吸量管(5mL), 容量瓶(50mL), 烧杯(50mL)试剂:HAC 溶液,NAOH 标准溶液, 酚酞
四、实验步骤
1. 醋酸溶液浓度的测定
2.配制不同浓度的醋酸溶液
3.不同浓度醋酸溶液pH 值的测定
4.加⼊等量的HAC
5.测定溶液PH
五、结果记录及数据处理
表1 醋酸溶液浓度的测定
当加⼊等量的HAC后测定的溶液的PH值就是醋酸的电离平衡常数:如图:
取平均值后得:3.60
得:电离平衡常数3.60
推导式:
、六、实验误差分析:
1.仪器的洗涤不⼲净。
2.数据的读数不准确。
3.计算的误差。

pH 法测定醋酸电离度和电离平衡常数【教学目的】1. 掌握 pH 法测定醋酸电离常数 K a 的原理和方法。
2. 掌握吸量管和酸式滴定管的使用方法。
3. 学习使用酸度计测定溶液的 pH 值。
【教学重点】通过测定醋酸电离度和电离常数,使学生加深对电离度和电离常数的理解, 并掌握酸度 计测定溶液 pH 值的方法。
【教学内容】一、实验原理醋酸是一元弱酸,在水溶液中存在下列平衡:HAc = H + + Ac– 其电离常数表达式为:K a = ]HAc [ ] Ac ][ H [ _ + (1) 设醋酸的起始浓度为c ,平衡时,[H + ] = [Ac – ],[HAc] = c –[H + ],代入(1)式得 K a = ] H [ c ] H [ 2 + + - (2)电离度a = c ] H [ + ´ 100%,代入(2)式得 K a = a a - 1 c 2 (3)当a < 5% 时,1 - a » 1 ,故 K a = c] H [ 2 + (4) 若在一定温度下,用 p H 计测定已知浓度的醋酸溶液的 p H 值,则可通过(2)或(4) 式计算该温度下醋酸溶液的电离度和醋酸的电离常数。
二、实验步骤1. 配制不同浓度的醋酸溶液取 4 只 100 mL 的烧杯洗净、干燥后编号。
按表 1 醋酸和蒸馏水的取用量,分别用吸量 管和滴定管准确量取一定体积的醋酸和蒸馏水,在烧杯中混合均匀。
2. 醋酸溶液 pH 值的测定用酸度计由稀到浓测定 1~4号 HAc 溶液的 pH 值,记录在表 1。
3. 数据记录与结果处理 表 1 醋酸电离度和电离常数的测定室温K a 烧杯 编号 HAc/mLH 2O /mL HAc 浓度 c /mol∙L -1 p H [H + ]/mol∙L -1 a 测定值 平均值 13.00 45.00 26.00 42.00 312.00 36.00 4 24.00 24.00四、基本操作及仪器的使用1. 吸量管的使用(见仪器的认领与洗涤)2. 酸式滴定管的使用滴定管是准确测量溶液体积的量出式量器,分为酸式滴定管和碱式滴定管。
实验八 (一)醋酸电离常数的测定——pH 法【目的要求】1、掌握利用pH 法测定电解质的电离常数的基本原理;2、学习pH 计的使用方法;3、巩固滴定管、移液管、吸量管、容量瓶的使用操作。
3、进一步熟悉溶液的配置与标定,规范称量、滴定的操作。
【实验原理】醋酸在水溶液中存在电离平衡:+HAcH +Ac -,由电离度和电离常数的定义有:+[H ]100%cα=⨯,2a [H ][Ac ][H ][HAc][H ]K c +-++==-当5%α<时,2a [H ]K c+≈,由此计算醋酸的电离度和电离常数。
【实验步骤】1、250mL 0.2 mol ·L -1的NaOH 溶液的配制与标定。
①称量NaOH 2.0g ,放入小烧杯中,加水溶解,转入试剂瓶,充分混合摇匀。
②称量KHC 8H 4O 4(-1204.2mol L M =⋅)0.8~1.0 g ,分别加入到标号为1~3的锥形瓶中,加40mL 水溶解。
加入2滴0.2%的酚酞溶液,用待测定NaOH 溶液滴定至微红色且30s 不变色。
平行滴定3份,要求精密度良好。
2、300mL 0.2 mol ·L -1的HAc 溶液的配配制与标定。
①用10mL 量筒量取冰乙酸(17.5mol ·L -1)3.4~3.5mL ,注入小烧杯中,加去离子水稀释后转入试剂瓶,再加水至300mL ,充分混合摇匀。
②用移液管分别向标号为1~3的三个锥形瓶中放入待测HAc 溶液25.00mL ,并加入2滴0.2%的酚酞溶液,用已标定浓度的NaOH 溶液滴定其至微红色且30s 不变色。
平行滴定3份,要求精密度良好。
3、配制不同浓度的HAc 溶液。
①用吸量管分别吸取2.50mL 、5.00mL 已知浓度醋酸溶液,用移液管移取25.00mL 已知浓度醋酸溶液,分别注入三只50mL 容量瓶中,定容,摇匀。
②将原醋酸溶液和新配制的醋酸溶液分别注入标号为1~4的四个干燥小烧杯中,按照由稀到浓的顺序用pH 计测定1~4号烧杯中不同浓度的HAc 的pH 。
乙酸解离度和解离常数的测定
一、实验目的
1、学习用pH计测定乙酸解离常数的原理和方法;
2、加深对弱电解质解离平衡等基本概念的理解;
3、学会酸度计、
二、实验原理
三、主要仪器和试剂
仪器:酸度计, 碱式滴定管(50mL), 锥形瓶(250mL), 移液管(25mL), 吸量管(5mL), 容量瓶(50mL), 烧杯(50mL)
试剂:HAC 溶液,NAOH 标准溶液, 酚酞
四、实验步骤
1. 醋酸溶液浓度的测定
2.配制不同浓度的醋酸溶液
3.不同浓度醋酸溶液pH 值的测定
4.加入等量的HAC
5.测定溶液PH
五、结果记录及数据处理
表1 醋酸溶液浓度的测定
滴定序号 1 2 3 HAc溶液用量(mL)25.00
NaOH标准溶液浓度(mol⋅L-1)0.1
NaOH标准溶液初读数V1(mL)0 0 0 NaOH标准溶液末读数V2(mL)35 32 38 NaOH标准溶液用量V(mL)35 32 38
HAc溶液测定浓度(mol⋅L-1)0.14 0.128 0.152 平均浓度(mol⋅L-1)0.14
相对平均偏差
当加入等量的HAC后测定的溶液的PH值就是醋酸的电离平衡常数:如图:
取平均值后得:3.60
得:电离平衡常数3.60
推导式:
、六、实验误差分析:
1.仪器的洗涤不干净。
2.数据的读数不准确。
3.计算的误差。