第一章相变热力学
- 格式:ppt
- 大小:6.47 MB
- 文档页数:43


热力学系统的相变与相变平衡热力学是研究能量转化和能量传递的学科,而相变则是热力学中非常重要的概念之一。
相变是物质从一种相态转变为另一种相态的过程,例如从固态到液态的熔化,从液态到气态的汽化等。
相变过程中的能量转化和物质的性质变化对于我们理解和应用热力学非常重要。
本文将介绍热力学系统的相变及其相变平衡的基本概念和相关理论。
1. 相变的基本概念相变是物质由一个相态变为另一个相态的过程,可以是固态到液态、液态到气态、固态到气态等。
相变发生时物质的性质会发生明显的变化,例如物质密度、体积、热容等。
相变可以通过调节温度和压力等外部参数来实现,一定条件下的相变称为相变平衡。
在相变过程中,物质的温度和压力保持不变,而物质内部结构的排列方式发生变化。
2. 相变的分类根据物质相变时的温度和压力变化趋势,相变可以分为一级相变和二级相变。
一级相变也称为一级相变点,一般发生在固液或液气相变时,相变过程中物质的温度保持不变,需要吸收或释放大量的潜热。
例如水的熔化和汽化过程就是一级相变。
而二级相变则是温度和压力随着相变过程的进行而逐渐变化,例如铁的铁磁相变。
3. 相变平衡的条件相变平衡的关键是物质处于两个相态之间的平衡状态,该状态下物质的温度和压力不变。
相变平衡的条件有两个:一是两相共存的压强相等,即两相的化学势相等;二是两相的温度相等,即两相之间没有温度梯度。
只有满足这两个条件,才能称为相变平衡。
4. 相变平衡的相图表示相图是描述物质在不同温度和压力下,各相相对稳定的图形表示。
相图的横轴为温度,纵轴为压力,不同相态的相界以曲线或直线表示。
在相图中,相变平衡的状态对应于相界上的点。
相界也可以通过实验测定得到,例如根据液体和气体相变的压力和温度关系可以得到液气相界。
5. 相变平衡的热力学描述根据热力学第一定律和第二定律,相变平衡过程有以下几个特点:一是相变过程中的能量转化为潜热,即相变过程中单位质量的物质吸收或释放的能量;二是相变平衡过程中物质的温度和压力不变,即可通过相变平衡曲线上的点来确定相变过程中系统的状态;三是相变过程中熵的变化,熵在相变时会发生跳跃,即熵的不连续性。


相变和热力学固体液体和气体之间的转化相变是物质在不同温度和压力条件下从一个相态转变为另一个相态的过程。
在热力学中,固体、液体和气体是物质的三种基本相态。
它们之间的相互转化是一个重要的研究领域,本文将介绍相变以及固体、液体和气体之间的转化。
一、物质的相态物质的相态是由其分子或原子的排列方式以及它们之间的相互作用力决定的。
固体的分子紧密排列,有规律的结构;液体的分子间距离较大,无规律的运动;气体的分子间距离更大,自由运动。
二、相变的概念相变是物质从一种相态转变为另一种相态的过程,常见的相变包括固液相变、液气相变和固气相变。
这些相变过程伴随着热量的吸收或释放,且在一定的温度和压力条件下发生。
三、固液相变(熔化和凝固)固液相变是物质从固体态转变为液体态(熔化)或从液体态转变为固体态(凝固)的过程。
熔化是固体受热增加分子热运动,使结构松散,从而转变为液体。
凝固则是液体受冷减少分子热运动,使结构重新排列,从而转变为固体。
四、液气相变(蒸发和液化)液气相变是物质从液体态转变为气体态(蒸发)或从气体态转变为液体态(液化)的过程。
蒸发是液体分子受热增加热运动,克服表面张力逸出液体,从而转变为气体。
液化是气体受冷减少热运动,分子聚集形成液滴,从而转变为液体。
五、固气相变(升华和凝华)固气相变是物质从固体态转变为气体态(升华)或从气体态转变为固体态(凝华)的过程。
升华是固体受热增加分子热运动,直接由固体转变为气体,无液体状态的中间过程。
凝华则是气体受冷减少分子热运动,直接由气体转变为固体。
六、热力学和相变热力学研究物质的热力学性质以及相变规律。
在热力学中,相变与热力学性质——温度、压力和物质的熵有关。
物质在相变过程中,其温度和压力会保持恒定,而物质的熵有一定的关系。
经典的热力学理论可以解释和预测相变的条件和行为。
七、相变的应用相变在日常生活和工业生产中有广泛的应用。
例如,冰在融化的过程中吸收热量,使得温度降低,因此被用于制冷和保鲜。

物理学中的相变与热力学物理学是一门研究物质运动、结构和变化规律的学科。
在物理学的各个领域中,热力学是一个十分重要的分支,它研究物质与能量之间的关系,揭示了自然界中各种现象和过程的本质。
在热力学中,相变是一个至关重要的概念,它涉及到物质从一个相态向另一个相态转变的过程,是热力学中的重要现象之一。
一、相变的概念相变是指物质从一种相态向另一种相态转化的过程。
在物理学中,物质存在着凝固态、液态和气态三种基本相态。
固体是相对稳定的,它的分子或原子在空间中排列有序,形成了一个密实、紧凑的结构;液体是无定形的,分子或原子之间存在着一定的吸引力和斥力,使得它们能够相对运动;气体则是相对稀薄的,分子或原子之间的相互作用极弱,它们之间具有高度的自由度和运动能量。
相变是物质在不同温度和压力下的表现,是一个独立于化学组成的物理过程。
当温度和压力发生变化时,物质的分子或原子之间的相互作用也会发生变化,从而使物质的性质发生改变,产生相变。
二、相变的分类根据物质的相态及相变的过程,相变可以分为以下几类:1、固-液相变固体通过升温,可以转变为液体。
这个过程称为固-液相变。
其中,熔化是最常见的固-液相变。
在熔化过程中,物质吸收热量,其温度开始升高,当温度升高到一定程度时,物质开始熔化,即从固体状态转变为液体状态。
这个过程是一个吸热过程,也就是说,它需要吸收热量才能发生。
2、液-固相变液体通过降温,可以转变为固体。
这个过程称为液-固相变。
其中,凝固是最常见的液-固相变。
在凝固过程中,物质释放热量,其温度开始降低,当温度降低到一定程度时,物质开始凝固,即从液体状态转变为固体状态。
这个过程是一个放热过程,也就是说,它会释放热量。
3、液-气相变液体通过升温或增加压力,可以转变为气体。
这个过程称为液-气相变。
其中,汽化和沸腾是最常见的液-气相变。
在汽化和沸腾过程中,物质吸收热量,其温度开始升高,当温度升高到一定程度时,液体开始汽化或沸腾,即从液体状态转变为气体状态。


热力学中的相变与相热力学是研究能量转化和传递的科学,而相变是热力学中的重要概念之一。
相变指的是物质由一种相态转变为另一种相态的过程。
在不同的温度和压力条件下,物质的相态也会发生改变。
本文将讨论热力学中的相变现象以及相变对物质性质的影响。
一、相变的定义和分类相变是指物质由一种相态转变为另一种相态的过程。
相态是指物质在给定温度和压力下的物理状态。
熟知的相态一般有固体、液体和气体三种,而在更高温度和压力下还存在等离子体、玻璃态等其他形态。
相变可以分为一级相变和二级相变。
一级相变是指在相变点上,物质的两种相态同时存在,而且其相应的热容量和体积有突变现象。
典型的一级相变包括水的冰点和沸点。
二级相变则是指在相变过程中物质的热容量和体积都是连续变化的,例如铁的铁磁相变。
二、相变的热力学特性相变是热力学研究的重要内容之一,其热力学特性可以通过相变热和相变潜热来描述。
1. 相变热相变热是指在相变过程中物质放出或吸收的热量。
对于一级相变,相变热通常为定值,例如冰的融化和水的沸腾时放出或吸收的热量。
而对于二级相变,相变热则随温度和压力的变化而变化。
2. 相变潜热相变潜热是指在相变过程中单位质量的物质所吸收或放出的热量。
相变潜热可以通过单位质量的物质在相变点上的焓变来计算,表示了单位质量物质从一种相态转变为另一种相态时所需要的能量。
三、相变对物质性质的影响相变对物质的性质具有重要影响,不仅在实际应用中具有广泛的意义,也在科学研究中有着深远的影响。
1. 导致物质性质的变化相变会导致物质的性质发生改变。
以水的相变为例,水在冰的相态下是固体,具有规则的晶体结构,而在液态下则是流动的液体。
固体和液体的物理性质存在显著差异,如密度、热导率等。
相变点附近的物质性质的变化也常常呈现出非常特殊的现象,例如热膨胀系数的极大值。
2. 技术应用相变的特性在现代科技中被广泛应用。
例如,相变储能材料可以在相变时吸收或释放大量的热量,用于无线传感器、智能建筑和电子设备的温控系统。

热力学中的相变现象热力学是研究能量转化和过程的科学,而相变现象则是热力学中的重要概念之一。
相变指的是物质由一种相态转变为另一种相态的过程,例如液化、固化和气化等。
在本文中,我们将探讨热力学中的相变现象及其背后的原理。
一、相变的定义与分类相变是物质在一定条件下由一种状态转变为另一种状态的过程。
根据物质的性质和转变的条件,相变可以分为凝固、熔化和汽化三种基本类型。
1. 凝固:凝固是指物质由液态转变为固态的过程。
当温度降低到某一点,液体中的分子或离子开始有序排列,形成固态结晶体。
2. 熔化:熔化是指物质由固态转变为液态的过程。
当温度升高到某一点,固体中的分子或离子离开有序排列,变得更加自由运动。
3. 汽化:汽化是指物质由液态转变为气态的过程。
当温度升高到某一点,液体中的分子或离子足够具有逃离液体表面的能量,形成气体状态。
二、相变的热力学原理热力学中的相变现象与物质的内能变化及熵变有关。
在一个封闭系统中,相变发生时,物质的内能会发生变化,而系统的熵也会发生变化。
1. 内能变化:在相变过程中,虽然温度保持不变,但是物质的内能却发生了变化。
这是因为相变过程中,分子间的相互作用和排列方式发生了改变,导致内能的变化。
2. 熵变:熵是衡量系统无序程度的物理量,相变过程中也会发生熵的变化。
例如凝固过程中,液体变为有序排列的固体,系统的熵会减小。
而汽化过程中,液体变为高度无序的气体,系统的熵会增加。
根据热力学第二定律,熵的增加趋势是不可逆的,即自发向高熵状态变化。
因此,相变过程也符合热力学第二定律的要求。
三、相变与相图相图是描述特定物质在不同温度和压力下各相态之间转变关系的图表。
在相图中,可以清晰地看到物质的相变点和相变曲线。
1. 相变点:相变点是指在一定的温度和压力下,物质由一种相态转变为另一种相态的临界条件。
例如水的相变点在常压下是0摄氏度(冰点)和100摄氏度(沸点)。
2. 相变曲线:相变曲线是用来表示不同相态之间转变的曲线。

相变的条件与热力学计算相变是物质由一种状态转变为另一种状态的过程,常见的相变有固体到液体的熔化、液体到气体的汽化以及固体到气体的升华。
相变发生的条件与热力学计算密切相关,本文将探讨相变的条件以及热力学计算的方法。
一、相变的条件相变在一定的条件下才能发生,主要包括温度、压力和物质的性质等因素。
1. 温度条件温度是相变发生的关键因素之一。
对于普通物质而言,相变通常在一定的温度范围内进行。
例如,对于水来说,在标准大气压下,0℃以下会发生冻结相变,0℃到100℃之间会发生液体与气体之间的转变。
2. 压力条件压力也是影响相变的重要因素之一。
在一定的温度下,不同压力下相变的发生时间和条件也会有所不同。
以水为例,当压力增加时,水的沸点会升高,当压力降低时,水的沸点会降低。
3. 物质性质条件不同物质的相变条件也会存在差异。
例如,金属的熔化点通常较高,而非金属物质的熔化点通常较低。
物质的分子结构、化学组成和相互作用力等因素都会影响相变的条件。
二、热力学计算方法在研究相变过程时,热力学计算是一种重要的方法。
通过热力学计算,可以得到相变的热力学参数,例如相变的焓变、熵变和自由能变化等。
1. 焓变在相变过程中,焓的变化量被定义为相变时物质所吸收或释放的热量。
焓变可以通过测量相变前后的热量以及温度变化来计算。
焓变的计算方法可以使用热容和热量转移方程进行估算。
2. 熵变熵的变化量表示了在相变过程中物质的无序程度的变化。
熵变的计算方法可以利用熵的定义公式和热力学基本方程进行计算。
熵变的正负值可以表征相变是熵增(正)还是熵减(负)的过程。
3. 自由能变化自由能变化是相变过程中物质可能发生的方向和稳定性的判断依据。
通过计算相变前后的自由能变化,可以了解相变是否会自发发生。
自由能变化可以通过自由能的定义公式和热力学基本方程进行计算。
通过热力学计算,可以获得相变的热力学参数,从而对相变过程进行分析和预测。
这对于材料科学、化学工程以及能源研究等领域都有着重要的意义。

第一章 热力学第一定律核心内容:能量守恒 ΔU=Q+W主要内容:三种过程(单纯pVT 变化、相变、化学反应)W 、Q 、ΔU 、ΔH 的计算一、内容提要1.热力学第一定律与状态函数(1)热力学第一定律: ΔU=Q+W (封闭系统) 用途:可由ΔU ,Q 和W 中的任意两个量求第三个量。
(2)关于状态函数(M )状态函数:p 、V 、T 、U 、H 、S 、A 、G ……的共性: ①系统的状态一定,所有状态函数都有定值;②系统的状态函数变化值只与始终态有关,而与变化的途径无关。
用途:在计算一定始终态间的某状态函数增量时,为了简化问题,可以撇开实际的复杂过程,设计简单的或利用已知数据较多的过程进行计算。
ΔM (实)=ΔM (设)。
这种方法称为热力学的状态函数法。
③对于循环过程,系统的状态函数变化值等于零,即ΔM =0。
此外,对于状态函数还有如下关系:对于组成不变的单相封闭系统,任一状态函数M 都是其他任意两个独立自变量(状态函数)x 、y 的单值函数,表示为M=M(x 、y),则注意:因为W 和Q 为途径函数,所以Q 和W 的计算必须依照实际过程进行。
⎰-=21V V a m bdV p W ,其中p amb 为环境压力。
Q 由热容计算或由热力学第一定律求得。
dy y M dx x M dM xy ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂=)(1循环关系式-=⎪⎭⎫⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂xM y M y y x x M )(22尤拉关系式xy My x M ∂∂∂=∂∂∂1(p 1,V 1,T 1) (p'1,V 1,T 2) 2(p 2,V 2,T 2) (p 1,V'1,T 2) VT 将热力学第一定律应用于恒容或恒压过程,在非体积功为零(即w'=0)的情况下有:Q V =ΔU ,Q p =ΔH (H 的定义:H=U+pV )。
此时,计算Q v 、Q p 转化为计算ΔU 、ΔH ,由于U 、H 的状态函数性质,可以利用上面提到的状态函数法进行计算。
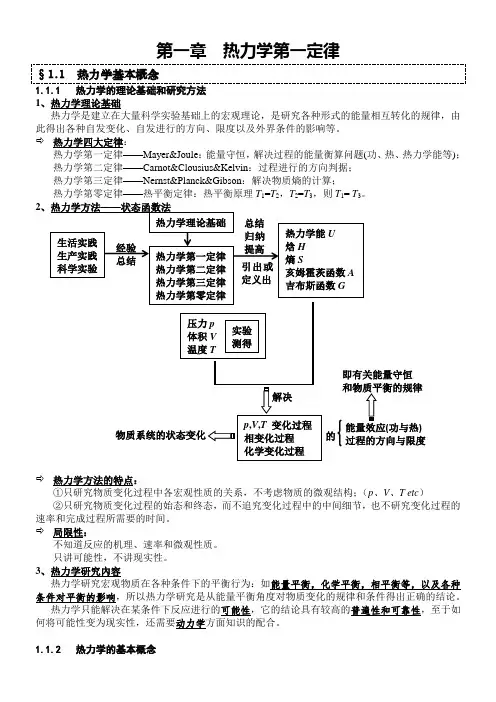
经验 总结总结 归纳提高 引出或定义出 解决的 能量效应(功与热) 过程的方向与限度 即有关能量守恒 和物质平衡的规律 物质系统的状态变化 第一章 热力学第一定律§1.1 热力学基本概念1.1.1 热力学的理论基础和研究方法 1、热力学理论基础热力学是建立在大量科学实验基础上的宏观理论,是研究各种形式的能量相互转化的规律,由此得出各种自发变化、自发进行的方向、限度以及外界条件的影响等。
⇨ 热力学四大定律:热力学第一定律——Mayer&Joule :能量守恒,解决过程的能量衡算问题(功、热、热力学能等); 热力学第二定律——Carnot&Clousius&Kelvin :过程进行的方向判据; 热力学第三定律——Nernst&Planck&Gibson :解决物质熵的计算;热力学第零定律——热平衡定律:热平衡原理T 1=T 2,T 2=T 3,则T 1= T 3。
2、热力学方法——状态函数法⇨ 热力学方法的特点:①只研究物质变化过程中各宏观性质的关系,不考虑物质的微观结构;(p 、V 、T etc )②只研究物质变化过程的始态和终态,而不追究变化过程中的中间细节,也不研究变化过程的速率和完成过程所需要的时间。
⇨ 局限性:不知道反应的机理、速率和微观性质。
只讲可能性,不讲现实性。
3、热力学研究內容热力学研究宏观物质在各种条件下的平衡行为:如能量平衡,化学平衡,相平衡等,以及各种条件对平衡的影响,所以热力学研究是从能量平衡角度对物质变化的规律和条件得出正确的结论。
热力学只能解决在某条件下反应进行的可能性,它的结论具有较高的普遍性和可靠性,至于如何将可能性变为现实性,还需要动力学方面知识的配合。
1.1.2 热力学的基本概念生活实践 生产实践 科学实验 热力学第一定律 热力学第二定律 热力学第三定律 热力学第零定律 热力学理论基础 热力学能U 焓H 熵S 亥姆霍茨函数A 吉布斯函数G压力p 体积V 温度T 实验测得p ,V ,T 变化过程 相变化过程 化学变化过程1、系统与环境 ⇨ 系统(System ):热力学研究的对象(微粒组成的宏观集合体)。
相变热力学能变化相变是物质在一定条件下由一种物态转变为另一种物态的过程,常见的相变包括凝固、熔化、蒸发、凝华等。
在相变过程中,热力学能发生变化,这种变化被称为相变热力学能变化。
本文将围绕相变热力学能变化展开讨论。
相变是物质内部结构和性质的重大变化,它对于物质的研究和应用具有重要意义。
相变热力学能变化是相变过程中能量的变化,可以通过热力学方法进行分析和计算。
我们来了解一下相变的基本概念。
相变是物质从一种物态转变为另一种物态的过程,这种转变是由于物质内部的微观结构发生了变化。
在相变过程中,物质的温度、压力和物质的性质都会发生变化。
相变可以分为两类,一类是一定温度下的压力变化引起的相变,另一类是一定压力下的温度变化引起的相变。
在相变过程中,热力学能是一个重要的物理量。
热力学能是指物质内部的能量,包括内能和势能。
在相变过程中,物质的内能和势能都会发生变化,从而引起热力学能的变化。
热力学能变化的大小取决于相变的类型和条件。
凝固是一种常见的相变过程,它是由于物质的温度降低而引起的。
在凝固过程中,物质从液态转变为固态,这是由于分子之间的作用力增强,使得分子排列有序。
在凝固过程中,物质的热力学能会发生变化。
当物质从液态转变为固态时,其内能会减少,而势能会增加,从而使得热力学能减少。
凝固过程中的热力学能变化是一个负值,表示能量的流失。
熔化是凝固的逆过程,它是由于物质的温度升高而引起的。
在熔化过程中,物质从固态转变为液态,这是由于分子之间的作用力减弱,使得分子排列无序。
在熔化过程中,物质的热力学能会发生变化。
当物质从固态转变为液态时,其内能会增加,而势能会减少,从而使得热力学能增加。
熔化过程中的热力学能变化是一个正值,表示能量的吸收。
蒸发是另一种常见的相变过程,它是由于物质的温度升高和压力降低而引起的。
在蒸发过程中,物质从液态转变为气态,这是由于分子的动能增加,使得分子能够克服表面张力逃逸到气相。
在蒸发过程中,物质的热力学能会发生变化。
相变过程中的热力学相变是物质的一种基本性质,概括而言,就是物质状态的转变。
相变可以有多种形式,如液化、凝固、升华等。
在相变的过程中,物质的热力学性质发生了变化,它的热容、熵、焓等都会发生变化。
相变的热力学基础相变的发生,实际上是物质能量状态发生了改变。
简单来说,相变就是从一种结构状态到另一种结构状态的转变。
在此过程中,物质所具有的热力学性质也会发生变化。
我们知道,物质的热力学性质,它们都是与能量维度密切相关的。
而相变正是在能量变化的影响下发生的。
相变中的热力学参数相变过程中最显著的一个热力学参数是焓。
焓是指在相变过程中物质所吸收的热量。
因为相变是从一种能量状态到另一种能量状态的转变,所以相变本质上是能量的转化过程。
这个转化过程,实际上就是热从一个系统转移到另一个系统,导致物质的能量状态发生了变化。
在这个转化过程中,焓就是承载这种能量变化的物理参数。
除了焓,还有熵和热容等参数也会随着相变而变化。
熵是一个系统的无序程度的度量,它会随着相变而发生变化。
而热容则是在相变温度下,物体所吸收的热量的变化程度,这也是相变过程中的重要物理参数。
相变的分类根据相变的表现形式,它们可以被分为多种类型。
1. 固体-液体相变:此类相变的典型代表是凝固和熔化。
这些相变通常需要利用物质状态的温度来控制。
2. 固体-气体相变:此类相变的代表是升华,利用温度和气压可控制。
3. 液体-气体相变:此类相变的代表是汽化,利用温度和气压可控制。
相变的热力学特征相变在热力学上的一个非常重要的特征,就是它发生时物质中的熵会发生变化。
在一般的相变中,物质的熵往往会增加。
这也是为什么在相变时物质所需要吸收的热量会非常巨大的原因。
因为在相变过程中,物质的熵变化非常显著,这就意味着,物质所吸收的热量也需要相应地增加。
总之,相变是热力学研究的一个重要领域,深入理解相变的热力学特征,可以帮助我们更好地掌握物质的热学性质。
这些理论研究的成果,也为我们研究物质的物理化学性质提供了有益的参考。
热力学中的相变现象知识点总结热力学是研究物质能量转换和物质的宏观行为的科学分支。
在热力学中,相变现象是物质在特定条件下从一种相态转变为另一种相态的过程。
本文将对热力学中的相变现象进行一些知识点的总结。
1. 相变的定义相变是物质在一定温度和压力条件下由一种相态转变为另一种相态的过程。
相变包括固态向液态的熔化、液态向气态的汽化、气态向液态的凝结以及液态向固态的凝固等过程。
2. 相变的热力学特性相变过程中,物质的温度保持不变,这是因为在相变过程中,物质吸收或释放的热量用来克服分子或原子间的相互作用力,使得相变发生。
这个过程中,物质的内能不发生改变。
3. 热力学相变图热力学相变图是用来描述物质随着温度和压力变化而发生相变的图表。
在热力学相变图中,横轴表示温度,纵轴表示压力,不同的相态以曲线或直线表示。
例如,对于水,冰的相变曲线表示了冰到水的熔化,水的相变曲线表示了水到水蒸气的汽化。
4. 相变的热力学描述相变过程中,物质吸收或释放的热量可以由热容量和热交换公式来描述。
热容量是物质单位质量在相变过程中吸收或释放的热量,一般用单位质量的物质的温度改变1摄氏度所需要的热量来表示。
5. 相变的状态方程相变过程可以通过一些状态方程来描述,最常用的是克拉珀龙方程和麦克斯韦方程。
克拉珀龙方程描述了在相变点附近物质的状态变化,麦克斯韦方程描述了在不同相态之间的状态变化。
6. 相变的分类相变可以分为一级相变和二级相变。
一级相变指的是物质在相变过程中吸收或释放的潜热(单位质量的物质在相变过程中吸收或释放的热量)突变,例如冰到水的熔化过程。
二级相变指的是物质在相变过程中吸收或释放的潜热不突变,例如水蒸气到水的凝结过程。
7. 相变的应用相变在生活中有许多应用,例如冷藏食品中的冷冻相变、制备高纯度合金的晶粒细化相变、汽车制动系统中的制动液的沸腾相变等。
总结:热力学中的相变现象是物质在特定温度和压力条件下从一种相态转变为另一种相态的过程。