人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)
- 格式:pdf
- 大小:186.15 KB
- 文档页数:3

肿瘤坏死因子-α正常水平肿瘤坏死因子-α(Tumor Necrosis Factor-alpha,TNF-α)是一种由活化的免疫细胞分泌的细胞因子,广泛参与了多种免疫和非免疫反应。
TNF-α可以激活、调节各类免疫细胞、介导细胞凋亡、促进炎症反应、改变代谢、参与器官发育、影响认知和情绪等多种生理和病理过程。
本文将重点介绍 TNF-α的正常水平及其相关参考内容。
正常水平TNF-α的正常水平会因年龄、性别、生理状态、环境因素等多种因素而异。
正常人体血清中 TNF-α的浓度大约是 1.6 -14.5 pg/mL,但这个水平也有很大的变异性。
此外,不同的检测方法和试剂盒也可能对 TNF-α的检测结果产生影响。
鉴于此,医生在判读检测结果时应该参考具体的医学指南并结合患者情况,以免产生误差。
参考值的设定通常是以健康人群的平均值为基准,多数实验室以3 pg/mL ~ 5 pg/mL为临界值。
当血清中 TNF-α的浓度超过临界值,则有可能存在某些炎症、感染、肿瘤等疾病。
当然,TNF-α检测结果应该与临床症状、其他病理检查结果等综合分析,不能单独作为诊断标准。
影响因素TNF-α的分泌受到多种生理和病理因素的影响。
以下是一些常见影响因素:1. 炎症和感染:TNF-α主要在炎症和感染状态下才会被大量产生。
细菌、病毒或其他致病微生物侵入机体后,会刺激免疫细胞分泌 TNF-α,以启动炎症反应并抵抗病原体。
2. 创伤和手术:创伤和手术也可以引起机体炎症反应,从而促进 TNF-α的分泌。
尤其是大面积的烧伤、创伤和手术后综合征等情况,TNF-α的水平会显著升高,并可能影响病情和预后。
3. 肥胖和代谢紊乱:一些研究表明,肥胖、2型糖尿病和代谢综合征等代谢紊乱疾病与 TNF-α的水平升高有关。
这可能是由于TNF-α与脂肪细胞、胰岛素、葡萄糖代谢等有关的机制。
4. 其他因素:其他因素如精神压力、某些药物、环境污染等也可能引起 TNF-α的变化,但目前仍需进一步研究证实。

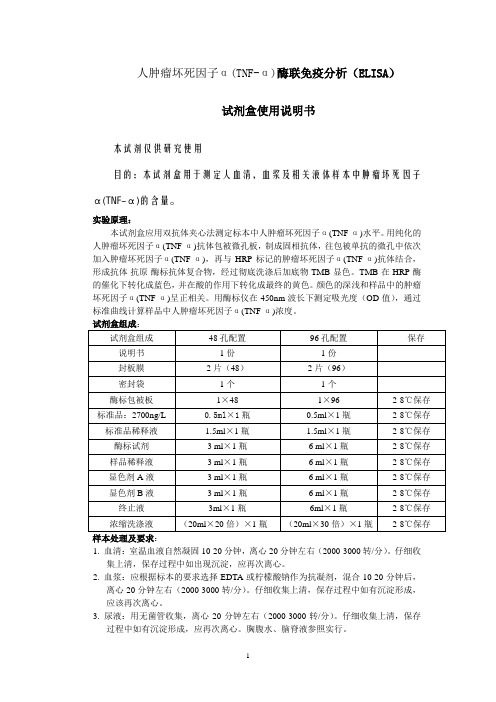
人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,细胞上清及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的人肿瘤坏死因子α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450pg/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。


人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α(TNF-α),再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤坏死因子α(TNF-α)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。

血清TNF摘要:目的:旨在研究2型糖尿病(t2dm)患者血清肿瘤坏死因子-α(tumor necrosis factor,tnf-α)与视网膜病变的相关性。
方法:进入本研究的共有120例,所有受试者中无高血压、冠心病、脑血管病病史,其中单纯2型糖尿病(non-diabetic retinopathy,ndr组)者31例,2型糖尿病合并背景期dr(background-diabetic retinopathy,bdr组)者30例,2型糖尿病合并增殖期dr (proliferative-diabetic retinopathy,pdr组)者29例及正常对照组30例。
测定受试者禁食8-10小时过夜后的空腹血糖(fpg)、糖化血红蛋白(hba1c)、tc、tg、hdl-c、ldl-c并测量身高、体重,计算bmi。
结论:bdr组血清tnf-α水平明显高于ndr组,pdr组血清tnf-α水平高于bdr组,随着dm病程的延长及视网膜受损程度与tnf-α呈显著正相关。
关键词:2型糖尿病肿瘤坏死因子-α糖尿病视网膜病变【中图分类号】r4 【文献标识码】a 【文章编号】1008-1879(2012)12-0048-02糖尿病视网膜病(diabetic retinopathy,dr)是糖尿病最常见的微血管并发症之一,是造成糖尿病病人失明的主要原因,其发生机制尚不完全清楚。
当血液中tnf-α异常增高时,可损伤血管内皮细胞,造成血管内皮细胞形态改变,细胞膜及细胞器损害等,并能增加内皮细胞的通透性。
1 临床资料1.1 一般资料。
符合1998年who诊断标准2型糖尿病患者共90例,男42例,女48例,dr诊断按全国眼底病协作组制定的糖尿病视网膜诊断标准,根据直接眼底镜检查将患者分为三组:①无视网膜病变组(non-dr,ndr)31例,男15例,女16例,年龄58.5±6.9岁,病程6个月-5年。
②背景期dr组(background-dr,bdr)30例,男15例,女15例,年龄60.3±5.4岁,病程3-15年。
绵羊肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定绵羊血清,血浆及相关液体样本中肿瘤坏死因子α(TNF-α)量。
实验原理:本试剂盒应用双抗体夹心法测定标本中绵羊肿瘤坏死因子α(TNF-α)水平。
用纯化的绵羊肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的TNF-α抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤坏死因子α呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD值),通过标准曲线计算样品中绵羊肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450ng/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂 3 ml×1瓶 6 ml×1瓶2-8℃保存样品稀释液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液 3 ml×1瓶 6 ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存20倍浓缩洗涤液20ml×1瓶30ml×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
肿瘤坏死因子检测方法
肿瘤坏死因子(Tumor Necrosis Factor, TNF)是一种由免疫细胞产生的蛋白质,它在调节炎症反应、免疫应答和细胞凋亡等方面发挥重要作用。
检测肿瘤坏死因子的方法对于疾病诊断和治疗具有重要意义。
目前,常用的肿瘤坏死因子检测方法主要包括酶联免疫吸附试验(ELISA)、
流式细胞术和PCR技术等。
首先,酶联免疫吸附试验是一种常用的定量检测方法。
该方法通过特异性抗体
与目标物结合,再利用辣根过氧化物酶或碱性磷酸酶等酶标记的二抗进行检测。
通过测量酶标记物的反应产物的光学密度,可以定量检测肿瘤坏死因子的含量。
其次,流式细胞术也广泛应用于肿瘤坏死因子检测。
该方法通过标记特异性抗体,结合细胞表面的肿瘤坏死因子,再利用荧光染料检测的原理,可以定量分析肿瘤坏死因子在不同细胞亚群中的表达水平。
流式细胞术具有高灵敏度和高通量的优点,能够同时检测多个指标。
此外,PCR技术也可以用于肿瘤坏死因子的检测。
PCR技术利用特异性引物扩增目标基因片段,通过测量扩增产物的数量来定量分析肿瘤坏死因子的表达水平。
PCR技术具有高度的灵敏度和特异性,能够快速准确地检测目标物。
综上所述,肿瘤坏死因子的检测方法包括酶联免疫吸附试验、流式细胞术和PCR技术等。
这些方法在临床诊断、疾病监测和药物研发中具有重要意义,有助
于深入理解肿瘤坏死因子在疾病发生发展中的作用机制,并为个体化治疗提供参考依据。
双抗体夹心ELISA法检测样本中TNF-α的浓度TNF-α简介:肿瘤坏死因子(TNF-α)是由单核细胞和巨噬细胞产生的多肽类细胞因子,在炎症反应、免疫系统的发展、细胞程序性死亡和脂代谢中起重要的作用。
其功能主要是在免疫反应中是一个多功能的调节器甚至作为一个强烈的热原性物质刺激中性粒细胞,改变血管内皮细胞的特性,调节其它组织的代谢活性。
TNF-α也可通过抑制脂蛋白脂肪酶的活性而导致恶液病。
爱泼斯坦病毒引起的细胞活化也可被TNF-α所抑制。
巨噬细胞表面的淋巴因子和肉毒素也可介导包括上皮细胞、内皮细胞和肿瘤细胞等产生TNF-α。
据报道干扰素能显著提高TNF-α的分泌量。
TNF-α在关节炎和其它组织的炎症的发病机理中起重要作用。
TNF-α也参与了包括哮喘、克罗恩氏病、类风湿性关节炎、神经性疼痛、肥胖症、 型糖尿病、自身免疫病和肿瘤等疾病的发生检测原理:本试剂盒采用双抗体夹心ELISA法检测样本中TNF-α的浓度。
TNF-α捕获抗体已预包被于酶标板上,当加入标本或参考品时,其中的TNF-α会与捕获抗体结合,其它游离的成分通过洗涤的过程被除去。
当加入生物素化的抗人TNF-α抗体后,抗人TNF-α抗体与TNF-α接合,形成夹心的免疫复合物,其它游离的成分通过洗涤的过程被除去。
随后加入辣根过氧化物酶标记的亲合素。
生物素与亲合素特异性结合,亲合素连接的酶就会与夹心的免疫复合物连接起来;其它游离的成分通过洗涤的过程被除去。
最后加入显色剂,若样本中存在TNF-α将会形成免疫复合物,辣根过氧化物酶会催化无色的显色剂氧化成蓝色物质,在加入终止液后呈黄色。
通过酶标仪检测,读其450nm处的OD值,TNF-α浓度与OD450值之间呈正比,通过参考品绘制标准曲线,对照未知样本中OD值,即可算出标本中TNF-α浓度。
实验过程需自备的材料:1.不同规格的加样枪及相应的枪头;2.酶标仪;3.自动洗板机; 4.去离子水或双蒸水;标本收集:1.标本的收集请按下列流程进行操作:A.细胞上清标本离心去除悬浮物后即可;B.血清标本应是自然凝固后,取上清,避免在冰箱中凝固血液;C.血浆标本,推荐用EDTA的方法收集;D. 若待测样本不能及时检测,标本收集后请分装,冻存于-20℃,避免反复冻融。
TNF肿瘤坏死因子的介绍TNF-α(肿瘤坏死因子-α)是一种重要的细胞生物活性因子,是免疫系统中的关键分子之一、它起源于巨噬细胞、单核细胞、淋巴细胞、T细胞等,并且在感染、炎症和免疫反应中起着重要的调节作用。
TNF-α在炎症反应和组织修复过程中发挥着重要的作用。
TNF-α主要由活化的巨噬细胞和T细胞分泌,它的分泌受到多种刺激因素的调控。
在感染时,病原体成分经过细胞感应机制激活细胞表面的受体,这些受体激活之后会引起下游信号通路的激活,最终导致TNF-α的产生和释放。
TNF-α的产生和作用具有很强的时效性,可以迅速对炎症反应作出反应,并诱导其他炎性细胞的积聚和活化。
TNF-α的生物活性非常广泛,它可以通过多种机制参与免疫调节。
首先,TNF-α可以增加细胞表面黏附分子的表达,这些黏附分子对炎症细胞的黏附和集聚起着重要作用。
其次,TNF-α可以增强血管的渗透性,使白细胞更容易穿过血管壁进入炎症区域。
此外,TNF-α还可以促进细胞的凋亡,即程序性细胞死亡,从而清除病原体和受损细胞。
尽管TNF-α在炎症反应和免疫调节中扮演重要角色,但过度产生TNF-α也可能引起炎症反应失控,导致严重的炎症性疾病。
例如,关节炎、炎性肠病、系统性红斑狼疮和肺部感染等疾病的发展与TNF-α的过度产生密切相关。
因此,抑制TNF-α的作用已成为许多药物研发的重要目标之一在临床治疗中,针对TNF-α的治疗策略已被广泛采用。
针对TNF-α的免疫抑制药物已被用于治疗类风湿性关节炎、银屑病和炎性肠病等疾病。
这些药物可以通过结合TNF-α并中和其生物活性来达到治疗的效果。
此外,利用基因工程技术生产的可溶性TNF-α受体融合蛋白也作为治疗TNF-α相关疾病的一种手段。
总之,TNF-α作为一种免疫系统中的重要调节因子,参与多个疾病的发生和发展过程中,具有广泛的生物活性和调节作用。
深入研究TNF-α的分子机制和功能,不仅有助于揭示炎症反应和免疫调节的机制,还为相关疾病的治疗提供了重要的思路和方法。
人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)
试剂盒使用说明书
本试剂仅供研究使用目的:本试剂盒用于测定人血清,细胞上清及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:
本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的羊抗人抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的人肿瘤坏死因子α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:
样本处理及要求:
1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上
清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心
20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程
中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/
分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞
浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备
用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
分装后一份待检测,其余冷冻备用。
6. 标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上
进行试验,可将标本放于-20℃保存,但应避免反复冻融.
7. 不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤
1.标准品的稀释与加样:在酶标包被板上设标准品孔12孔,在第一、第二孔中分别加标
准品100μl;然后从第一孔、第二孔中各取50μl分别加到第三孔和第四孔,再在第三、第四孔分别加标准品稀释液50μl,混匀;然后在第三孔和第四孔中各取50μl分别加到第五、第六孔中,再在第五、第六孔中分别加标准品稀释液50ul,混匀;混匀后从第
五、第六孔中各取50μl分别加到第七、第八孔中,再在第七、第八孔中分别加标准品
稀释液50μl,混匀后从第七、第八孔中分别取50μl加到第九、第十孔中,再在第九第十孔分别加标准品稀释液50μl,混匀后从第九第十孔中各取50μl加到第十一、第十二孔中,再在第十一、第十二孔分别加标准品稀释液50μl,混匀后从第十一、第十二孔中各取50μl弃掉。
(稀释后各孔加样量都为50μl,浓度分别为40 ng/ml,20 ng/ml ,
10 ng/ml,5ng/ml,2.5 ng/ml, 1.25 ng/ml)。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样
品孔。
在酶标包被板上待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30(48T的20倍)倍浓缩洗涤液用蒸馏水30(48T的20倍)倍稀释后备用。
5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此
重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色
15分钟.
10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
11.测定:以空白空调零,450nm波长依序测量各孔的吸光度(OD值)。
测定应在加终止
液后15分钟以内进行。
注意事项:
1.试剂盒从冷藏环境中取出应在室温平衡15-30分钟后方可使用,酶标包被板开封后如未用完,板条应装入密封袋中保存。
2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。
3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。
一次加样时间最好控制在5分钟内,如标本数量多,推荐使用排枪加样。
4.请每次测定的同时做标准曲线,最好做复孔。
如标本中待测物质含量过高(样本OD值大于标准品孔第一孔的OD值),请先用样品稀释液稀释一定倍数(n倍)后再测定,计
算时请最后乘以总稀释倍数(×n×5)。
5.封板膜只限一次性使用,以避免交叉污染。
6.底物请避光保存。
7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准.
8.所有样品,洗涤液和各种废弃物都应按传染物处理。
9.本试剂不同批号组分不得混用。
10. 如与英文说明书有异,以英文说明书为准。
计算:Array以标准物的浓度为横坐标,OD值为纵坐标,
在坐标纸上绘出标准曲线,根据样品的OD
值由标准曲线查出相应的浓度;再乘以稀释
倍数;或用标准物的浓度与OD值计算出标
准曲线的直线回归方程式,将样品的OD值
代入方程式,计算出样品浓度,再乘以稀释
倍数,即为样品的实际浓度。
(此图仅供参考)试剂盒性能:
1.样品线性回归与预期浓度相关系数R值为0.92以上。
2.批内与批见应分别小于9%和15%
检测范围:
0.7ng/ml -40 ng/ml
保存条件及有效期:
1.试剂盒保存:;2-8℃。
2.有效期:6个月。