构成物质的基本微粒(1)
- 格式:doc
- 大小:1003.50 KB
- 文档页数:4

构成物质的基本微粒(1)一、回顾、预习与交流1.高锰酸钾固体的颜色为_______,高锰酸钾溶液_______色。
2.冰、水、水蒸气是同种物质吗?___________;干冰和冰是同种物质吗?____3.水的电解和水的蒸发是同种变化吗?你能解释吗?4.汞俗称水银,可作为温度计的材料,你能解释原因吗?水能否作为制作温度计的材料呢?夏天,高速行驶的汽车容易爆胎,你知道原因吗?二、合作~研讨~点拨活动一、探究构成物质的微粒的性质[观察实验] 见课本中p63的“观察与思考”[现象记录] 【实验1】说明氨水能使酚酞试液变_____。
实验2的现象_____________________[交流讨论] 实验2的现象说明了什么?你能从微观的角度来分析吗?_____________________________________________[结论]构成物质的微粒_______________________ ______________ _____[观察实验] 见课本中p63的“活动与探究”。
[现象记录] 实验1现象_____________________________实验2现象_____________________________[交流讨论] 实验1说明了什么?实验2说明了什么?[结论]构成物质的微粒_______________________ ______________ ______________ _____三、总结~反思~提升1.活动一、活动二。
2.反思“预习交流”中的第4题,你能用微粒的观点来分析吗?3.你能从微观的角度去分析解释“预习交流”中的第2、3题吗?4.沙尘暴现象的存在能证明微粒具有运动的性质吗?海绵能够吸水的事实能说明微粒之间有空隙的性质吗?5.将50ml酒精与50ml水混合后的体积是多少? 50ml酒精与50ml酒精呢?6.从热水瓶中倒完开水,塞瓶塞时,瓶塞总是往上蹦,这是什么原因?四、自检~反馈~巩固【课堂反馈】完成课本中“练习与实践”1-6题。

第3章物质构成的奥秘第1节构成物质的基本微粒(第1课时)【教学内容】上教版九义教科书《化学》上册第三章第一节【教学目标】1.知识目标:①理解物质的微粒性:物质由微粒构成,微粒持续运动,微粒之间有空隙;②能用微粒的观点解释某些常见的现象;③能用某些事实或设计完成某些实验说明物质的微粒性;④使用相关物质的微粒知识实行想象和推理。
2.水平和技能目标:①培养学生的观察和实验水平;②培养学生提出问题、分析问题和解决问题的水平。
3.情感、态度、价值观目标:①培养学生尊重事实、勇于探索、勇于创新的科学精神;②培养学生主动参与、合作的意识和水平。
【教学重点、难点】1.理解物质的微粒性:物质由微粒构成,微粒持续运动,微粒之间有空隙;2.能用微粒的观点解释某些常见的现象。
【教学策略】学生在第二章已学习了身边的物质,知道不同的物质的化学性质是不同的,本节课以“为什么不同的物质的化学性质不同”引入,让学生明确本章学习的内容和目的。
首先,通过实验感受物质分割过程,使学生构建微粒的观点;其次,通过学生的讨论、设计、实验探究,得到微粒的某些特征:微粒是持续运动的,微粒之间有空隙,并使用多媒体动画演示微粒的变化情况以加深理解;最后,利用物质的微观性能解释生活中常见的现象和一些实验现象。
形成微粒的观点,学生接受构成物质的三种基本微粒(分子、原子和离子)就更加顺利。
【教学准备】1.学生准备分组实验,四人一组,其中化学学习水平较强的学生为组长。
2.教具准备①多媒体教学设备②试管、烧杯、酒精灯、药匙、胶头滴管、一端封口的细玻璃管、注射器、研钵、高锰酸钾、蒸馏水、浓氨水、酚酞、酒精等。
【教学过程】附:板书设计第一节构成物质的基本微粒一、物质都是由极其微小的、肉眼看不见的微粒构成的。
不同的物质由不同的微粒构成,因此不同的物质有不同的性质。
二、微粒是不断运动的。
三、微粒之间有空隙。
气体物质中微粒之间的距离比固体、液体中的大。

构成物质的基本微粒构成物质的基本微粒是指构成物质的最基本的、不可再分的微小粒子。
根据现代物理学的研究,目前已经确定了构成物质的基本微粒有三种,分别是质子、中子和电子。
质子是构成原子核的基本粒子,具有正电荷。
它的质量约为1.6726219×10^-27千克,是电子的1836倍。
质子的数量决定了原子的元素性质,不同元素的原子核中质子的数量不同。
中子也是构成原子核的基本粒子,它没有电荷,是电子的1839倍。
中子的质量约为1.6749275×10^-27千克,略大于质子。
中子的存在稳定了原子核的结构,使得原子核能够存在。
电子是带负电荷的基本粒子,围绕原子核运动。
电子的质量约为9.10938356×10^-31千克,是质子的约1/1836。
电子的数量决定了原子的电荷性质,正负电子数量相等时,物质是电中性的。
质子、中子和电子是构成原子的基本微粒,它们以一定的方式组合形成各种不同的原子。
原子是构成物质的最基本单位,所有物质都是由不同种类的原子组成的。
原子通过化学反应可以组成分子,分子是物质的另一种基本单位。
分子由两个或多个原子通过共享电子形成化学键而结合在一起。
不同种类的原子组成的分子具有不同的化学性质。
除了质子、中子和电子,目前还存在其他一些更基本的微粒,如夸克和轻子等。
夸克是构成质子和中子的基本粒子,有六种不同的味道(上夸克、下夸克、奇夸克、反奇夸克、顶夸克和底夸克),它们以不同的方式组合形成质子和中子。
轻子是一类基本粒子,包括电子、μ子、τ子和它们对应的中微子。
基本微粒的发现和研究对于理解物质的基本结构和性质具有重要意义。
通过研究微观粒子的性质和相互作用,人们不断深化了对物质的认识,推动了科学技术的发展。
构成物质的基本微粒是质子、中子和电子。
它们以不同的方式组合形成原子和分子,构成了我们周围的一切物质。
对基本微粒的研究有助于深化对物质本质的认识,为科学研究和技术应用提供了重要基础。
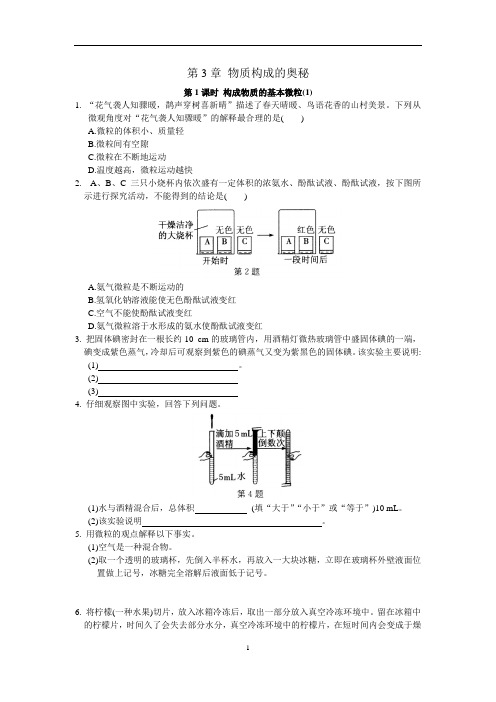
第3章物质构成的奥秘第1课时构成物质的基本微粒(1)1. “花气袭人知骤暖,鹊声穿树喜新晴”描述了春天晴暖、鸟语花香的山村美景。
下列从微观角度对“花气袭人知骤暖”的解释最合理的是( )A.微粒的体积小、质量轻B.微粒间有空隙C.微粒在不断地运动D.温度越高,微粒运动越快2. A、B、C三只小烧杯内依次盛有一定体积的浓氨水、酚酞试液、酚酞试液,按下图所示进行探究活动,不能得到的结论是( )A.氨气微粒是不断运动的B.氢氧化钠溶液能使无色酚酞试液变红C.空气不能使酚酞试液变红D.氨气微粒溶于水形成的氨水使酚酞试液变红3. 把固体碘密封在一根长约10 cm的玻璃管内,用酒精灯微热玻璃管中盛固体碘的一端,碘变成紫色蒸气,冷却后可观察到紫色的碘蒸气又变为紫黑色的固体碘。
该实验主要说明:(1) 。
(2)(3)4. 仔细观察图中实验,回答下列问题。
(1)水与酒精混合后,总体积(填“大于”“小于”或“等于”)10 mL。
(2)该实验说明。
5. 用微粒的观点解释以下事实。
(1)空气是一种混合物。
(2)取一个透明的玻璃杯,先倒入半杯水,再放入一大块冰糖,立即在玻璃杯外壁液面位置做上记号,冰糖完全溶解后液面低于记号。
6. 将柠檬(一种水果)切片,放入冰箱冷冻后,取出一部分放入真空冷冻环境中。
留在冰箱中的柠檬片,时间久了会失去部分水分,真空冷冻环境中的柠檬片,在短时间内会变成于燥的柠檬片。
用微粒的观点解释:(1)为什么冷冻后的柠檬片还会失去水分?(2)为什么真空冷冻环境中的柠檬片,在短时间内就会变干燥?第2课时 构成物质的基本微粒(2)1. 化学的学习使我们学会了从微观的角度认识宏观现象,下列对宏观现象解释不正确的是( )A.干冰升华—分子的体积变大B.闻到远处花香—分子在不断地运动C.水变为水蒸气体积变大—分子间间隔增大D.氧化汞受热分解—分子在化学变化中可以再分2. 下列关于分子和原子的说法,错误的是( )A.分子和原子都可以构成物质B.由分子构成的物质,分子是保持其化学性质的最小微粒C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小3. 在电解水的反应中,发生变化的微粒是 ,不变的微粒是 和 ,产生的新微粒是 和 ,反应前后分子数目 (填“变化”或“不变”,下同),原子种类 ,原子数目 ,原子质量 。

课题:3.1 构成物质的基本微粒(第一课时)【教学目标】1.认识物质的微粒性:物质由微粒构成的,微粒不断运动,微粒之间有间隔,2.了解物质性质与微粒之间的关系:微粒的性质决定了物质的化学性质【教学重难点】重点:物质的微粒性与物质变化的联系难点:物质的微粒性与物质变化的联系【教具】教师用:烧杯胶头滴管长玻璃管酒精浓氨水酚酞水等等【教学过程】引入:既然要开始研究物质构成的奥秘,那么我们学会用微观的观点来观察和解释宏观的物质或现象。
实验:探究物质的可分性1.将高锰酸钾粉末取出少部分,用研钵将高锰酸钾再研碎,成为小颗粒。
2.将研磨的高锰酸钾粉末放入试管中少量,加入少量的水,发现试管中的固体颗粒逐渐变少,直至消失,3.得到的高锰酸钾溶液中,逐渐加入水,溶液的紫红色逐渐变浅,直至无色分析:1.固体颗粒为什么消失?答:高锰酸钾颗粒被“粉碎”成肉眼看不见的微粒,分散到水中。
2.溶液的颜色由深到浅,直至无色,这是为什么?答:变浅直至无色,并不是高锰酸钾消失,而是构成它的微粒太少,太小,我们看不见了。
也就是能说明高锰酸钾固体是由肉眼看不见的微粒构成的。
3.同样是高锰酸钾溶液,有的颜色深,有的颜色浅,甚至无色。
那么我们是否能说同种物质的微粒的物理性质不同?答:不能。
对于一个微粒而言,毫无物理性质之说。
也就是说,一种物质的物理性质必然是大量微粒聚集才能表现出来的。
4.日常生活中,糖水是甜的,盐水是咸的,这个现象又能说明什么问题?答:在水的作用下,构成蔗糖和食盐的微粒被分散到水中。
同样是微粒,一种是甜的,一种是咸的,说明不同物质是由不同微粒构成的,具有不同的化学性质。
总结:物质是由极其微小的、肉眼看不见的微粒构成的1.物质可以再分;2.物质是由极其微小的微粒构成的;3.不同的物质由不同的微粒构成,具有不同的化学性质,即:构成物质的微粒能保持物质的化学性质;4.构成物质的微粒不能保持物质的物理性质,物理性质是由大量微粒体现的。

构成物质的微粒有哪些
构成物质的微粒包括原子、分子和离子。
这些微粒是物质的基本组成单位,根据物质的性质和化学结构的不同,它们可以以不同的方式组合和排列。
1. 原子:原子是构成物质的最基本的微粒,是化学元素的基本单位。
每种元素都由一种特定类型的原子组成,其化学性质由其原子的结构和排列决定。
2. 分子:分子是由两个或更多个原子以共价键相连形成的结构单元。
分子可以是同一种元素的原子组成的,也可以是不同元素的原子组成的化合物。
例如,氧气分子(O2)由两个氧原子以共价键连接形成。
3. 离子:离子是由失去或获得一个或多个电子而带有电荷的原子或分子。
正离子是失去了一个或多个电子的,带有正电荷;负离子是获得了一个或多个电子的,带有负电荷。
离子通过离子键相互吸引形成化合物,如氯化钠(NaCl)中的钠离子和氯离子。
这些微粒以不同的方式组合和排列形成各种不同类型的物质,如元素、化合物和混合物。
对于理解物质的性质和行为,以及化学反应的机理和速率等方面都至关重要。
1/ 1。
第三章物质构成的奥秘第一节构成物质的基本微粒(1)阅读教材,完成以下问题:一、构成物质的微粒1.构成物质的微粒有、、。
2.由原子直接构成的物质有:(Fe、Cu、Mg)、(He、Ne)、金刚石(C)、石墨(C)、Si等。
3.由分子构成的物质有:常见气体:H2、O2、N2、、CO2、NH3、SO2、HCl等。
液体:酒精、H2O等。
固体:五氧化二磷、蔗糖等。
4.由离子构成的物质有:是由钠离子和氯离子构成的。
二、微粒的性质(一)物质是由肉眼________________的、___________的微粒构成的。
(二)微粒是不断运动的1.【观察与思考】实验1:向盛水的烧杯中滴入无色酚酞试液,得到溶液甲:现象:结论:再向其中滴入浓氨水现象:结论:实验2:在烧杯C中重新配制甲溶液。
在烧杯B中加入浓氨水,用一个大烧杯把两个小烧杯罩一起。
现象:结论:浓氨水中的氨,并进入到滴有酚酞的蒸馏水中,使溶液变红。
由上述实验得出:☆备注:浓氨水是色、有_______________味体,有性,显性,可以使色的酚酞试液变成色。
思考::a.湿衣服在阳光下比阴凉处干的快 b.相同质量的白糖在热水中溶解比在同样多的冷水中快。
两个事例说明:影响微粒运动快慢的因素是,而且越高,微粒运动的速率越,可以解释的现象有:a.湿衣服在阳光下比阴凉处干的快 b.相同质量的白糖在热水中溶解比在同样多的冷水中快。
练习1:如图所示,将滴有酚酞的滤纸条放在试管里,如图所示放在实验桌上:⑴用仪器A吸取浓氨水,滴在管口的棉花球上,仪器A的名称是,该仪器的主要用途是⑵实验中,往往在试管下放一张白纸,白纸的作用是⑶实验中,观察到的现象是这一实验说明。
(三)微粒之间有空隙1.【活动与探究】实验1:取一根约30cm长一端封口的细玻璃管,按图进行实验。
现象:结论:实验2:取一支针筒,抽取一定量的空气,用手指堵住针筒末端小孔,将栓塞慢慢推入,观察现象;用刚才的针筒抽取相同量的水,用手指堵住针筒末端小孔,将栓塞慢慢推入,观察现象。
3.1 构成物质的基本微粒(1)【学习目标】1.能认识物质的微粒性;班级:姓名:2.能用微粒的观点解释某些常见的现象。
【学习重难点】能从微观上认识微粒的性质。
【学习过程】一、微粒的性质(一)活动与探究:探究一:物质是由微粒构成的物质是由肉眼________________的、______ _____的微粒构成的。
探究二:微粒是不断运动的1.探究微粒运动的实验⑴实验1:向烧杯A中加入20mL蒸馏水,滴入2-3滴酚酞试液,得到溶液甲。
观察到的现象:_______________________________________,得到的结论:__________________________________________。
再向溶液中慢慢滴加浓氨水观察到的现象:________________________________________,得到的结论:__________________________________________。
备注:浓氨水是色、有_______________味体,有性,显性,可以使色的酚酞试液变成色。
⑵实验2:重新配制甲溶液。
在烧杯B中加入3mL-5mL浓氨水,用一个大烧杯把两烧杯的溶液罩在一起(如右图所示)观察到的现象:,产生这一现象的原因:,得到的结论:。
⑶该实验是否需要做下图1所示的对比实验,理由是,该实验做下图2所示的对比实验,其目的是。
2.总结:微粒是在不断地的。
⑴下列事件可以用此解释的现象有:,不能解释的现象有: (填字母),a.花园里闻到花香b.落叶纷纷c.长期堆煤的墙变黑了d.尘土飞扬e.雪花飘飘f.柳絮轻飞g.糖放到水里,溶解了。
⑵影响微粒运动快慢的因素是,越高,微粒运动的速率越,可以解释的现象有:a.湿衣服在阳光下比阴凉处干的快b.相同质量的白糖在热水中溶解比在同样多的冷水中快。
探究三:微粒之间有空隙1.探究微粒之间有空隙的实验⑴【实验1】,可以观察到的现象:其液体体积会(填“增大”“减小”或“不变”),可以得到的结论:构成物质的微粒之间都有一定的________,不同微粒之间的空隙____(填“相同”或“不同”)。