2012年中考化学第一轮复习 专题3 物质的分类和分离
- 格式:ppt
- 大小:2.81 MB
- 文档页数:37

精品基础教育教学资料,仅供参考,需要可下载使用!中考化学一轮复习考点讲解:物质的分类及构成物质的微粒一、物质分类(一)基本概念1、混合物:宏观,由两种或两种以上物质组成的;微观,由两种或两种以上分子构成的。
举例:空气、溶液和合金等。
注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物、混合物与组成元素的种类无关。
即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净物或混合物。
2、纯净物:宏观,由一种物质组成的;微观,由一种分子构成的。
举例:蒸馏水、氧气和冰水混合物。
3、单质:由一种元素组成的纯净物。
举例:金、金刚石、氢气和氧气等。
注意:(1)分为:金属单质;非金属固体单质;稀有气体单质。
(2)由一种元素组成的物质,不一定是单质,有可能是混合物,有可能是单质。
4、化合物:由两种或两种以上元素组成的纯净物。
举例:过氧化氢、二氧化碳等。
5、有机物:含有碳元素的化合物叫做有机化合物,简称有机物。
举例:甲烷(最简单的有机物)、乙醇和醋酸等。
注意:但是CO、CO2、H2CO3和碳酸盐具有无机物的特点,通常把它们看做无机物。
6、无机物:除有机物以外的其他化合物统称为无机化合物,简称无机物。
举例:碳酸钠、硝酸银和硫酸钡等。
7、氧化物:由两种元素组成的化合物,其中一种元素是氧。
举例:二氧化碳、过氧化氢等。
注意:含氧化合物是含有氧元素的化合物,包含氧化物。
8、酸:电离时形成的阳离子全部是氢离子的化合物。
举例:盐酸、硫酸和碳酸等。
注意:酸溶液的pH值小于7,通常化学式的第一种元素是“H”,酸由氢和酸根离子组成,紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色。
9、碱:电离时形成的阴离子全部是是氢氧根离子的化合物。
举例:氢氧化钠、氢氧化钙和氢氧化钡等。
10、盐:由金属阳离子或铵根离子和酸根离子构成的化合物。
举例:硝酸铵、碳酸钙和硫酸钡等。
(二)、物质分类金属单质混合物根据所含单质元素种类非金属单质根据所含稀有气体单质物质物质种类根据所含有机物纯净物元素种类根据氧化物化合物有无C 酸无机物碱盐二、原子(一)原子发现史1、道尔顿:原子不可再分,是最小的实心球体。
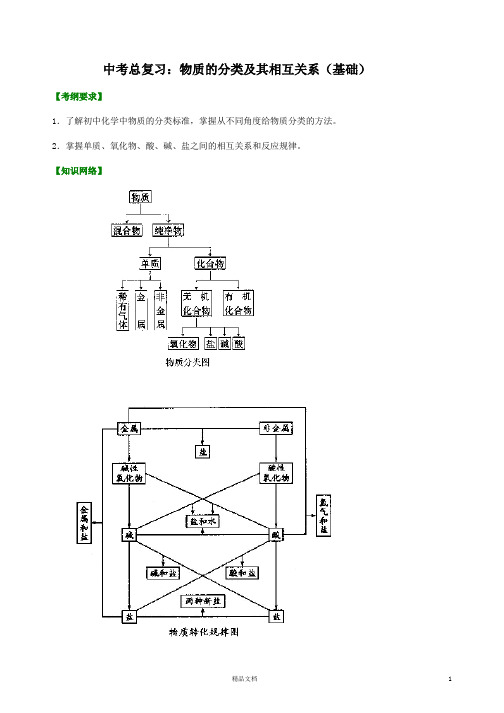
中考总复习:物质的分类及其相互关系(基础)【考纲要求】1.了解初中化学中物质的分类标准,掌握从不同角度给物质分类的方法。
2.掌握单质、氧化物、酸、碱、盐之间的相互关系和反应规律。
【知识网络】【考点梳理】考点一、物质的分类1.物质分类图:(同本知识导学【知识网络】中“物质分类图”)对物质分类时,一般应从三个层面上去认识。
首先看它是一种单一的物质还是由不同物质混合而成的,从而把它们分为纯净物或混合物,再看它是一种元素还是由多种元素组成的,将其分成单质或化合物,第三根据物质的组成元素和性质的特点,继续进行分类:有机物、无机物,无机物中又分酸、碱、盐、氧化物等。
2.认识氧化物注意以下三点:(1)氧化物是一类特殊的化合物,又分为金属氧化物和非金属氧化物。
判断是否为氧化物必须满足三个条件:①是纯净物;②由两种元素组成;③含有氧元素。
三个条件缺一不可。
(2)含氧化合物并不一定是氧化物。
含氧化合物是含有氧元素的化合物,是由两种或两种以上元素组成的,含氧化合物包括氧化物。
(3)水(H2O)是一种特殊的氧化物,是相对分子质量最小的氧化物,与一些金属氧化物反应生成碱(碱必须是可溶的或微溶的),与某些非金属氧化物反应生成酸。
【要点诠释】1.混合物一定由多种物质组成,但不一定由多种元素组成。
例如氧气和臭氧混合,属于混合物,但其中只有一种元素,所以判断纯净物、混合物唯一的标准是一种成分还是多种成分。
2.对单质和化合物概念进行辨析时,一定要紧扣“纯净物”这一前提,离开这一前提谈单质、化合物是不成立的。
3.单质一定由同种元素组成,但由同种元素组成的物质不一定是单质。
如O2和O3的混合物都是氧元素组成,但它不是单质,而是混合物,所以单质、化合物的前提一定是纯净物。
4.有机物里一定含碳元素,但含碳元素的化合物不一定是有机物,如CO、CO2、Na2CO3等都属于无机物。
考点二、不同类物质的相互关系1.单质、氧化物、酸、碱、盐的相互关系:(1)图中每一条线都表示各种物质间的相互关系。




第九章物质的分类【考纲导读】1.区别典型的混合物、纯净物2.会使用过滤、蒸发的方法对混合物进行分离3.运用化合价书写简单的、常见物质的化学式4.根据化学式推断元素的化合价5.能列举化学式表示的意义6.区别典型的酸、碱、盐、氧化物,说出典型物质的名称7.会计算物质的相对分子质量8.熟练计算化合物中元素质量分数和质量比备注:不考酸式盐、碱式盐,酸性氧化物、碱性氧化物的分类和命名【知识精讲】一、物质的分类1.物质混合物,如空气(由氧元素、氮元素等组成)纯净物单质,如氧气,氮气等化合物,如二氧化碳等2.混合物的分离过滤蒸发内容将不溶于液体的固体分离将溶于液体的固体物质与液体分离实例分离水中泥沙粗盐提纯要点“一贴”、“二低”、“三靠”、玻璃棒作用:搅拌、引流、使受热均匀1.化合价:是元素在化学反应中离子形式的反映,也是离子结合的数据依据。
常见元素化合价口诀:一价氢氯钾钠银,二价氧钡钙镁锌,三铝四硅五氮磷,二三铁,二四碳,二四六硫价齐全,铜汞二价最常见,金属为正,非金属为负,莫忘单质价为零。
物质整体不显电性,因此化合价为零。
化合物中元素较多时,常通过化合价单一的元素来推断化合价多变的元素。
2.化学式:由实验测得的用元素符号表示物质组成,只有纯净物才有化学式。
化学式的意义(以水H2O为例):(1)表示某种物质,表示水;(2)表示该物质的元素组成(表示水由氢元素和氧元素组成);(3)表示该物质的一个分子(表示一个水分子);(4)表示一个分子的原子构成(表示一个水分子由两个氢原子和一个氧原子组成);(5)表示分子的相对原子质量(水的相对原子质量为2×1+16=18)。
三名称含高价金属(或铵)离子含低价金属离子酸“某酸”或“氢某酸”碱“氢氧化某”“氢氧化亚某”盐“某化某”或“某酸某”“某化亚某”或“某酸亚某”氧化物“氧化某”或“几氧化几某”“氧化亚某”四1.计算相对分子质量:化学式中各元素的相对原子质量之和。
中考总复习:物质的分类及其相互关系【考纲要求】1.了解初中化学中物质的分类标准,掌握从不同角度给物质分类的方法。
2.掌握单质、氧化物、酸、碱、盐之间的相互关系和反应规律。
【知识网络】【考点梳理】考点一、物质的分类(专题课堂《对化学物质的再认识》)1.物质分类图:(同本知识导学【知识网络】中“物质分类图”)对物质分类时,一般应从三个层面上去认识。
首先看它是一种单一的物质还是由不同物质混合而成的,从而把它们分为纯净物或混合物,再看它是一种元素还是由多种元素组成的,将其分成单质或化合物,第三根据物质的组成元素和性质的特点,继续进行分类:有机物、无机物,无机物中又分酸、碱、盐、氧化物等。
2.认识氧化物注意以下三点:(1)氧化物是一类特殊的化合物,又分为金属氧化物和非金属氧化物。
判断是否为氧化物必须满足三个条件:①是纯净物;②由两种元素组成;③含有氧元素。
三个条件缺一不可。
(2)含氧化合物并不一定是氧化物。
含氧化合物是含有氧元素的化合物,是由两种或两种以上元素组成的,含氧化合物包括氧化物。
(3)水(H2O)是一种特殊的氧化物,是相对分子质量最小的氧化物,与一些金属氧化物反应生成碱(碱必须是可溶的或微溶的),与某些非金属氧化物反应生成酸。
【要点诠释】1.混合物一定由多种物质组成,但不一定由多种元素组成。
例如氧气和臭氧混合,属于混合物,但其中只有一种元素,所以判断纯净物、混合物唯一的标准是一种成分还是多种成分。
2.对单质和化合物概念进行辨析时,一定要紧扣“纯净物”这一前提,离开这一前提谈单质、化合物是不成立的。
3.单质一定由同种元素组成,但由同种元素组成的物质不一定是单质。
如O2和O3的混合物都是氧元素组成,但它不是单质,而是混合物,所以单质、化合物的前提一定是纯净物。
4.有机物里一定含碳元素,但含碳元素的化合物不一定是有机物,如CO、CO2、Na2CO3等都属于无机物。
考点二、不同类物质的相互关系1.单质、氧化物、酸、碱、盐的相互关系:(1)图中每一条线都表示各种物质间的相互关系。