NADP-分析方法
- 格式:doc
- 大小:66.00 KB
- 文档页数:3

生命大分子常用测定方法生物大分子常用测定方法二、常用的测定方法1.光谱法2.电化学法3.生物活性检测法4.免疫分析法5.生物传感器1 光谱法(1)吸收光谱法[①直接测定法;②比色法](2)荧光法(3)浊度法特点:测定时所需的样品量较少,但往往能产生比较高的消光值;且操作简单,反应迅速、灵敏;结果也较准确,(1)吸收光谱法直接测定法、比色法①直接测定法将待测物(如核酸、蛋白质)配制成一定浓度的溶液后,移至相应波长的分光光度计中,即可从测定的消光值换算出待测物的含量。
A.测定核酸含量构成核酸的碱基组分是分光光度计测定核酸含量的依据。
在测定过程中,DNA或RNA溶液浓度的增加或降低,会使其在波长260nm的消光值(A260) 随之增加或降低,二者之间成正比关系。
通常1个A260值分别相当于双链DNA 50μg/ml单链DNA 37μg/ml单链RNA 40μg/ml用A260/A280比值可确定DNA和RNA的纯度:纯DNA比值为1.8纯RNA的比值为2.0当此比值分别小于1.8和2.0时,表明样品中已污染了蛋白质或酚类等物质。
B.测定蛋白质的含量及纯度蛋白质(包括酶和肽)溶液的A280值主要是由构成蛋白质组分的色氨酸(Trp)和酪氨酸(Tyr)的消光值决定的,胱氨酸的贡献很小。
②比色法将待测物(如蛋白质、核酸、糖类)与相关试剂(见表1-2)或酶的底物作用后,根据呈现的颜色或形成的产物特性,移至相应波长的分光光计中,即可从测定的消光值换算出待测物的含量。
例如:邻苯二酚(在275nm有吸收峰)+ 邻苯二酚-2,3-双加氧酶黄色的α- 羟基粘康酸半醛(在375nm有吸收峰)通过检测375nm消光值的升高即可换算出所用酶的活力。
还可用不同消光值之间的比值鉴定某些物质的纯度例如纯细胞色素c还原型A550/氧化型A280比值为1.25~ 1.28。
假如比值过高或过低,就表明细胞色素C中污染了杂质。
(2)荧光法特点:荧光法的精确性、重复性和灵敏度比吸收光谱法好。

细胞代谢组学中的定量分析与生化组分分析研究细胞代谢组学是研究细胞的代谢物质组成和代谢通路的一门学科。
其中,定量分析和生化组分分析是非常重要的研究方法。
本文将结合实际案例,介绍这两种方法在细胞代谢组学领域的应用和意义。
一、定量分析定量分析是指测定样品中某种物质的含量。
在细胞代谢组学中,我们可以利用这种方法来研究细胞中代谢物质的变化情况。
例如,在一项研究中,研究人员利用定量分析的方法,测定了小麦根尖细胞中ATP/ADP和NADPH/NADP+比值的变化情况。
结果显示,小麦根尖细胞在发芽早期,ATP/ADP和NADPH/NADP+比值都有明显的升高。
这表明这时期小麦根尖细胞的代谢物质的生产活跃度较高,也为后续的生长提供了足够的能量和还原力。
定量分析的方法有很多,其中最常用的便是色谱法和质谱法。
色谱法可以将样品中的混合物分离成各种组分,并可测定各组分的浓度或含量。
质谱法则可以测量样品中不同化合物的分子量。
这两种方法的优点在于,它们可以同时解决复杂的样品,且具有高灵敏度和高精确度。
二、生化组分分析生化组分分析是指通过测定组成物质的各种物理和化学性质来确定其组成成分的方法。
在细胞代谢组学中,我们可以使用生化组分分析的方法,进一步研究代谢物质的组成和含量。
例如,利用气相色谱-质谱联用技术,我们可以分析出细胞中葡萄糖、丙酮酸、乳酸等小分子代谢产物的组成比例。
这种方法可以帮助我们更全面地了解细胞的代谢情况,为进一步深入探究代谢通路提供数据支持。
与定量分析类似,生化组分分析的方法也有很多,例如核磁共振法、毛细管电泳法等。
不同的方法适用于不同的样品和目的。
三、典型案例一个有趣的案例是研究人员利用定量分析和生化组分分析,研究酵母细胞代谢的变化。
他们将酵母进行了不同的处理,然后在不同时间点(1、2、4、6、8小时)进行了样品采集和分析。
定量分析的结果显示,在胁迫条件下,酵母细胞中葡萄糖的含量减少,而丙酮酸和乳酸的含量增加。

生化分析仪常用分析方法共有三大类,分不为终点法、固定时刻法和动力学法。
终点法:指通过一段时刻的反响,反响到达平衡,由于反响的平衡常数特别大,可认为全部底物(被测物)转变成产物,反响液的吸光度不再变化,只与被测物的浓度有关。
这类方法通常称为“终点〞法,更确切地讲应称“平衡〞法。
单试剂单波长终点法:t1时刻参加试剂〔体积为V〕,t2刻参加样本〔体积为S〕,然后搅拌并反响,之后开始测量反响液的吸光度,在t3时刻反响到达终点,t3-t2为测定时刻。
反响度R=At3-At2-1×V/(V+S),或R=At3-ARBLK。
其中:Ati为i时刻的吸光度,ARBLK为试剂空白吸光度。
单试剂双波长终点法:全然上同“单试剂单波长终点法〞,只是关于每一个测定周期,事实上际吸光度等于Aλ1-Aλ2。
双试剂单波长终点法:t1时刻参加第一试剂(体积为V1),t2时刻参加样本(体积为S)之后立即搅拌,t3时刻参加第二试剂(体积为V2)并立即搅拌,t4时刻反响到达终点。
t3-t2为孵育时刻,t4-t3为测定时刻。
在工程参数中,要是反响起始时刻设为0,那么反响度R=A时刻吸光度-双试剂空白吸光度。
要是反响起始时刻小于0,那么反响度R=At4-双试剂空白吸光度-t3到t2间设定点的吸光度×〔V1+S〕/(V1+S+V2)。
双试剂双波长终点法:全然上同“双试剂单波长终点法〞,只是关于每一个测定周期,事实上际吸光度等于Aλ1-Aλ2。
固定时刻法:又称为一级动力学法、二点动力学法等,指在一定的反响时刻内,反响速度与底物浓度的一次方成正比,即v=k[S]。
由于底物在不断的消耗,因此整个反响速度在不断的减小,表现为吸光度的变化越来越小。
这类反响到达平衡的时刻特别长,理论上能够在任意时刻段进行监测,但由于血清成份复杂,反响刚启动时反响较复杂,杂反响较多,必需通过一段延迟时刻才能进进稳定反响期。
t1时刻参加试剂(体积为V),之后测量试剂空白的吸光度,t2时刻参加样本(体积为S),t3时刻反响稳定,t4时刻停止对反响进行监测;t2-t3为延迟时刻,t3-t4为测定时刻。

一、实验目的1. 了解还原酶的催化作用原理。
2. 掌握测定还原酶活性的实验方法。
3. 通过实验验证还原酶在不同条件下的活性变化。
二、实验原理还原酶是一类能够催化氧化还原反应的酶,在生物体内具有重要作用。
本实验以葡萄糖-6-磷酸为底物,在还原酶的催化下,葡萄糖-6-磷酸被还原成葡萄糖-6-磷酸还原物,同时产生NADPH。
NADPH在氧化还原反应中起到传递电子的作用。
通过测定NADPH的生成量,可以反映还原酶的活性。
三、实验材料与仪器1. 材料:新鲜叶片、0.1M磷酸缓冲液、0.2M葡萄糖-6-磷酸、0.2M NADP+、0.1M NADP+、蒸馏水、无水乙醇、3,5-二硝基水杨酸、NaOH、硫酸铜、碘化钾、淀粉溶液。
2. 仪器:恒温水浴锅、分光光度计、移液枪、烧杯、试管、容量瓶、剪刀、电子天平、研钵、滤纸等。
四、实验步骤1. 样品制备:取新鲜叶片,用剪刀剪成小片,称取0.5g,放入研钵中,加入少量蒸馏水,研磨成匀浆。
将匀浆过滤,收集滤液。
2. 样品处理:取一定量的滤液,加入等体积的95%乙醇,混匀,静置10min,离心分离。
取上清液作为还原酶样品。
3. 还原酶活性测定:(1)取6支试管,编号为1-6,分别加入0.1M磷酸缓冲液、0.2M葡萄糖-6-磷酸、0.2M NADP+、还原酶样品、蒸馏水。
(2)将试管置于恒温水浴锅中,保温5min。
(3)加入0.1M NADP+,立即启动计时器,每隔30s取出一支试管,加入3,5-二硝基水杨酸和NaOH溶液,混匀,于540nm波长下测定吸光度。
4. 数据处理:以吸光度为纵坐标,时间为横坐标,绘制还原酶活性曲线。
五、实验结果与分析1. 还原酶活性曲线:根据实验数据绘制还原酶活性曲线,观察还原酶在不同时间下的活性变化。
2. 还原酶活性影响因素:通过改变实验条件,如温度、pH值等,观察还原酶活性变化,分析还原酶活性的影响因素。
六、实验结论1. 本实验成功测定了还原酶的活性,验证了还原酶的催化作用原理。

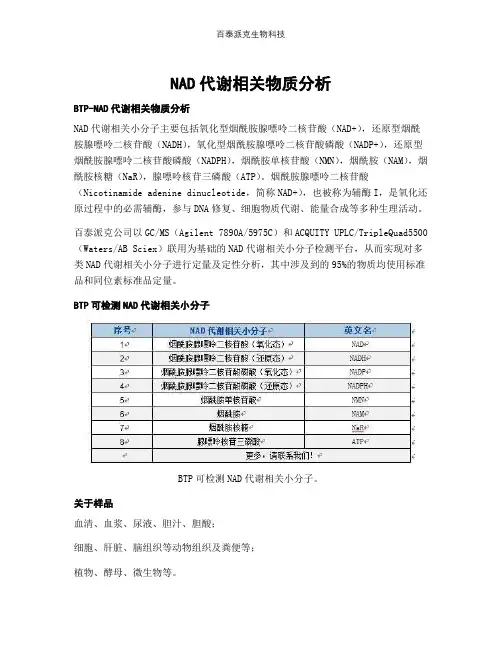
NAD代谢相关物质分析BTP-NAD代谢相关物质分析NAD代谢相关小分子主要包括氧化型烟酰胺腺嘌呤二核苷酸(NAD+),还原型烟酰胺腺嘌呤二核苷酸(NADH),氧化型烟酰胺腺嘌呤二核苷酸磷酸(NADP+),还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),烟酰胺单核苷酸(NMN),烟酰胺(NAM),烟酰胺核糖(NaR),腺嘌呤核苷三磷酸(ATP)。
烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,简称NAD+),也被称为辅酶I,是氧化还原过程中的必需辅酶,参与DNA修复、细胞物质代谢、能量合成等多种生理活动。
百泰派克公司以GC/MS(Agilent 7890A/5975C)和ACQUITY UPLC/TripleQuad5500(Waters/AB Sciex)联用为基础的NAD代谢相关小分子检测平台,从而实现对多类NAD代谢相关小分子进行定量及定性分析,其中涉及到的95%的物质均使用标准品和同位素标准品定量。
BTP可检测NAD代谢相关小分子BTP可检测NAD代谢相关小分子。
关于样品血清、血浆、尿液、胆汁、胆酸;细胞、肝脏、脑组织等动物组织及粪便等;植物、酵母、微生物等。
样本需求量:血样、胆汁等:10微升。
各种组织:10毫克。
粪便等:10毫克。
其它样本类型及用量请与百泰派克销售联系。
样品运输:以3-4公斤干冰挥发一天计算,请使用足量的干冰运输(建议尽量选用较大块的干冰,大块的干冰挥发较慢),并用泡沫盒封闭。
并且尽量选用较快的邮递方式,以降低运输过程中样品降解的可能性。
中/英文项目报告在技术报告中,百泰派克会为您提供详细的中英文双语版技术报告,报告包括:1.实验步骤(中英文)。
2.相关的质谱参数(中英文)。
3.鉴定物质的定量或定量信息。
4.质谱图片。
5.原始数据。
BTP-NAD代谢相关物质分析一站式服务您只需下单-寄送样品百泰派克一站式服务完成:样品处理-上机分析-数据分析-项目报告。
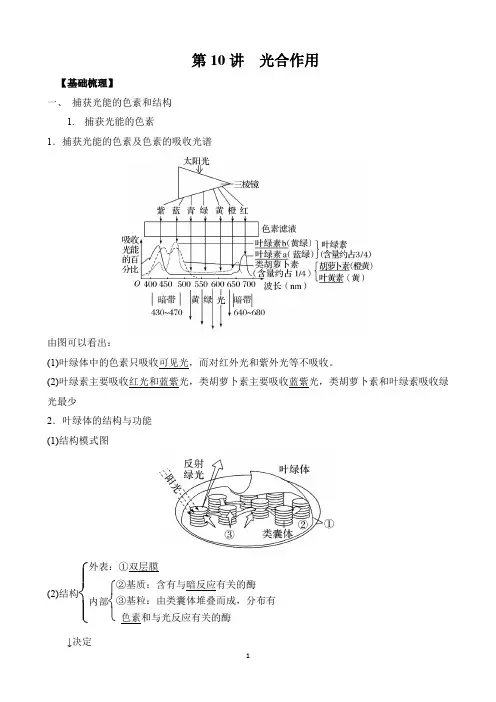
第10讲 光合作用【基础梳理】一、 捕获光能的色素和结构1. 捕获光能的色素1.捕获光能的色素及色素的吸收光谱由图可以看出:(1)叶绿体中的色素只吸收可见光,而对红外光和紫外光等不吸收。
(2)叶绿素主要吸收红光和蓝紫光,类胡萝卜素主要吸收蓝紫光,类胡萝卜素和叶绿素吸收绿光最少2.叶绿体的结构与功能 (1)结构模式图(2)结构⎩⎪⎨⎪⎧外表:①双层膜内部⎩⎨⎧ ②基质:含有与暗反应有关的酶③基粒:由类囊体堆叠而成,分布有色素和与光反应有关的酶↓决定(3)功能:进行光合作用的场所。
3.探究光合作用经典实验中的对照和变量及实验结论例1:下列有关光合作用探究历程的叙述,正确的是()A. 英格豪斯认为密闭玻璃罩中蜡烛熄灭的根本原因是缺乏足够的O2B. 萨克斯的实验中叶片曝光的一半变蓝,说明叶绿体在光下产生了淀粉C. 鲁宾和卡门只用18O标记H2O,证明了光合作用释放的O2都来自水D. 恩格尔曼的水绵实验利用了好氧细菌的生理特点作为因变量观测指标例2:如图是在电子显微镜下观察到的高等植物叶绿体结构模式图,下列有关叙述错误的是()A.①和②均为选择透过性膜B.③上分布有与光反应有关的色素和酶,这些色素对绿光吸收最少C.③上所含色素均含Mg2+,故缺Mg2+时这些色素都无法合成D.在③上形成的产物[H]和A TP进入④中为暗反应提供物质和能量二、光合作用的基本过程1.概念光合作用指绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存着能量的有机物,并且释放出氧气的过程。
光合作用分为光反应阶段和暗反应阶段,二者密切相关。
2.过程3.反应式(1)产物为(CH 2O):CO 2+H 2O――→光能叶绿体(CH 2O)+O 2。
(2)产物为C 6H 12O 6:6CO 2+12H 2O――→光能叶绿体C 6H 12O 6+6O 2+6H 2O 。
4.光反应和暗反应的比较光反应为暗反应提供两种重要物质:ATP 和[H](NADPH)。


L i n y e g u o s h u苹果轮纹病是我国苹果产区普遍发生的一种重要病害,在我国山东、陕西、甘肃、河北等地均有发生,尤其是在老产区,其危害严重。
目前,苹果轮纹病的防治以化学药剂为主,但由于其具有较强的抗药性,再加上目前生产中仍存在着对其认识不足、管理措施不到位等问题,导致我国苹果产业面临着巨大的挑战。
因此,需要对其进行深入研究与探索。
本文以山东省为例,对苹果轮纹病的发生规律、发病特点及其防治措施进行了总结分析,以期望能够为相关人员提供借鉴。
一、苹果轮纹病发生规律苹果轮纹病是由半知菌亚门真菌引起的一种危害严重的病害,主要危害叶片、果实以及枝干等,该病的发生与气候、品种以及栽培管理等因素密切相关。
近几年来,苹果轮纹病在山东发生较为严重。
根据对苹果轮纹病病害的发生规律和当地气候特点进行分析,笔者认为该病害主要危害3种类型的叶片和果实,在苹果花期最易发病。
春季温度超过18℃后,会导致病菌大量繁殖,当温度超过30℃时,则会导致病菌大量死亡。
进入5~6月份后,正是降雨天气最多的季节。
由于此时期气候潮湿,光照不足,降雨频繁且持续时间长,会导致果园内湿度大,适宜病菌的生存与繁殖。
同时随着雨水的增加以及空气湿度的增加,将会导致病菌大量繁殖、为害。
在此期间若降雨较多或持续时间长,则会导致该病害进一步扩散蔓延。
在此期间若降雨较少或持续时间短,则会导致该病害难以扩散蔓延。
此外,由于在山东省内苹果轮纹病的发生具有一定的规律性和地域性,因此其主要在苹果适生区(如胶东半岛、大连市中山区、鲁西南丘陵等)发生较为严重。
另外该病害还具有明显的季节性特征。
通过对苹果轮纹病在山东省不同地区的发生情况进行分析,发现苹果轮纹病菌的优势菌系为半知菌亚门真菌,在此优势菌系中,不同品种对该病的抗性存在明显差异。
例如,在山东省不同地区对苹果轮纹病菌进行调查发现,山东东部地区(包括烟台、威海等地)和西部地区(包括临沂、日照等地)的苹果轮纹病发生较为严重,且该病菌均为真菌。

自动生化分析技术一、分析方法分类(一)终点法被测物质在反应过程中完全被转变为产物,即达到反应终点,根据终点吸光度的大小求出被测物浓度,称为终点法(end essay)。
实际上被测物并没有完全被转变,而只是与产物达到一个动态的化学平衡,因此该法称为平衡法更为恰当。
从时间-吸光度曲线来看,到达反应终点或平衡点时,吸光度将不再变化。
分析仪通常在反应终点附近连续选择两个吸光度值,求出其平均值计算结果,并可根据两点的吸光度差来判断反应是否到达反应终点。
终点法参数设置简单,反应时间一般较长,精密度较好。
终点时间的确定:①根据时间-吸光度曲线来确定,如Trinder反应测定尿酸,反应曲线上3~5min时其吸光度已趋向稳定,因而可将5min作为反应终点。
②根据被测物反应终点,结合干扰物的反应情况来确定,如在血清白蛋白的溴甲酚绿法测定中,白蛋白与溴甲酚绿在10s内很快完成反应,之后α球蛋白和β球蛋白与溴甲酚绿发生"慢反应",使反应曲线上吸光度在10s后仍继续缓慢上升,持续约达10min,因此终点时间应采用10~30s,而不应选择10min。
1.一点终点法在反应到达终点,即在时间-吸光度曲线上吸光度不再改变时选择一个终点吸光度值,这种方法称为一点终点法(one point end essay),其反应曲线见图7-3。
其检测结果的计算公式是:待测物浓度CU=(待测吸光度AU-试剂空白吸光度AB)×K。
K为校准系数,详见第五节二操作方法。
2.两点终点法在被测物反应或指示反应尚未开始时,选择第一个吸光度,在反应到达终点或平衡时选择第二个吸光度,此两点吸光度之差用于计算结果,称为两点终点法(two point end essay),其反应曲线见图7-4。
计算公式为CU=(待测吸光度A2-待测吸光度A1)×K。
该法能有效地消除溶血(hemolysis)、黄疸(icterus)和脂浊(lipo-turbid)等样品本身光吸收(见图7-5)造成的干扰。

nad激酶试验方案
一、目的
本试验旨在测定生物样品中NAD激酶的活性,以评估其生物活性和功能。
二、原理
NAD激酶是一种在生物体内发挥重要功能的酶,它能够将NAD+磷酸化成为NADP+。
本试验通过监测样品中NAD激酶催化NAD+生成NADP+的过程,计算酶的活性。
三、操作步骤
1.准备试剂和样品:准备好所需的试剂,如磷酸盐缓冲液、NAD+、NAD激酶等,
并将生物样品进行适当处理。
2.建立反应体系:在适当的试管中加入磷酸盐缓冲液、NAD+和生物样品,混合均
匀。
3.加入NAD激酶:将适量的NAD激酶加入反应体系中,启动反应。
4.反应孵育:将反应体系在适宜的温度下孵育一定时间,使NAD激酶充分催化
NAD+生成NADP+。
5.终止反应:在反应达到预定时间后,加入适量的终止液,终止反应的进行。
6.测定NADP+:通过适当的方法(如分光光度法或高效液相色谱法)测定反应体
系中NADP+的含量。
7.计算酶活性:根据测定的NADP+含量,计算出NAD激酶的活性。
四、注意事项
1.确保所有试剂和样品均处于适宜的温度和pH值范围内,以保证酶活性的正常发
挥。
2.在操作过程中要避免污染,以免影响实验结果。
3.对于不同的生物样品,其最佳反应条件可能有所不同,需根据实际情况进行调整。
4.对于分光光度法测定NADP+含量的方法,需注意选择合适的波长和消除干扰物
质的影响。
5.在计算酶活性时,需考虑样品中其他物质对实验结果的影响,进行适当的校正。
NADP分析方法一、范围本标准规定了β-烟酰胺腺嘌呤二核苷酸磷酸二钠盐的质量指标及检验方法。
结构式:中文名:β-烟酰胺腺嘌呤二核苷酸磷酸二钠盐英文名称:β-Triphosphopyridine nucleotide disodium saltCAS号:24292-60-2分子式:C21H26N7Na2O17P3分子量:787.37二、质量指标三、检测项目3.1 含量(HPLC)仪器岛津20AT HPLC试剂1.甲醇HPLC级li-Q 水3.三氟乙酸HPLC级5.NADP对照品色谱条件色谱柱:Agilent SB-C18 5µm 4.6*250mm洗脱程序:梯度流速:0.8 mL/min分析时间:21 min检测波长:260 nm进样体积:5uL柱温:25 ℃保留时间:7.9min梯度程序流动相A0.1%三氟乙酸:准确量取1 mL三氟乙酸溶于1L去离子水中,抽滤并超声脱气15 min后做为流动相A。
流动相BHPLC 级甲醇对照溶液精密称取50 mg NADP标准品于100 mL容量瓶中,用去离子水溶解并定容至刻度。
样品溶液精密称取50 mg NADP样品于100 mL容量瓶中,用去离子水溶解并定容至刻度。
进样程序数据处理,样样%100m nf A %X A c f stdstd ⨯∙∙==C std ::对照品浓度 A std :对照品峰面积 A 样:样品峰面积 n :稀释倍数m 样:样品称样量 图谱3.2 pH 值测定精密称取50 mg NADP 样品于100 mL 容量瓶中,用去离子水溶解并定容至刻度,利用pHS-3C 型pH 计测定pH 值(操作见pHS-3C 型pH 计SOP )。
3.3 水分测定精密称取50 mg NADP 样品,放入卡尔费休水分滴定仪中(操作见卡尔费休水分滴定仪SOP ),记录结果。
起草人: 审核人: 批准人:。
常见的氧化损伤生物标记物分析技术分类介绍氧化应激(Oxidative Stress,OS)是指体内氧化与抗氧化作用失衡的一种状态,倾向于氧化,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物。
氧化应激是由自由基在体内产生的一种负面作用,并被认为是导致衰老和疾病的一个重要因素。
氧化应激可通过测量活性氧(ROS)来直接评估,或通过过度产生的ROS对脂质,蛋白质和核酸造成的相关损害来间接评估。
尽管直接测量ROS是理想的方法,但是与ROS的瞬时特性相比,通常更依赖于间接方法因为生物分子上的损伤标记相对稳定。
以下是用于检测最常见的氧化损伤生物标记物的分析技术的分类。
ROS:氧气作为正常代谢的一部分被电子还原,导致形成各种ROS,包括过氧化氢(H2O2)和超氧化物(O2•-)。
当不受控制的氧化对生物系统造成压力时,会对细胞大分子造成损害。
ROS的测定不能识别ROS 产生的来源(即正常状态与疾病状态),但是如果实验模型处于压力下,则ROS可能增加并且分子成分改变。
过氧化氢分析试剂盒Hydrogen Peroxide Cell-Based Assay Kit,#600050利用ADHP(灵敏稳定的H2O2探针),并包含过氧化氢酶以检查试验的特异性。
RNS:在氧化应激过程中也会产生活性氮(RNS)。
由一氧化氮合酶(NOS)和O2•-合成的高含量一氧化氮(NO•)导致过氧亚硝酸盐的形成。
NO•本身也与硫醇和铁硫酶反应,而过氧亚硝酸盐与酪氨酸残基反应形成硝基酪氨酸。
Nitrate/Nitrite Colorimetric Assay试剂盒Nitrate/Nitrite Colorimetric Assay Kit,#780001将少量添加的NADPH与催化系统结合使用,将用过的NADP+循环回NADPH以避免NADPH干扰Griess试剂的化学性质;对于血浆和尿液等液体的分析非常有效,但不能通过体外NOS分析(添加了过量的NADPH)进行NO2-和NO3-分析。