金属盐溶解度表
- 格式:xls
- 大小:135.00 KB
- 文档页数:40
化合物的溶度积常数表化学溶解性表常见物质溶解性CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=B aSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体合成氨工业和硝酸的生产密切相关,氨和空气混合后,通过铂铑合金网(催化剂)便被氧化为一氧化氮。
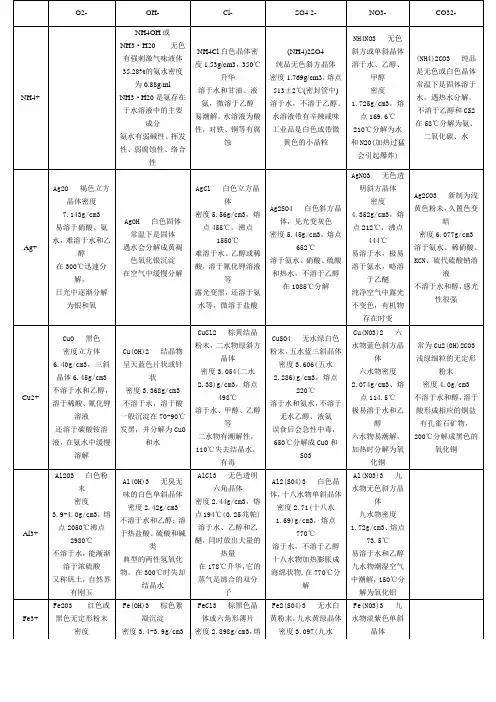
O2- OH- Cl- SO4 2- NO3- CO32-NH4+NH4OH或NH3·H20 无色有强刺激气味液体35.28%的氨水密度为0.88g/mlNH3·H20是氨存在于水溶液中的主要成分氨水有弱碱性、挥发性、弱腐蚀性、络合性NH4Cl白色晶体密度1.53g/cm3,350℃升华溶于水和甘油、液氨,微溶于乙醇易潮解。
水溶液为酸性,对铁、铜等有腐蚀(NH4)2SO4纯品无色斜方晶体密度1.769g/cm3,熔点513±2℃(密封管中)溶于水,不溶于乙醇。
水溶液带有辛辣咸味工业品是白色或带微黄色的小晶粒NH4NO3 无色斜方或单斜晶体溶于水、乙醇、甲醇密度1.725g/cm3,熔点169.6℃210℃分解为水和N2O(加热过猛会引起爆炸)(NH4)2CO3 纯品是无色或白色晶体常温下是固体溶于水,遇热水分解。
不溶于乙醇和CS2在58℃分解为氨、二氧化碳、水Ag+ Ag2O 褐色立方晶体密度7.143g/cm3易溶于硝酸、氨水,难溶于水和乙醇在300℃迅速分解,日光中逐渐分解为银和氧AgOH 白色固体常温下是固体遇水会分解成黄褐色氧化银沉淀在空气中缓慢分解AgCl 白色立方晶体密度5.56g/cm3,熔点455℃,沸点1550℃难溶于水、乙醇或稀酸,溶于氰化钾溶液等露光变黑,还溶于氨水等,微溶于盐酸Ag2SO4 白色斜方晶体,见光变灰色密度5.45g/cm3,熔点652℃溶于氨水、硝酸、硫酸和热水,不溶于乙醇在1085℃分解AgNO3 无色透明斜方晶体密度4.352g/cm3,熔点212℃,沸点444℃易溶于水,极易溶于氨水,略溶于乙醚纯净空气中露光不变色,有机物存在时变Ag2CO3 新制为浅黄色粉未,久置色变暗密度6.077g/cm3溶于氨水、稀硝酸、KCN、硫代硫酸钠溶液不溶于水和醇,感光性很强Cu2+CuO 黑色密度立方体6.40g/cm3,三斜晶体6.45g/cm3不溶于水和乙醇,溶于稀酸、氰化钾溶液还溶于碳酸铵溶液,在氨水中缓慢溶解Cu(OH)2 结晶物呈天蓝色片状或针状密度3.368g/cm3不溶于水,溶于酸一般沉淀在70-90℃发黑,并分解为CuO和水CuCl2 棕黄结晶粉末,二水物绿斜方晶体密度3.054(二水2.38)g/cm3,熔点498℃溶于水、甲醇、乙醇等二水物有潮解性,110℃失去结晶水,有毒CuSO4 无水绿白色粉末,五水蓝三斜晶体密度3.606(五水2.286)g/cm3,熔点220℃溶于水和氨水,不溶于无水乙醇、液氨误食后会急性中毒,650℃分解成CuO和SO3Cu(NO3)2 六水物蓝色斜方晶体六水物密度2.074g/cm3、熔点114.5℃极易溶于水和乙醇六水物易潮解,加热时分解为氧化铜常为Cu2(OH)2CO3浅绿细粒的无定形粉末密度4.0g/cm3不溶于水和醇,溶于酸形成相应的铜盐有孔雀石矿物,200℃分解成黑色的氧化铜Al3+Al2O3 白色粉末密度3.9-4.0g/cm3,熔点2050℃沸点2980℃不溶于水,能渐渐溶于浓硫酸又称矾土,自然界有刚玉Al(OH)3 无臭无味的白色单斜晶体密度2.42g/cm3不溶于水和乙醇;溶于热盐酸、硫酸和碱类典型的两性氢氧化物。

碱土金属碳酸盐溶解度规律碱土金属碳酸盐的溶解度规律,哎呀,听上去是不是有点儿生涩?别担心,咱们来聊聊这玩意儿,轻松点,开心点。
咱们得知道,碱土金属是什么?其实就是那一群乖乖的金属,像钙、镁、锶和钡这些小家伙。
它们可不止是在化学实验室里混日子,平时的生活中也大有用处,像钙就和我们骨头的健康息息相关,镁嘛,对心脏也挺好的。
这些金属和碳酸根离子结合起来,就形成了碳酸盐,听上去就觉得有点儿复杂,但其实没啥好怕的。
说到溶解度,咱们就得看看这些碳酸盐在水里到底表现得如何。
你想想,碳酸钙这个家伙,溶解度可是非常有限的。
这就像我们有时候在家里做饭,明明想让面条更软,却发现怎么煮都不入味,这碳酸钙在水里就像这样,它宁愿躲在角落里,也不想溶解。
而钡的碳酸盐,嘿嘿,跟它相比,那就更是个“高冷”人物了,溶解度几乎可以说是微乎其微。
你说,怎么这么倔呢?不过,咱们不能光盯着这些“怪兽”,别忘了镁的碳酸盐,它在水里溶解度还算不错,偶尔也会来点“水灵灵”的表现,真是让人意外啊!碱土金属碳酸盐的溶解度可不是随便的,它们还有个秘密武器,那就是溶液的pH 值。
哎,别担心,这可不是化学课上那些让人头疼的理论。
简单来说,酸性溶液会增加它们的溶解度。
比如说,当你加点醋或者柠檬汁,这些酸就像是催化剂,把它们逼得快快溶解。
就像让孩子吃青菜,非得加点儿糖,才能勉强咽下去。
所以,下次喝酸奶的时候,想想它背后的化学原理,也许你会更加喜欢哦。
还有一种情况,那就是随着碱土金属的“地位”变化,它们的溶解度也跟着变。
钙盐在水里的表现就挺好的,能溶出不少,毕竟它是个“大哥”,相对比较“接地气”。
而锶盐,嘿,稍微有点儿小傲娇了,溶解度就小一些。
更神奇的是,随着金属原子的大小增大,溶解度也会出现不同的变化。
就像一群朋友聚会,大家聊得火热,突然有个家伙不太合群,慢慢就显得孤单了。
这种现象就叫做“溶解度规则”,在碱土金属的世界里可是真实存在的。
讲真,这些碱土金属碳酸盐的故事,不仅仅是化学,更像是一个个性格各异的小角色。

化学溶解性表超全化学溶解性表是指记录了各种化学物质在水中溶解性的一份详细数据表,主要用于指导化学实验和工业生产。
本文将展示化学溶解性表超全,其中包括了常见无机物、有机物以及一些特殊物质的溶解度数据,以及一些实验技巧和注意事项。
一、常见无机物的溶解度1. 氢氧化钠(NaOH)氢氧化钠是一种强碱性物质,在水中溶解度较高,且显著地随温度升高而增加。
常温下,100g水可溶解4.3g氢氧化钠,而在80℃时,可将23g氢氧化钠完全溶解在100g水中。
2. 氢氧化铝(Al(OH)3)氢氧化铝的溶解度非常低,但是在碱性溶液中,可以形成络合物而增加其溶解度。
在pH为9时,氢氧化铝的溶解度可达1g/L。
3. 碳酸钠(Na2CO3)碳酸钠在水中的溶解度随温度升高而增加,但在酸性溶液中,其溶解度会明显减小。
在常温下,100g水可溶解7.9g碳酸钠,而在50℃时,可将37g碳酸钠完全溶解在100g水中。
4. 碘化钾(KI)碘化钾是一种常用的氧化剂,它在水中的溶解度非常高。
在常温下,100g水可溶解36g碘化钾。
5. 氰化物(CN-)氰化物是一种非常强的配体,广泛用于配位化学和有机合成中。
它在水中的溶解度非常低,但是在碱性溶液中,可以形成氰化金属络合物而增加其溶解度。
在常温下,氰化物在水中的溶解度约为0.02g/L,而在pH为12时,其溶解度可达1g/L。
6. 硫酸铜(CuSO4)硫酸铜在水中的溶解度随温度升高而增加,常温下,100g水可溶解31.6g硫酸铜,而在50℃时,可将63.4g硫酸铜完全溶解在100g水中。
7. 氢氧化钙(Ca(OH)2)氢氧化钙在水中的溶解度比较低,在常温下,100g水只能溶解0.185g氢氧化钙。
但是,当加入少量酸性物质或二氧化碳时,会形成可溶性的碳酸钙和Ca(HCO3)2,从而提高其溶解度。
二、常见有机物的溶解度1. 甲苯(C7H8)甲苯是一种常用的有机溶剂,其在水中的溶解度非常低,只有0.1g/L左右。

三元前驱体溶解车间金属盐浓度标准三元前驱体是一种常用于制备锂离子电池正极材料的重要原料。
在制备三元前驱体过程中,常常需要溶解含有金属盐的原料,以获得所需的金属离子浓度。
金属盐的溶解度与溶液中金属离子的浓度密切相关,在溶解车间中,根据不同的需求,制定不同金属盐的溶解浓度标准。
一般来说,制备三元前驱体时需要用到的金属盐有锂盐、镍盐、钴盐和锰盐。
以下是一些常用的金属盐浓度标准:1. 锂盐浓度标准:通常制备锂离子电池正极材料需要使用锂盐溶液。
常见的锂盐有氢氧化锂(LiOH)和碳酸锂(Li2CO3)。
在制备锂离子电池正极材料的过程中,一般使用氢氧化锂浓度为3-6 mol/L的溶液。
2. 镍盐浓度标准:三元前驱体中的镍离子通常来自镍盐的溶解。
常见的镍盐有硫酸镍(NiSO4)、氯化镍(NiCl2)等。
在制备三元前驱体的过程中,一般使用硫酸镍浓度为0.5-1.5 mol/L的溶液。
3. 钴盐浓度标准:钴离子通常来自钴盐的溶解。
常见的钴盐有硫酸钴(CoSO4)、氯化钴(CoCl2)等。
在制备三元前驱体的过程中,一般使用硫酸钴浓度为0.2-0.6 mol/L的溶液。
4. 锰盐浓度标准:锰离子通常来自锰盐的溶解。
常见的锰盐有硫酸锰(MnSO4)、氯化锰(MnCl2)等。
在制备三元前驱体的过程中,一般使用硫酸锰浓度为0.4-0.8 mol/L的溶液。
需要注意的是,金属盐的溶解浓度标准可能会因具体的制备工艺和材料要求而有所不同,以上浓度标准仅供参考。
在实际操作中,应根据具体的制备工艺要求和实验结果进行优化和调整。
化合物的溶度积常数表化学溶解性表常见物质溶解性CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体合成氨工业和硝酸的生产密切相关,氨和空气混合后,通过铂铑合金网(催化剂)便被氧化为一氧化氮。

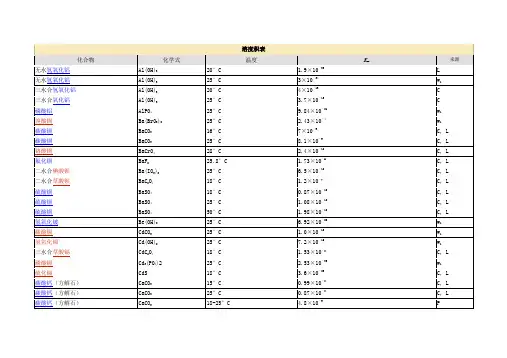
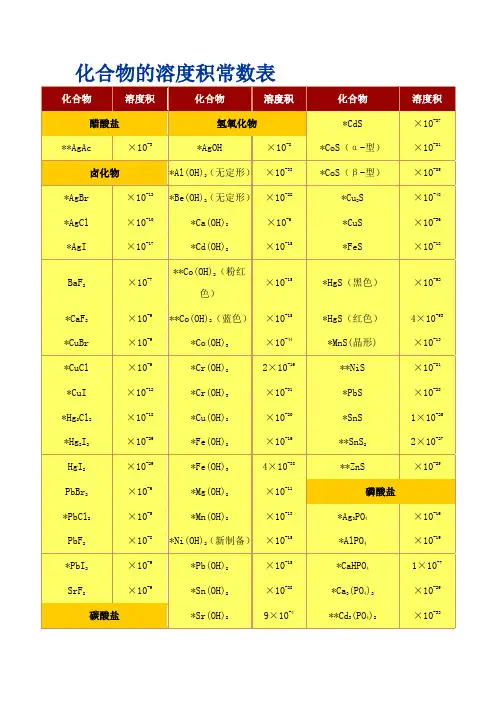
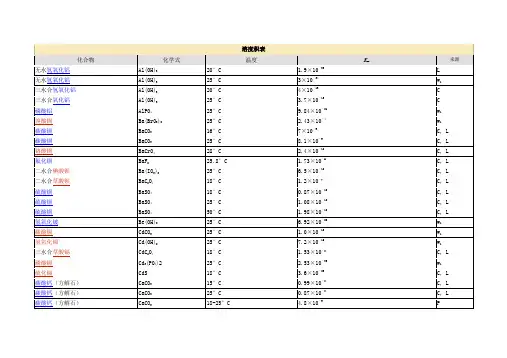
化合物的溶度积常数表化合物的溶度积常数表化合物溶度积化合物溶度积化合物溶度积醋酸盐氢氧化物*CdS 8.0×10-27 **AgAc 1.94×10-3*AgOH 2.0×10-8*CoS(α-型) 4.0×10-21卤化物*Al(OH)3(无定形)1.3×10-33*CoS(β-型)2.0×10-25*AgBr 5.0×10-13*Be(OH)2(无定形)1.6×10-22*Cu2S2.5×10-48*AgCl 1.8×10-10*Ca(OH)2 5.5×10-6*CuS 6.3×10-36 *AgI 8.3×10-17*Cd(OH)2 5.27×10-15*FeS 6.3×10-18BaF2 1.84×10-7**Co(OH)2(粉红色)1.09×10-15*HgS(黑色) 1.6×10-52*CaF2 5.3×10-9**Co(OH)2(蓝色) 5.92×10-15*HgS(红色)4×10-53 *CuBr 5.3×10-9*Co(OH)3 1.6×10-44*MnS(晶形) 2.5×10-13 *CuCl 1.2×10-6*Cr(OH)22×10-16**NiS 1.07×10-21 *CuI 1.1×10-12*Cr(OH)3 6.3×10-31*PbS 8.0×10-28 *Hg2Cl2 1.3×10-18*Cu(OH)2 2.2×10-20*SnS 1×10-25 *Hg2I2 4.5×10-29*Fe(OH)28.0×10-16**SnS22×10-27 HgI2 2.9×10-29*Fe(OH)34×10-38**ZnS 2.93×10-25 PbBr2 6.60×10-6*Mg(OH)2 1.8×10-11磷酸盐*PbCl2 1.6×10-5*Mn(OH)2 1.9×10-13*Ag3PO4 1.4×10-16PbF2 3.3×10-8*Ni(OH)2(新制备)2.0×10-15*AlPO4 6.3×10-19*PbI27.1×10-9*Pb(OH)2 1.2×10-15*CaHPO41×10-7 SrF2 4.33×10-9*Sn(OH)2 1.4×10-28*Ca3(PO4)2 2.0×10-29碳酸盐*Sr(OH)29×10-4**Cd3(PO4)2 2.53×10-33 Ag2CO38.45×10-12*Zn(OH)2 1.2×10-17Cu3(PO4)2 1.40×10-37 *BaCO3 5.1×10-9草酸盐FePO4·2H2O 9.91×10-16 CaCO3 3.36×10-9Ag2C2O4 5.4×10-12*MgNH4PO4 2.5×10-13 CdCO3 1.0×10-12*BaC2O4 1.6×10-7Mg3(PO4)2 1.04×10-24 *CuCO3 1.4×10-10*CaC2O4·H2O 4×10-9*Pb3(PO4)28.0×10-43 FeCO3 3.13×10-11CuC2O4 4.43×10-10*Zn3(PO4)29.0×10-33 Hg2CO3 3.6×10-17*FeC2O4·2H2O 3.2×10-7其它盐MgCO3 6.82×10-6Hg2C2O4 1.75×10-13*[Ag+][Ag(CN)2-] 7.2×10-11MnCO3 2.24×10-11MgC2O4·2H2O 4.83×10-6*Ag4[Fe(CN)6] 1.6×10-41 NiCO3 1.42×10-7MnC2O4·2H2O 1.70×10-7*Cu2[Fe(CN)6] 1.3×10-16 *PbCO37.4×10-14**PbC2O48.51×10-10AgSCN 1.03×10-12 SrCO3 5.6×10-10*SrC2O4·H2O 1.6×10-7CuSCN 4.8×10-15 ZnCO3 1.46×10-10ZnC2O4·2H2O 1.38×10-9*AgBrO3 5.3×10-5铬酸盐硫酸盐*AgIO3 3.0×10-8 Ag2CrO4 1.12×10-12*Ag2SO4 1.4×10-5Cu(IO3)2·H2O 7.4×10-8*Ag2Cr2O7 2.0×10-7*BaSO4 1.1×10-10**KHC4H4O6(酒石酸氢钾)3×10-4*BaCrO4 1.2×10-10*CaSO49.1×10-6**Al(8-羟基喹啉)35×10-33 *CaCrO47.1×10-4Hg2SO4 6.5×10-7*K2Na[Co(NO2)6]·H2O 2.2×10-11 *CuCrO4 3.6×10-6*PbSO4 1.6×10-8*Na(NH4)2[Co(NO2)6] 4×10-12 *Hg2CrO4 2.0×10-9*SrSO4 3.2×10-7**Ni(丁二酮肟)24×10-24 *PbCrO4 2.8×10-13硫化物**Mg(8-羟基喹啉)24×10-16 *SrCrO4 2.2×10-5*Ag2S 6.3×10-50**Zn(8-羟基喹啉)25×10-251997-1998* 摘自J.A.Dean Ed. Lange's Handbook of Chemistry, 13th. edition 1985** 摘自其他参考书。

一、介绍碱金属盐是指具有碱性的金属盐,主要包括氢氧化钠、氢氧化钾、氢氧化钙等。
由于碱金属盐的溶解度较小,因此在化学实验和工业生产中具有一定的特殊性。
二、溶解度较小的碱金属盐类化学式1. 氢氧化钠化学式:NaOH氢氧化钠是一种固体碱性化合物,在水中溶解度相对较小。
其溶解度为39.2g/100mL(20℃),在常温下呈固体状态。
氢氧化钠是一种强碱,在水中呈现碱性反应,常用于工业生产中的碱法制备工艺中。
2. 氢氧化钾化学式:KOH氢氧化钾是另一种常见的碱性化合物,其溶解度相对较小。
在20℃下,氢氧化钾的溶解度约为112g/100mL。
氢氧化钾具有强碱性,在工业上常用于肥皂制备、碱液制备等过程中。
3. 氢氧化钙化学式:Ca(OH)2氢氧化钙是一种固体碱性化合物,其在水中的溶解度较小。
在20℃下,氢氧化钙的溶解度约为1.7g/100mL。
氢氧化钙具有较强的碱性,在工业生产和农业生产中有着广泛的应用。
三、影响溶解度的因素1. 温度温度对碱金属盐的溶解度有一定影响。
一般来说,随着温度的升高,碱金属盐的溶解度会增加。
但是对于某些特定的碱金属盐,却可能存在溶解度随温度而减小的情况。
2. 其他物质的影响有些碱金属盐的溶解度还会受到其他物质(如盐酸、硫酸等)的影响。
这些物质会通过与碱金属盐发生化学反应或者物理作用,从而影响碱金属盐的溶解度。
四、应用由于溶解度较小的碱金属盐具有一定的特殊性,因此在实验室和工业生产中有着特定的应用:在化学合成实验中,可以利用碱金属盐的溶解度较小特点,进行相应的实验设计和操作。
在工业生产中,需要根据碱金属盐的溶解度特点,制定相应的工艺控制和生产流程。
五、结论就溶解度较小的碱金属盐而言,其化学式包括氢氧化钠(NaOH)、氢氧化钾(KOH)、氢氧化钙(Ca(OH)2)等。
在实验室和工业生产中,需要充分了解并合理应用碱金属盐的溶解度特点,从而实现更精确的实验结果和更高效的生产过程。
希望本文对您有所帮助。
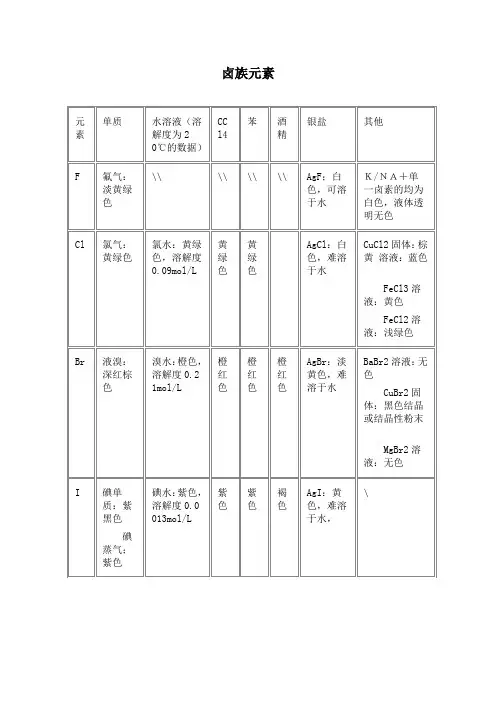
卤族元素准金属metalloid准金属也叫半金属。
通常指硼、硅、锗、硒、碲、钋、砷和锑。
它们在元素周期表中处于金属向非金属过渡的位置,物理性质和化学性质介于金属和非金属之间。
单质一般性脆,呈金属光泽。
电负性在1.8~2.4之间,大于金属,小于非金属,准金属多是半导体,具有导电性。
它们跟非金属作用时常作为电子给予体,而跟金属作用时常作为电子接受体。
这类元素大部分为重要的工业材料,用于制造晶体管、集成电路芯片、半导体器件、陶瓷制品、太阳能电池和某些聚合物。
碱金属是锂、钠、钾、铷、铯、钫六种金属元素的统称。
(钫因为是放射性元素所以高中不予考虑)除了氢氧化锂是中强碱之外,其余碱金属的氢氧化物是强碱。
碱金属盐类溶解性的最大特点是易溶性。
除极少数阴离子的碱金属盐难溶于水外,几乎所有的碱金属盐均易溶于水,且在溶液中完全电离。
所谓主族元素就是指除了最外层电子层以外的电子层的电子数都是满电子的化学元素。
原理:同主族元素从上到下原子序数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,得电子能力逐渐减小,失电子能力逐渐增大,元素金属性逐渐增大,非金属性逐渐减小,气态氢化物稳定性逐渐减小。
IA:Li Na K Rb Cs Fr最高价氧化物对应水化物的碱性:LiOH<NaOH<KOH<RbOH<CsOHⅡA:Be Mg Ca Sr Ba Ra)最高价氧化物对应水化物碱性:Be(OH)2<Mg(OH)2<Ca(OH)2<Sr(OH)2<Ba(OH)2ⅢA:B Al Ga In Ta此层元素比较特殊,在化学性质上显示出两性ⅣA:C Si Ge Sn Pb气态氢化物的稳定性:CH4>SiH4最高价氧化物对应水化物的酸性:H2CO3>H2SiO3(H4SiO4)ⅤA:N P As Sb Bi气态氢化物的稳定性:NH3>PH3>AsH3最高价氧化物对应水化物的酸性:HNO3>H3PO4>H3AsO4ⅥA:O S Se Te Po气态氢化物的稳定性:H2O>H2S>H2Se最高价氧化物对应水化物的酸性:H2SO4>H2SeO4ⅦA:F Cl Br I At气态氢化物的稳定性:HF>HCl>HBr>HI最高价氧化物对应水化物的酸性:HClO4>HBrO4>HIO4卤素,卤族元素的简称,是元素周期表上的第ⅦA族元素(IUPAC新规定:17族)。
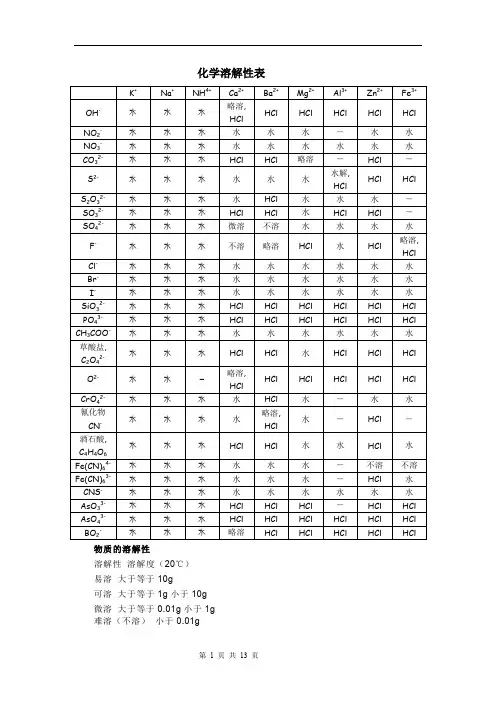
化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH-、硝酸根NO3-、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>Os>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O10.碳酸氢钠加热的反应2NaHC O3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应 2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应 2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2H Cl+S↓71.硫化氢与浓硫酸的反应 H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca(OH)2 (3) Mg2++2OH2-==== Mg(OH)2↓ (4) Mg(OH)2+2HCl==== MgCl2+2H2O (5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑ 103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O 104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3 105.硅酸加热分解H2SiO3==== SiO2+H2O 106.铝与氧气的反应4Al+3O2==== 2Al2O3 107.铝与氯气的反应2Al+3Cl2==== 2AlCl3 108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑ 110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3 112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3 113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4] 115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH)3↓+3(NH4)2SO4 117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl 118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl 119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+NaCl+H2O 122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O 124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3NaCl 125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3 126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3 127.铜与氧气的反应2Cu+O2==== 2CuO 128.铜与氯气的反应Cu+Cl2==== CuCl2 129.铜氧化在高温下转化4CuO==== 2Cu2O+O 2↑ 130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体(1)(2)铵盐:O H NH NH 234+↑−→−+碱⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质2.与酸反应产生气体(1) (2)()()()2332222332H H H CO HCO CO S HS H S SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O4.与水反应产生气体 (1)单质(2)化合物5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
常见物质溶解性(一)(参见初中化学课本P273表)钾盐铵盐都易溶,硝酸盐遇水影无踪。
硫酸盐不溶钡和铅,氯化物不溶银、亚汞。
其它盐类溶三种,①沉淀溶于强酸中。
钾钠钡钙碱可溶,②其它也溶强酸中。
注:①除硝酸盐、硫酸盐、氯化物以外的盐类只有钾、钠、铵盐可溶。
②氢氧化钙Ca(OH)2是微溶。
常见物质溶解性(二)钾钠铵盐水易溶,硝酸盐类性相同;“硫”盐不溶钡与铅,①“氯”盐不溶银亚汞;②弱碱和那弱酸盐,水中大部分不能溶。
注:①“硫”盐,指硫酸盐。
②“氯”盐,指盐酸盐。
盐类物质的溶解性一切钠、钾盐全部溶,铵盐、硝酸盐也相同。
硫酸钡、铅要除外,氯化亚汞、银不溶,亚硫酸盐、磷酸盐,钠、钾、铵溶余不溶,碳酸盐和硅酸盐,全跟上面相雷同。
硫化钾、钡、钠、镁溶,硫化钙微溶余不溶。
盐类溶解性歌硝酸钾钠溶,碳硅和亚硫,盐酸除银汞,钠后都不溶。
①硫酸去钡铅,微溶氯化铅,磷盐多不溶。
硫酸钙银汞。
注:①溶解性表中钠以后的金属盐都不溶于水。
鸟之诗[先知]比中学化学课本上的要详细溶解度表維基百科,自由的百科全書跳轉到: 導航, 搜尋關於高中階段使用的用於判斷溶解性的簡易表格,請參見溶解性表。
溶解度表以化學品中特徵元素的拼音順序排列。
所有數據都為1atm下的數據,單位為g/100cm3。
內容列表:錒、氨、銨、鈀、鋇、鉍、鉑、鈈、氮、鏑、鉺、釩、釓、鈣、鋯、鎘、鉻、汞、鈷、矽、鉿、氦、鈥、鎵、鉀、金、鈧、鑭、鋰、硫、鑥、鋁、鎂、錳、鈉、鎳、釹、硼、鈹、釙、鐠、氫、鉛、銣、銫、釤、砷、鈰、鍶、鉈、碳、鋱、銻、鐵、銅、釷、錫、氙、鋅、溴、氬、氧、銦、釔、鐿、銀、鈾、銪、有機化合物物質化學式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C 乙酸鈉CH3COONa36.240.846.454.665.6139153161170疊氮化鈉NaN338.939.940.8苯甲酸鈉NaC7H5O253.0溴酸鈉NaBrO324.230.336.442.648.862.675.790.8溴化鈉NaBr80.285.290.898.4107118120121121碳酸鈉Na2CO3712.521.539.7494643.943.9氯酸鈉NaClO379.687.695.9105115137167184204氯化鈉NaCl35.735.835.936.136.437.13838.539.2鉻酸鈉Na2CrO431.750.1848896115125126氰化鈉NaCN40.848.158.771.2水解重鉻酸鈉Na2Cr2O7163172183198215269376405415磷酸二氫鈉NaH2PO456.569.886.9107133172211234。
銨溶解度單位為g/100ml物質化學式0°C 10°C 20°C 30°C 40°C 50°C 60°C 70°C 80°C 90°C 100°C 氨NH388.5 70 56 44.5 34 26.5 20 15 11 8 7碳酸氫銨NH4HCO311.9 16.1 21.7 28.4 36.6 59.2 109 170 354 溴化銨NH4Br 60.6 68.1 76.4 83.2 91.2 108 125 135 145 碳酸銨(NH4)2CO3100氯酸銨NH4ClO328.7氯化銨NH4Cl 29.4 33.2 37.2 41.4 45.8 50.4 55.3 60.2 65.6 71.2 77.3 鉻酸銨(NH4)2CrO425 29.2 34 39.3 45.3 59 76.1重鉻酸銨(NH4)2Cr2O718.2 25.5 35.6 46.5 58.5 86 115 156 磷酸二氫銨NH4H2PO422.7 39.5 37.4 46.4 56.7 82.5 118 173 甲酸銨NH4HCO2102 143 204 311 533磷酸一氫銨(NH4)2HPO442.9 62.9 68.9 75.1 81.8 97.2碘化銨NH4I 155 163 172 182 191 209 229 250 硝酸銨NH4NO3118 150 192 242 297 421 580 740 871 高氯酸銨NH4ClO412 16.4 21.7 37.7 34.6 49.9 68.9磷酸銨(NH4)3PO426.1硒酸銨(NH4)2SeO496 105 115 126 143 192硫酸銨(NH4)2SO470.6 73 75.4 78 81 88 95 103 亞硫酸銨(NH4)2SO347.9 54 60.8 68.8 78.4 104 144 150 153 酒石酸銨(NH4)2C4H4O645 55 63 70.5 76.5 86.9硫氰酸銨NH4SCN 120 144 170 208 234 346硫代硫酸銨(NH4)2S2O3 2.15鈣鈣2溴酸鈣Ca(BrO3)2230溴化鈣CaBr2125 132 143 213 278 295 312 氯酸鈣Ca(ClO3)2209鉻酸鈣CaCrO4 4.5 2.25 1.83 1.49 0.83磷酸二氫鈣Ca(H2PO4)21.8甲酸鈣Ca(HCO2)216.1 16.6 17.1 17.5 17.9 18.4 磷酸氫鈣CaHPO44.303×10-3氫氧化鈣Ca(OH)20.189 0.182 0.173 0.16 0.141 0.1218.6×10-27.6×10-2碘酸鈣 Ca(IO 3)2 9×10-2 0.24 0.38 0.52 0.65 0.66 0.67 碘化鈣 CaI 2 64.6 66 67.6 70.8 74 78 81 鉬酸鈣 CaMoO 4 4.099×10-3 硝酸鈣 Ca(NO 3)2·4H 2O 102 115 129 152 191 358 363 亞硝酸鈣 Ca(NO 2)2 ·4H 2O 63.9 84.5 104 134 151 166 178 高氯酸鈣 Ca(ClO 4)2188高錳酸鈣 Ca(MnO 4)2 338 磷酸鈣 Ca 3(PO 4)2 2×10-3 硫酸鈣CaSO 4·2H 2O 0.223 0.244 0.255 0.264 0.265 0.244 0.234 0.205鉀物質化學式0°C 10°C 20°C 30°C 40°C 50°C 60°C 70°C 80°C 90°C 100°C 乙酸鉀KC2H3O2216 233 256 283 324 350 381 398苯甲酸鉀KC7H5O265.8 70.7 76.7 82.1溴酸鉀KBrO3 3.09 4.72 6.91 9.64 13.1 22.7 34.1 49.9 溴化鉀KBr 53.6 59.5 65.3 70.7 75.4 85.5 94.9 99.2 104 碳酸鉀K2CO3105 109 111 114 117 127 140 148 156 氯酸鉀KClO3 3.3 5.2 7.3 10.1 13.9 23.8 37.5 46 56.3氯化鉀KCl 28 31.2 34.2 37.2 40.1 45.8 48.8 51.3 53.9 56.3 鉻酸鉀K2CrO456.3 60 63.7 66.7 67.8 70.1 74.5氰化鉀KCN 50重鉻酸鉀K2Cr2O7 4.7 7 12.3 18.1 26.3 45.6 73磷酸二氫鉀KH2PO414.8 18.3 22.6 28 35.5 50.2 70.4 83.5鐵氰化鉀K3Fe(CN)630.2 38 46 53 59.3 70 91 亞鐵氰化鉀K4Fe(CN)614.3 21.1 28.2 35.1 41.4 54.8 66.9 71.5 74.2 氟化鉀KF 44.7 53.5 94.9 108 138 142 150甲酸鉀KHCO2313 337 361 398 471 580 658碳酸氫鉀KHCO322.5 27.4 33.7 39.9 47.5 65.6磷酸一氫鉀K2HPO4150硫酸氫鉀KHSO436.2 48.6 54.3 61 76.4 96.1 122 氫氧化鉀KOH 95.7 103 112 126 134 154 178 碘化鉀KI 128 136 144 153 162 168 176 192 198 206 硝酸鉀KNO313.9 21.9 31.6 45.3 61.3 106 167 203 245 亞硝酸鉀KNO2279 292 306 320 329 348 376 390 410 草酸鉀K2C2O425.5 31.9 36.4 39.9 43.8 53.2 63.6 69.2 75.3 高氯酸鉀KClO40.76 1.06 1.68 2.56 3.73 7.3 13.4 17.7 22.3 磷酸鉀K3PO481.5 92.3 108 133硒酸鉀K2SeO4107 109 111 113 115 119 121 122 硫酸鉀K2SO47.4 9.3 11.1 13 14.8 18.2 21.4 22.9 24.1 硫氰酸鉀KSCN 177 198 224 255 289 372 492 571 675鈉、鎳鈉苯甲酸NaC7H5O253.0鈉溴酸鈉NaBrO324.2 30.3 36.4 42.6 48.8 62.6 75.7 90.8 溴化鈉NaBr 80.2 85.2 90.8 98.4 107 118 120 121 121 碳酸鈉Na2CO37 12.5 21.5 39.7 49 46 43.9 43.9氯酸鈉NaClO379.6 87.6 95.9 105 115 137 167 184 204 氯化鈉NaCl 35.7 35.8 35.9 36.1 36.4 37.1 38 38.5 39.2 鉻酸鈉Na2CrO431.7 50.1 84 88 96 115 125 126 氰化鈉NaCN 40.8 48.1 58.7 71.2 水解重鉻酸Na2Cr2O7163 172 183 198 215 269 376 405 415 鈉磷酸二NaH2PO456.5 69.8 86.9 107 133 172 211 234氫鈉氟化鈉NaF 3.66 4.06 4.22 4.4 4.68 4.89 5.08 甲酸鈉HCOONa 43.9 62.5 81.2 102 108 122 138 147 160碳酸氫NaHCO37 8.1 9.6 11.1 12.7 16鈉氫氧化NaOH 98 109 119 129 174鈉碘酸鈉NaIO3 2.48 4.59 8.08 10.7 13.3 19.8 26.6 29.5 33 碘化鈉NaI 159 167 178 191 205 257 295 302 鉬酸鈉Na2MoO444.1 64.7 65.3 66.9 68.6 71.8硝酸鈉NaNO373 80.8 87.6 94.9 102 122 148 180NaNO271.2 75.1 80.8 87.6 94.9 111 113 160 亞硝酸鈉草酸鈉Na2C2O4 2.69 3.05 3.41 3.81 4.18 4.93 5.71 6.5高氯酸NaClO4167 183 201 222 245 288 306 329 鈉高碘酸NaIO4 1.83 5.6 10.3 19.9 30.4鈉磷酸鈉Na3PO4 4.5 8.2 12.1 16.3 20.2 20.9 60 68.1 77焦磷酸Na4P2O7 2.26鈉硒酸鈉Na2SeO413.3 25.2 26.9 77 81.8 78.6 74.8 73 72.7硫酸鈉Na2SO4 4.9 9.1 19.5 40.8 48.8 45.3 43.7 42.7 42.5硫代硫Na2S2O371.5 73 77.6 90.8 97.2 酸鈉溴酸鎳Ni(BrO3)2·6H2O 28溴化鎳NiBr2113 122 131 138 144 153 154 155 碳酸鎳NiCO39.643×10-4氯酸鎳Ni(ClO3)2111 120 133 155 181 221 308氯化鎳NiCl253.4 56.3 66.8 70.6 73.2 81.2 86.6 87.6 碘化鎳NiI2124 135 148 161 174 184 187 188硝酸鎳Ni(NO3)279.2 94.2 105 119 158 187 188高氯酸Ni(ClO4)2105 107 110 113 117鎳焦磷酸Ni2P2O7 1.017×10-3鎳硫酸鎳NiSO4·6H2O 44.4 46.6 49.2 55.6 64.5 70.1 76.7硼鋅物質化學式0°C 10°C 20°C 30°C 40°C 50°C 60°C 70°C 80°C 90°C 100°C乙酸Zn(C2H3O2)230鋅溴化ZnBr2389 446 528 591 618 645 672 鋅碳酸ZnCO3 4.692×10-5鋅氯酸Zn(ClO3)2145 152 209 223鋅氯化ZnCl2342 353 395 437 452 488 541 614 鋅氰化Zn(CN)2 5.8×10-2鋅甲酸Zn(HCO2)2 3.7 4.3 6.1 7.4 11.8 21.2 28.8 38鋅碘化ZnI2430 432 445 467 490 510 鋅硝酸Zn(NO3)298 138 211鋅高錳Zn(MnO4)233.3酸鋅硫酸ZnSO441.6 47.2 53.8 61.3 70.5 75.4 71.1 60.5 鋅。
化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g第 2 页共16 页第 3 页共16 页在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH- 、硝酸根NO3- 、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO 42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>Os>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色第 4 页共16 页17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O第 5 页共16 页10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2 二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O第 6 页共16 页35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO4第7 页共16 页59.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应 2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应 2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O 硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2H Cl+S↓71.硫化氢与浓硫酸的反应 H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca(OH)2(3) Mg2++2OH2-==== Mg(OH)2↓ (4) Mg(OH)2+2HCl==== MgCl2+2H2O(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl2第8 页共16 页78.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑第9 页共16 页101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3105.硅酸加热分解H2SiO3==== SiO2+H2O106.铝与氧气的反应4Al+3O2==== 2Al2O3107.铝与氯气的反应2Al+3Cl2==== 2AlCl3108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4]115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH)3↓+3(NH4)2SO4 117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+NaCl+H2O 122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O 124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3NaCl 125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3 126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3第10 页共16 页中考数学物理化学复习资料第 11 页 共 16 页127.铜与氧气的反应2Cu+O2==== 2CuO128.铜与氯气的反应Cu+Cl2==== CuCl2129.铜氧化在高温下转化4CuO==== 2Cu2O+O 2↑130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体 (1)(2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体(1)⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓中考数学物理化学复习资料 第 12 页 共 16 页(2)()()()2332222332H H H CO HCO CO S HS H S SO HSO SO ++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O4.与水反应产生气体(1)单质(2)化合物 5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。