杂环化合物
- 格式:doc
- 大小:808.50 KB
- 文档页数:18




有机化学基础知识点整理杂环化合物的性质与应用杂环化合物是有机化学中一类具有杂原子(通常是氮、氧、硫等非碳原子)构成的环状分子。
它们具有多种独特的性质和广泛的应用。
本文将整理一些重要的有机化学基础知识点,涵盖杂环化合物的性质和应用。
一、杂环化合物的命名和结构杂环化合物的命名使用通常的有机化学命名法,如官能团命名法、光谱法等。
其结构通常由杂原子和碳原子组成,可以包含一个或多个杂环。
其中,氮杂环化合物如吡嗪、噻吩和咪唑等具有广泛的结构多样性和化学活性。
二、杂环化合物的性质1. 杂环化合物的稳定性:杂环化合物中的杂原子可以增加分子的稳定性,一些杂环化合物比它们的同系物更稳定。
例如,咪唑酮比噻唑酮更稳定,这是由于含氮原子的电子亲和力高于含硫原子的电子亲和力。
2. 杂环化合物的化学反应:杂环化合物中的杂原子可以参与许多重要的化学反应,如亲电取代、亲核取代、氧化还原等。
以氮杂环化合物为例,它们可以发生亲电取代反应,如芳香性亲电取代、加成反应等。
3. 杂环化合物的光学性质:杂环化合物中存在的共轭体系可以产生有趣的光学性质,如荧光、蓝光发射等。
研究人员利用这些性质开发出许多发光材料,应用于有机光电子器件、荧光探针等领域。
三、杂环化合物的应用1. 杂环化合物在药物领域的应用:许多杂环化合物具有药理活性,并被用作药物的活性成分。
例如,噻唑类和咪唑类化合物具有抗菌和抗肿瘤活性,吡唑类和吡唑酮类化合物被广泛应用于抗癌药物研究。
2. 杂环化合物在染料领域的应用:杂环化合物可以用作染料分子的基础结构,赋予染料分子良好的色谱性能和稳定性。
它们在纺织、油墨和染料敏化太阳能电池等领域有广泛应用。
3. 杂环化合物在有机电子器件中的应用:杂环化合物具有优异的载流子传输性能和独特的光学性质,因此被广泛应用于有机发光二极管(OLED)、有机太阳能电池和有机场效应晶体管等器件中。
四、结语本文对有机化学基础知识中的杂环化合物的性质和应用进行了整理和阐述。

杂环化合物定义杂环化合物是一类含有至少一个杂原子(指不是碳原子的原子)的碳氢化合物。
它们的分子结构通常包括一个或多个环,并含有不同的杂原子,如氮、氧、硫等,这赋予了它们独特的化学性质和功能。
一、杂原子1.1 氮杂环化合物其中最常见的是咪唑和嘧啶。
在咪唑中,氮原子是在环上的。
它使它在一些细胞信号转导、 RNA 与 DNA 的生物合成中扮演重要角色。
而嘧啶含有两个氮原子,一个位于环中,另一个则连接着杂环。
1.2 氧杂环化合物这类化合物通常包括呋喃、吡咯烷酮、吡喃等。
多用于制药、农药、染料等领域。
1.3 硫杂环化合物例如噻吩和二恶硫。
其中噻吩可以作为一些染料、润滑油和药物的原料,因为它具有防腐和抗氧化的作用。
二、杂环的特点2.1 可通过不同的杂原子以及相对排列方式制造出种类繁多的化合物。
2.2 杂环化合物具有多种多样的化学和生物活性,因此成为了广泛应用的重要原料。
2.3 杂环亦能改变化合物的分子形状和分子间的各种不同相互作用,从而加强添加物的分子间相互作用力,其作用值得深入挖掘。
三、杂环的应用3.1 杂环化合物广泛应用于医药领域,如抗生素、抗肿瘤药物、心血管药物等的制造。
3.2 在新型材料的研究中,杂环化合物作为一种功能性的化合物,拥有广泛的应用前景。
3.3 杂环化合物也被用于新型铀和镎的萃取分离和控制核材料的制备。
结语杂环化合物是一类特别的有机化合物,以其多样的结构和广阔的应用领域而被广泛使用。
期望在未来,随着人们对其的进一步研究,可以开发出更为优异的化合物及其应用。



有机化学杂环化合物有机化学杂环化合物是由碳以外的元素(通常是氮、氧或硫)组成的化合物,其中至少一个炭原子和这些元素原子形成共价键。
这些化合物常常作为药物、染料、及其它重要化合物的基础结构。
一、常见的有机化学杂环化合物及其特性1. 含氮杂环化合物:其中最常见的是吡咯烷(pyrrolidine)及其衍生物。
这类化合物可以吸收紫外线,常用作苯乙酮的合成中间体,制药、农药、染料等各方面应用广泛。
2. 含氧杂环化合物:其中最常见的是吡喃(furan)。
在生物体内有重要的作用,如可用于合成DNA(脱氧核糖核酸)和RNA (核糖核酸)的成分。
3. 含硫杂环化合物:其中最常见的是噻吩(thiophene)。
它们通常具有很好的电子传导性质,可以用作半导体材料、涂料和染料等领域。
二、有机化学杂环化合物的制备方法1. Hantzsch合成法:Hantzsch合成法是常见的含氮杂环化合物制备方法,为β-二酮与1,4-二胺或是1,3-二醇反应,生成相应的杂环化合物。
2. Paal-Knorr合成法:Paal-Knorr反应是一种常见的含硫或含氧杂环化合物制备方法,用有官能基的酮或羧酸与无官能基化合物反应生成对应杂环化合物。
3. Pinner反应:Pinner反应是一种含氮杂环化合物制备方法,用苯酸酰氯与硫酸铵塔反应得到相应的吡啶盐。
三、应用领域1. 作为药物:含杂环化合物在药物领域中占据重要地位,如吉非替尼(alectinib)、西妥昔单抗(rituximab)等,广泛用于治疗肺癌等疾病。
2. 作为染料:有机化学杂环化合物可作为重要的染料合成中间体,用于制作多种颜色的染料。
3. 作为涂料:有机化学杂环化合物可用于制作防腐涂料和抗紫外线涂料等。
总之,有机化学杂环化合物是重要的有机化合物之一,具有广泛的应用领域,对于其制备、性质和应用的研究具有重要意义。
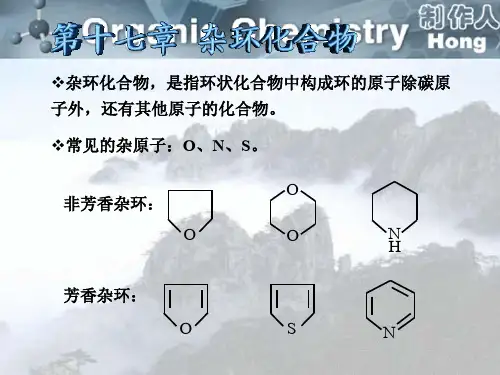
第⼗⼆章杂环化合物第⼗⼆章杂环化合物⼀、定义和分类分⼦中含有由碳原⼦和其它原⼦共同组成的环的化合物称为杂环化合物。
杂环中的⾮碳原⼦称为杂原⼦,最常见的杂原⼦有N 、O 、S 等。
象环醚、内酯、环酐及内酰胺等似乎也应属于杂环化合物。
但是,由于这些环状化合物容易开环形成脂肪族化合物,其性质⼜与相应的脂肪族化合物类似,因此,⼀般不放在杂环化合物中讨论。
本章讨论的是环系⽐较稳定,并且在性质上具有⼀定芳⾹性的杂环化合物。
根据环数的多少分为单杂环和多杂环;单杂环⼜可根据成环原⼦数的多少分为五元杂环及六元杂环等;多杂环稠杂环、桥杂环及螺杂环,其中以稠杂环较为常见。
⼆、命名杂环化合物的名称包括杂环母体及环上取代基两部分。
杂环母环的命名有⾳译法和系统命名法2种。
⾳译法:是⽤外⽂谐⾳汉字加“⼝”偏旁表⽰杂环母环的名称。
如呋喃等。
系统命名法:是把杂环看作杂原⼦转换了相应碳环中的碳原⼦,命名时以相应的碳环为母体,在碳环名称前加上杂原⼦的名称,称为“某(杂)某”。
如吡啶称为氮(杂)苯,喹啉称为1-氮(杂)萘。
杂环母环的编号规则(1)含1个杂原⼦的杂环,从杂原⼦开始⽤阿拉伯数字或从靠近杂原⼦的碳原⼦开始⽤希腊字母编号。
(2)如有⼏个不同的杂原⼦时,则按O 、S 、-NH-、-N=的先后顺序编号,并使杂原⼦的编号尽可能⼩。
(3)有些稠杂环母环有特定的名称和编号原则。
杂环的命名如下:2-硝基吡咯 4-甲基吡啶 2-甲基-5-苯基噻唑α-硝基吡咯γ-甲基吡啶3-甲基-8-羟基喹啉 1-甲基-7-氯异喹啉 1-甲基-2-巯基咪唑 2-呋喃甲醛(糠醛) 2-噻吩磺酸 3-吡啶甲酰胺α-呋喃甲醛α-噻吩磺酸β-吡啶甲酰胺N H NO 2N CH 3N S C 6H 5CH 3N CH 3CH 3N Cl N CH 3N SH O CHO S SO 3H N CONH 2三、五元杂环化合物(⼀)吡咯、呋喃和噻吩1、结构与芳⾹性吡咯环的4个碳原⼦和1个氮原⼦都以SP 2杂化轨道成键。
杂环化合物名词解释
杂环化合物是一类具有杂原子(非碳原子)的环状化合物,其命名方式和结
构特点将在本文中进行解释。
杂环化合物是一类具有杂原子(非碳原子)的环状化合物。
杂环化合物的命名方式与其结构特点相关联。
在有机化学中,碳原子是最常见的原子,但当其他原子如氮、氧、硫等参与到分子中形成环状结构时,我们称其为杂环化合物。
杂环化合物的命名方式遵循一定的规则。
一般来说,首先要确定化合物中的杂原子种类和数量。
常见的杂原子有氮、氧、硫等。
然后,根据杂原子在环上的位置以及它们与碳原子的连接方式,命名中使用相应的前缀和后缀。
以含有氮原子的杂环化合物为例,我们可以根据氮原子的位置和连接方式来命名。
如果氮原子与一个碳原子相连,形成五元环,则称之为吡嗪;如果氮原子与两个相邻的碳原子相连,形成六元环,则称之为噻嗪;如果氮原子与两个不相邻的碳原子相连,形成五元环,则称之为咪唑。
类似地,其他含有不同杂原子的杂环化合物也有相应的命名规则。
例如,含有氧原子的环状化合物称为环醚,含有硫原子的环状化合物称为环硫醚。
杂环化合物具有丰富的结构多样性和广泛的应用领域。
它们在药物、农药、染料等领域中都有重要的应用。
通过调整杂环化合物的结
构和功能团,可以产生不同的化学性质和生物活性,从而满足不同领域的需求。
总结起来,杂环化合物是一类具有杂原子的环状化合物,其命名方式和结构特点与杂原子的种类、位置以及连接方式相关。
通过了解杂环化合物的命名规则和结构特点,我们可以更好地理解和研究这类化合物的性质和应用。
第13章杂环化合物本章重点介绍杂环化合物的分类和命名;五元杂环化合物的结构特点、芳香性、亲电取代反应,六元杂环化合物的结构特点、芳香性、亲核取代反应;五元、六元杂环化合物的衍生物及其生物活性;稠杂环化合物的结构特点等。
在环状有机化合物中,构成环系的原子除碳原子外,还含有一个或多个非碳原子时,叫做杂环化合物(heterocyclic compound);环上除碳以外的原子称为杂原子,常见的杂原子有氧、硫、氮等。
大多数杂环化合物具有不同程度的芳香性,环也比较稳定。
因此,杂环化合物是有机化合物中数量最庞大的一类,约占总数的三分之二以上。
自然界中最具有强烈生物活性的天然有机化合物,绝大多数正是杂环化合物。
例如:对核酸(nucleic acid)的活性起决定作用的碱基就是嘌呤(purine)和嘧啶(pyrimidine)的衍生物。
又如叶绿素(chlorophyll)、氨基酸(amino acid)、维生素(vitamin)、血红素(haeme)、核酸(nucleic acid)、生物碱(alkaloid)等,大多数都在生命的生长、发育、遗传和衰亡过程中起着关键作用。
在现有的药物中,杂环类化合物占了相当大的比重。
它们应用于各种疾病和医疗领域,其数量之大和种类之多,是难以想象的,比如我们非常熟悉的青霉素(benzylpenicillin)、头孢菌素(先锋霉素cephalosporin)、喹喏酮(Quinolone)类以及治疗肿瘤的5–Fu(5–Fluorouracil)、喜树碱(comptothecin)、紫杉醇(Taxol)等,都是含有杂环的化合物。
内酯、交酯、环状酸酐、内酰胺性质上与相应的开链化合物相似,它们不列入杂环化合物中讨论。
本章将着重讨论五元和六元具有芳香性的化合物。
你在学完本章后,应该能回答以下问题:1.你能写出一些常见杂环化合物的结构和名称吗?2.为什么吡咯有一定的酸性而吡啶却显碱性?3.为什么吡啶可以任意比例溶于水,同时又能溶于其它有机化溶剂?4.为什么吡啶既能起亲电取代反应又可进行亲核取代反应?5.你能写出青霉素、头孢菌素、咖啡因、尼群地平、雷米封等常用药物的结构及英文名称吗?13.1 杂环化合物的分类和命名法杂环化合物的分类是以杂环的骨架为基础,按环的形状分为单杂环和稠杂环,最有意义的是五元杂环和六元杂环,详见表13–1。
杂环化合物的命名,长期以来一直比较混乱,通常有“音译法”和根据相应碳环化合物名称“类比取名法”两种。
我国目前已统一采用“音译法”即把杂环化合物的英文名称的汉字译音加上“口”字偏旁。
例如:O S NN呋喃噻吩吡啶吖啶furan thiophene pyridine acridine表13–1 杂环母体化合物的种类杂环的种类重要的杂环五元杂环O S N SNNNHNN345213452134524521345231134521呋喃噻吩吡咯噻唑吡唑咪唑furan thiophene pyrrole thiazole pyrazole imidazole六元杂环N N N NNNN43261453261456124561135吡啶哒嗪嘧啶吡嗪吡喃pyridine pyridazine pyrimidine pyrazine pyran稠杂环NNNH 453261784536174532612喹啉异喹啉吲哚quinoline isoquinoline indole NNN NNH45326178910132689457NNNN45326178吖啶嘌呤喋啶acricine purine pteridine单杂环的命名,首先要确定它的基本名称,如“呋喃”、“吡啶”。
然后给每个“环节”原子编号,并令杂原子处在最小号数位置。
当环上有两个或两个以上相同杂原子时,尽可能使杂原子编号最小;如果其中的一个杂原子上连有氢,应从连有氢的杂原子开始编号。
如环上有多个不同种类杂原子时,则按O、S、N 的顺序排列。
例如:ON SN N 345213452145231咪唑 噻唑 噁唑 imidazole thiazole oxazole当环上有取代基时,要先将取代基的名称放在杂环基本名称前面,并标明位置编号。
例如:N CH 334521N432615CH 3CH 33-甲基吡啶 1,3-二甲基吡咯对于不同程度饱和的杂环化合物,命名时不但要标明氢化(饱和)程度,而且要标出氢化的位置,例如:ON N四氢呋喃 六氢吡啶 2,5-二氢吡咯 tetrahydrofuran piperdine 2,5-dihydrorrol问题13–1 写出α–呋喃甲醇、糠醛、2–氨基–5–甲基噻唑的结构式?13.2 五元杂环化合物呋喃、吡咯、噻唑及它们的衍生物都是非常重要的化合物。
如α-呋喃甲醛 ,俗名糠醛,是一种重要的有机合成原料,吡咯的衍生物广泛分布于自然界,叶绿素、血红素、维生素B 12以及许多生物碱中都含有吡咯环。
13.2.1 结构与性质温习提示:苯、苯胺和硝基苯的结构吡咯、呋喃与噻吩具有相似的电子结构,碳原子与杂原子均以sp 2杂化,碳原子之间以及碳原子与杂原子之间经sp 2杂化轨道组成σ键,并在一个平面上。
每个碳原子和杂原子都剩下一个未参与杂化的p 轨道,互相平行。
碳原子的p 轨道有一个p 电子,而杂原子的p 轨道有2电子,形成了一个环型封闭的6π电子共轭体系,π电子数符合4n +2的规则。
因此,具有一定的芳香性。
杂原子的第三个sp 2杂化轨道中,吡咯有一个电子,与氢原子形成N-H σ键,呋O CHO喃和噻吩有一对未共用电子对(又称孤对电子),详见图13-1。
图13-1 吡咯、呋喃和噻吩的轨道结构示意图由于杂原子上有一对电子参与共轭,电子云平均化的结果,使得杂原子上的电荷向碳环移动,所以极性降低。
在吡咯、呋喃和噻吩中,诱导效应和共轭效应方向相反。
呋喃和噻吩分子中由于分别含有O 、S ,它们的电负性较大,吸电子的诱导效应被给电子的共轭效应部分抵消,因而偶极矩值比相应的饱和化合物小。
而吡咯则由于氮的给电子共轭效应大于吸电子诱导效应,其偶极矩值比相应的饱和化合物大。
呋喃、噻吩和吡咯具有一定程度的芳香性,环比较稳定,芳香性的强弱次序与苯相比为:苯>噻吩>吡咯>呋喃。
13.2.2亲电取代反应温习提示:苯和苯胺的亲电取代反应吡咯、呋喃和噻吩分子中的杂原子有斥电子的共轭效应,能使杂环活化,容易发生亲电取代,难以加成和氧化。
α位的电子云密度比β位大,当发生亲电取代反应时,优先进入α位,而且比苯更易进行。
不同五元杂环化合物发生亲电取代反应的活性顺序为:OSN>>>HO+Br Br二噁烷Oα-溴呋喃N +I IIINaI H 2OI 2+N ++HH四碘吡咯S+I HgOI 2Sα-碘噻吩S+H 2S O 4SS O 3H 室温噻吩磺酸由于吡咯、呋喃的反应活性比噻吩还要大,在强酸条件下,一旦H +与杂原子结合,就会破坏环的共轭体系,环本身被破坏而生成焦油。
所以,呋喃不能直接用硫酸进行磺化反应。
通常采用一种温和的磺化剂——吡啶磺酸:O+OS O 3HS O 吡啶(90%)α-呋喃磺酸而硝化则采用弱硝化剂——硝酸乙酰酯来进行:HN +5℃+H 3COONO HN NO 2HN NO 2(83%)(7%)α-硝基吡咯 β-硝基吡咯S++H 3COONO SNO 2SNO 2(70%)(5%)α-硝基噻吩 β-硝基噻吩呋喃、吡咯和噻吩也能发生付-克反应,如付-克酰基化反应:OOCOCH 3+(CH 3CO)2OBF 3α-呋喃乙酮HN N HCOCH 3+(CH 3CO)2OSnCl 2α-吡咯乙酮S+AlCl 3C 2H 5OClSCOCH 2CH 3α-噻吩丙酮13.2.3 吡咯的酸碱性温习提示:胺的碱性吡咯与相应的胺比较,碱性很弱,吡咯的pK b o 为13.6;而四氢吡咯的pK b o 为2.89。
这是由于吡咯分子中的亚氨基氮原子上未共用电子对参与环的共轭,使N 上的电子云密度降低,若吡咯的氮与H +结合,将破坏共轭体系。
正因为如此,吡咯与水较难形成氢键,致使它难溶于水,而易溶于有机溶剂。
由于共轭的结果,导致氮原子电子云密度降低,结果使N-H 键极性增加,使其表现出弱酸性(pK a o =17.5)。
吡咯在无水条件下可以与固体苛性钾共热成盐。
H 2OHN ++KOHN K13.2.4 吡咯的衍生物吡咯于1858年第一次从骨焦油中被分馏出来,沸点131℃,近年来有报道证实,它是某些烘烤食品的烤香成分之一。
例如:HN O CH 3N O CH 3CH 3N CH 2O这些化合物主要是存在于咖啡、烤花生、烟草中。
吡咯的衍生物广泛分布于自然界,叶绿素、维生素B 12(Vitamin B 12)、血红素、生物碱等中。
在生物体的发育、生长、能量储存和转换、生物之间的各种信息传递乃至死亡腐烂等各个过程的化学作用物质中,几乎都有吡咯衍生物参与。
叶绿素是绿色植物中的光合作用催化剂(结构式如图13-2所示)。
而血红素则存在于乳动物的红细胞中,与蛋白质结合成血红蛋白,是运输氧和二氧化碳的载体(结构式如图13-3所示)。
维生素B 12分子(结构式如图13-4所示)是1984年由动物肝脏中提取到的一种深红色2CH 332H 3C H 3CCH 3CH 3CH 3CH叶绿素(chlorophyll ) R=–CH 3为叶绿素a ;R=–CHO 为叶绿素b图13-2 叶绿素结构式2CONH 2H 2H 22CH 2CONH 2HNOCH 22CONH233H 2C CHCH 3O POOO HOCH 2OHN NCH CH HOOCH 2223CH 2H 3H 3图13-4 维生素B 12的结构式 图13-3 血红素的结构式结晶,而后直到1972年才由Woodward 等人完成了人工全合成。
历时二十余年,正是在合成B 12的基础上,Woodward 等人提出了分子轨道对称守恒定则。
这三种化合物都是生物体中维系生命现象的重要活性物质,虽然前者存在于植物体中,后两者存在于动物体中,但在分子结构上却惊人的相似,即都具有一个卟吩结构,环中都有一个金属离子。
N HN NHN卟吩 13.2.5 咪唑及其衍生物吡咯环上3位的CH 被氮原子取代生成的化合物称为咪唑(结构式见表14-1),咪唑3位的氮也是以sp 2杂化轨道成键,但与吡咯1位氮不同,吡咯分子中氮是以一对p 电子参与共轭,而咪唑中3位氮以一个p 电子参与共扼;在咪唑形成的大π键中也有六个π电子,符合H ückel 规则,具有一定的芳香性。
咪唑是吡唑的异构体,两个氮原子相隔一个碳原子。
两者分子中相应的两个N 原子的成键方式相同,其中一个氮原子的未共用电子对与吡咯一样,参与杂环共轭体系,另一个氮原子未共用电子对(或称孤对电子)未参与杂环共轭体系,既能与水形成氢键,又能与质子结合,因此咪唑、吡唑的碱性比吡咯碱性强,水溶度也比吡咯大(见表13-2)。