杂环化合物
- 格式:doc
- 大小:727.35 KB
- 文档页数:14






杂环化合物定义杂环化合物是一类含有至少一个杂原子(指不是碳原子的原子)的碳氢化合物。
它们的分子结构通常包括一个或多个环,并含有不同的杂原子,如氮、氧、硫等,这赋予了它们独特的化学性质和功能。
一、杂原子1.1 氮杂环化合物其中最常见的是咪唑和嘧啶。
在咪唑中,氮原子是在环上的。
它使它在一些细胞信号转导、 RNA 与 DNA 的生物合成中扮演重要角色。
而嘧啶含有两个氮原子,一个位于环中,另一个则连接着杂环。
1.2 氧杂环化合物这类化合物通常包括呋喃、吡咯烷酮、吡喃等。
多用于制药、农药、染料等领域。
1.3 硫杂环化合物例如噻吩和二恶硫。
其中噻吩可以作为一些染料、润滑油和药物的原料,因为它具有防腐和抗氧化的作用。
二、杂环的特点2.1 可通过不同的杂原子以及相对排列方式制造出种类繁多的化合物。
2.2 杂环化合物具有多种多样的化学和生物活性,因此成为了广泛应用的重要原料。
2.3 杂环亦能改变化合物的分子形状和分子间的各种不同相互作用,从而加强添加物的分子间相互作用力,其作用值得深入挖掘。
三、杂环的应用3.1 杂环化合物广泛应用于医药领域,如抗生素、抗肿瘤药物、心血管药物等的制造。
3.2 在新型材料的研究中,杂环化合物作为一种功能性的化合物,拥有广泛的应用前景。
3.3 杂环化合物也被用于新型铀和镎的萃取分离和控制核材料的制备。
结语杂环化合物是一类特别的有机化合物,以其多样的结构和广阔的应用领域而被广泛使用。
期望在未来,随着人们对其的进一步研究,可以开发出更为优异的化合物及其应用。



第10章杂环化合物第10章杂环化合物§杂环化合物的分类和命名分类1、按照环的多少分类单杂环:常见的是五元杂环和六元杂环,环上的杂原⼦有⼀个或两个。
五元杂环:六元杂环:吡喃没有芳⾹性,⽣成盐后则具有芳⾹性。
稠杂环:由苯环与单杂环或两个以上单杂环稠合⽽成的。
命名常见的基础杂环多数是具有芳⾹性的,命名时作为杂环化合物的母核。
1、⾳译法中⽂名称采⽤⾳译法,⽤带⼝字旁的同⾳汉字表⽰。
对于⽆特定名称的杂环化合物,中国化学会1980年颁布的有机化学命名原则规定:采⽤“杂”字作介词,把杂环看作是相应的碳环母核中碳原⼦被杂原⼦置换后的衍⽣物来命名。
国外现在采⽤的Hantzsch-Widman系统,规范了10元以下⼀般杂环的词尾词⼲的书写格式。
为了正确表明取代基位置,需将杂环母核编号,编号规则主要有:(1)含⼀个杂环原⼦的单杂环,从杂原⼦开始编号。
有时也使⽤希腊字母,把靠近杂原⼦的位置叫做α位,其次是β位,再其次是γ位。
(2)含两个及以上相同杂环原⼦的单杂环,编号从连有氢原⼦的杂原⼦开始,并使另⼀杂原⼦所在位次保持最⼩。
(3)含两个及以上不同杂环原⼦的单杂环,编号从价数⼩杂原⼦开始,价数相同时则从原⼦序数⼩的开始。
因此,常见杂原⼦编号优先顺序为O、S、N。
⼀般常见的稠杂环有特定的编号,或是沿⽤习惯。
§五元杂环化合物结构和物理性质1、结构这三种杂环上的原⼦都是sp2杂化,为平⾯结构。
每个碳原⼦垂直于环平⾯的p轨道有⼀个电⼦,杂原⼦垂直于环平⾯的p轨道有⼆个电⼦。
三种杂环π电⼦数都是6个,符合休克尔规则,都具有⼀定的芳⾹性。
结构特点:杂原⼦sp2杂化,未成键电⼦对在2p轨道上,参与共轭。
从吡咯的共振式看出,杂原⼦氮上部分负电荷分布到了碳原⼦上。
杂原⼦共轭效应是推电⼦的,诱导效应是吸电⼦的。
由于6个π电⼦分布于5个原⼦上,整个环的π电⼦⼏率密度⽐苯⼤,是富电⼦芳环。
因⽽⽐苯环活泼,亲电取代反应⽐苯快得多。

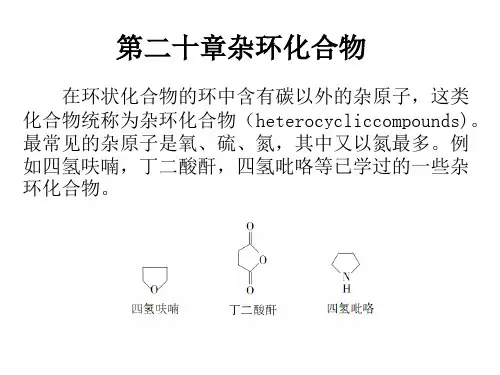
第⼗⼆章杂环化合物第⼗⼆章杂环化合物⼀、定义和分类分⼦中含有由碳原⼦和其它原⼦共同组成的环的化合物称为杂环化合物。
杂环中的⾮碳原⼦称为杂原⼦,最常见的杂原⼦有N 、O 、S 等。
象环醚、内酯、环酐及内酰胺等似乎也应属于杂环化合物。
但是,由于这些环状化合物容易开环形成脂肪族化合物,其性质⼜与相应的脂肪族化合物类似,因此,⼀般不放在杂环化合物中讨论。
本章讨论的是环系⽐较稳定,并且在性质上具有⼀定芳⾹性的杂环化合物。
根据环数的多少分为单杂环和多杂环;单杂环⼜可根据成环原⼦数的多少分为五元杂环及六元杂环等;多杂环稠杂环、桥杂环及螺杂环,其中以稠杂环较为常见。
⼆、命名杂环化合物的名称包括杂环母体及环上取代基两部分。
杂环母环的命名有⾳译法和系统命名法2种。
⾳译法:是⽤外⽂谐⾳汉字加“⼝”偏旁表⽰杂环母环的名称。
如呋喃等。
系统命名法:是把杂环看作杂原⼦转换了相应碳环中的碳原⼦,命名时以相应的碳环为母体,在碳环名称前加上杂原⼦的名称,称为“某(杂)某”。
如吡啶称为氮(杂)苯,喹啉称为1-氮(杂)萘。
杂环母环的编号规则(1)含1个杂原⼦的杂环,从杂原⼦开始⽤阿拉伯数字或从靠近杂原⼦的碳原⼦开始⽤希腊字母编号。
(2)如有⼏个不同的杂原⼦时,则按O 、S 、-NH-、-N=的先后顺序编号,并使杂原⼦的编号尽可能⼩。
(3)有些稠杂环母环有特定的名称和编号原则。
杂环的命名如下:2-硝基吡咯 4-甲基吡啶 2-甲基-5-苯基噻唑α-硝基吡咯γ-甲基吡啶3-甲基-8-羟基喹啉 1-甲基-7-氯异喹啉 1-甲基-2-巯基咪唑 2-呋喃甲醛(糠醛) 2-噻吩磺酸 3-吡啶甲酰胺α-呋喃甲醛α-噻吩磺酸β-吡啶甲酰胺N H NO 2N CH 3N S C 6H 5CH 3N CH 3CH 3N Cl N CH 3N SH O CHO S SO 3H N CONH 2三、五元杂环化合物(⼀)吡咯、呋喃和噻吩1、结构与芳⾹性吡咯环的4个碳原⼦和1个氮原⼦都以SP 2杂化轨道成键。
第10章杂环化合物§10.1 杂环化合物的分类和命名10.1.1 分类1、按照环的多少分类❖单杂环:常见的是五元杂环和六元杂环,环上的杂原子有一个或两个。
❒五元杂环:❒六元杂环:❒吡喃没有芳香性,生成盐后则具有芳香性。
❖稠杂环:由苯环与单杂环或两个以上单杂环稠合而成的。
10.1.2 命名常见的基础杂环多数是具有芳香性的,命名时作为杂环化合物的母核。
1、音译法中文名称采用音译法,用带口字旁的同音汉字表示。
对于无特定名称的杂环化合物,中国化学会1980年颁布的有机化学命名原则规定:采用“杂”字作介词,把杂环看作是相应的碳环母核中碳原子被杂原子置换后的衍生物来命名。
⏹国外现在采用的Hantzsch-Widman系统,规范了10元以下一般杂环的词尾词干的书写格式。
❖为了正确表明取代基位置,需将杂环母核编号,编号规则主要有:(1)含一个杂环原子的单杂环,从杂原子开始编号。
有时也使用希腊字母,把靠近杂原子的位置叫做α位,其次是β位,再其次是γ位。
(2)含两个及以上相同杂环原子的单杂环,编号从连有氢原子的杂原子开始,并使另一杂原子所在位次保持最小。
(3)含两个及以上不同杂环原子的单杂环,编号从价数小杂原子开始,价数相同时则从原子序数小的开始。
❒因此,常见杂原子编号优先顺序为O、S、N。
⏹一般常见的稠杂环有特定的编号,或是沿用习惯。
§10.2 五元杂环化合物10.2.1 结构和物理性质1、结构这三种杂环上的原子都是sp2杂化,为平面结构。
⏹每个碳原子垂直于环平面的p轨道有一个电子,杂原子垂直于环平面的p轨道有二个电子。
❖三种杂环π电子数都是6个,符合休克尔规则,都具有一定的芳香性。
❖结构特点:杂原子sp2杂化,未成键电子对在2p轨道上,参与共轭。
从吡咯的共振式看出,杂原子氮上部分负电荷分布到了碳原子上。
⏹杂原子共轭效应是推电子的,诱导效应是吸电子的。
⏹由于6个π电子分布于5个原子上,整个环的π电子几率密度比苯大,是富电子芳环。
因而比苯环活泼,亲电取代反应比苯快得多。
❖芳香性顺序:苯>噻吩>吡咯>呋喃,这与杂原子电负性顺序相反,从离域能数据也得出这一结论。
❖三种杂环都具有共轭二烯烃结构,芳香性最弱的呋喃可以顺利地进行双烯合成反应。
2、物理性质❖呋喃:无色液体,难溶于水,有氯仿的气味。
与盐酸浸过的松木片反应,显绿色。
❖吡咯:无色液体,有苯胺的气味,难溶于水。
与盐酸浸过的松木片反应,显红色。
❖噻吩:无色液体,不溶于水。
在硫酸存在下和吲哚醌作用,显蓝色。
10.2.2 质子化反应呋喃、噻吩、吡咯在酸的作用下可质子化,反应主要发生在α-C上。
⇨由于α-C的质子化反应,吡咯在强酸作用下会因聚合而被破坏。
在稀的酸性水溶液中,呋喃的质子化在氧上发生并导致水解开环。
10.2.3 亲电取代反应1、亲电取代的活性a、杂原子对环上电子的贡献为:N最多,O其次,S最少;b、亲电取代反应的活性为:吡咯>呋喃>噻吩>苯>吡啶。
c、由于呋喃、吡咯、噻吩环上的π电子云分布不匀,亲电取代反应主要发生在α-位上。
(1)芳香性对亲电取代的影响⏹噻吩、吡咯的芳香性较强,所以易取代而不易加成;⏹呋喃的芳香性较弱,更像二烯醚,亲电取代往往是通过加成-消除的方式进行的。
(2)环的稳定性对亲电取代的影响⏹吡咯在强酸性溶液中容易聚合或开环,因此亲电取代反应不能在强酸性溶液中进行。
⏹噻吩对酸不如吡咯和呋喃敏感,可以用硫酸磺化,用混酸硝化。
2、卤化反应①低温;②溶剂稀释等温和条件3、硝化反应①乙酰基硝酸酯作催化剂;②低温⏹应在较低的温度下,使用温和的硝化剂乙酰硝酸酯。
⏹呋喃比较特殊,先生成稳定的或不稳定的2,5-加成产物,然后加热或用吡啶除去乙酸,得到硝化产物。
原因:呋喃芳香性较弱。
4、磺化反应①吡咯、呋喃:吡啶与三氧化硫的加合物作磺化剂;②噻吩:R.T.下硫酸直接磺化吡咯、呋喃不太稳定,所以须用温和的磺化试剂磺化,常用吡啶与三氧化硫的加合化合物作磺化试剂。
噻吩和硫酸在室温下就能顺利地进行磺化,生成的噻吩磺酸能溶于硫酸中。
常用这个反应除去苯中的噻吩,苯和噻吩的沸点接近,不能用蒸馏的方法分离。
5、Friedel—Crafts酰基化反应呋喃、噻吩的酰化反应在α-C上发生,呋喃要用较温和的催化剂SnCl4、BF3等。
噻吩的酰化反应可以用酸催化。
吡咯的酰化反应,不用催化剂就顺利进行,既能在α-C上发生,又能在N上发生。
但在α-C 上发生比在N上发生容易。
10.2.4 亲电取代反应中的基团定位效应1、β位有取代基(1)β位有第二类定位基,后续基团进入不相邻的α位;(2)β位有第一类定位基,后续基团进入相邻的α位。
2、α位有取代基(1)当Z=O时,不论呋喃的α位是何种类型定位基,则后续基团均进入另一α位。
(2)当Z=N、S时,α位有第二类定位基,后续基团进入不相邻的β位;α位有第一类定位基,则后续基团进入另一α位。
10.2.5 加成反应1、催化加氢反应活性与芳香顺序相反:呋喃>吡咯>噻吩。
噻吩可以停留在二氢化物阶段,也不能用钯催化,因为噻吩能使钯催化剂中毒。
2、双烯合成呋喃、吡咯、噻吩都含有共轭二烯结构,理论上都应该能发生Diels-Alder反应。
芳香性最弱的呋喃很容易进行双烯合成反应,和顺丁烯二酸酐加成,主要生成内式异构体。
吡咯一般不发生双烯合成。
噻吩基本上不发生双烯加成,即使在个别情况下生成也是一个不稳定的中间体,直接失硫转化为别的产物。
10.2.6 吡咯的特殊性质1、酸碱性(1)弱碱性吡咯的碱性极弱,原因是氮上的未共用电子对参与了环的共轭体系,减弱了与H+的结合能力。
碱性:吡咯<苯胺。
(2)弱酸性吡咯氮原子上的氢有微弱的酸性。
⏹酸性:乙醇<吡咯<苯酚❖酸碱性应用:A、吡咯能与固体氢氧化钾加热成为钾盐:B、吡咯与格氏试剂作用生成吡咯卤化镁和烷烃:2、活泼芳环的性质(1)与重氮盐偶联(2)Reimer-Tiemann反应(3)Kolbe反应10.2.7 呋喃、吡咯、噻吩的制法1、呋喃的制备呋喃很容易由呋喃甲醛脱羰基制得2、吡咯的制备吡咯可用呋喃与氨在高温下反应得到。
吡咯还可以用乙炔和甲醛经丁炔二醇合成。
3、噻吩噻吩可用丁烷与硫、丁烯与二氧化硫在高温下反应得到。
§10.3 六元杂环化合物六元杂环化合物中重要的有吡啶、嘧啶和吡喃等。
其中吡啶是重要的有机碱,嘧啶是组成核糖核酸的重要生物碱母体。
10.3.1 吡啶的结构和物理性质 1、结构吡啶是含有一个氮原子的六元杂环化合物,分子中的成键情况和苯相似:由于环上氮原子的吸电子作用,使吡啶成为缺电子芳环。
2、物理性质⏹ 吡啶为有特殊臭味的无色液体;⏹ 熔点-42℃,沸点115.5℃,相对密度0.982; ⏹ 可以和水混溶,能溶解许多有机物和无机物;⏹ 由于吡啶的性质比较稳定,在有机合成中常用作溶剂和反应介质。
10.3.2 吡啶的化学性质❖ 吡啶碱性较强,可看作3°胺;❖ 环不易发生亲电取代反应但易发生亲核取代反应。
1、亲电取代反应吡啶环上氮原子为吸电子基,故吡啶环属于缺电子的芳杂环。
⇨ 吡啶亲电取代反应的特点:杂原子的共轭效应和诱导效应都是吸电子的;未成键电子对在sp 2杂化轨道上,不参与共轭。
a、吡啶环上杂原子N的定位效应和硝基相似,可以看作是一个间位定位基,亲电取代反应主要在β-位上。
b、反应比苯难,条件要求很高;不能发生傅-克烷基化、酰基化反应。
c、硝化、磺化、卤化必须在强烈条件下才能发生:(1)卤化反应吡啶氯代要用AlCl3催化且要加热,苯氯代用FeCl3催化不用加热;(2)磺化反应吡啶磺化要用发烟H2SO4并要加热,苯磺化用浓H2SO4即可顺利进行;(3)硝化反应⏹吡啶环上有推电子基团时,反应活性增高。
2、氧化和还原(1)吡啶环对氧化剂稳定,一般不被酸性高锰酸钾或重铬酸钾氧化。
(2)和氧化剂作用时,通常是侧链烃基被氧化成羧基。
(3)用过氧化氢氧化,可得N-氧化吡啶,N-氧化吡啶较容易发生亲电取代,取代基主要进入γ-位。
(4)吡啶比苯容易还原,用钠加乙醇、催化加氢均使吡啶还原为六氢吡啶。
3、亲核取代反应亲核取代反应是吡啶环特有的反应,取代基进入α-位。
⇨原因:吡啶环电子几率密度低(和苯相比) 。
吡啶与固体氨基钠一起加热,生成2-氨基吡啶。
4、吡啶的碱性吡啶分子中氮原子上有一对未共用电子没有参加共轭,可以和质子结合,碱性比苯胺稍强,但比氨弱。
碱性强弱的顺序:①②因此,吡啶可以和无机酸生成盐。
吡啶在结构上属于环状叔胺,因此可以和卤代烃作用生成季铵盐,加热到290~300℃后,可发生重排反应。
有时,N-烷基化可用活泼亚甲基化合物与I2来完成。
氮上的未共用电子对还可以结合SO3,生成吡啶三氧化硫。
§10.4 喹啉和异喹啉10.4.1 结构及其物理性质1、结构喹啉和异喹啉都是由一个苯环和一个吡啶环稠和而成的。
分子中所有原子都在同一平面内,具有芳香性。
2、物理性质喹啉为无色油状液体,沸点238℃,常用作高沸点溶剂;异喹啉为低熔点固体,熔点26℃。
10.4.2 化学性质喹啉分子中吡啶环上碳原子的电子云密度,低于与之并联的苯环,异喹啉也存在类似情况。
⏹喹啉的亲电取代反应发生在电子云密度较大的苯环上,取代基主要进入5-或8-位。
⏹亲核取代则主要发生在吡啶环的2-或4-位。
⏹受到并联的苯环影响,喹啉的碱性比吡啶稍弱。
1、亲电取代反应:反应比吡啶容易,取代基进入5,8-位。
2、亲核取代反应:取代基进入α-位3、氧化反应:用强氧化剂氧化喹啉时,苯环破裂4、还原反应:发生在吡啶环上10.4.3 喹啉和异喹啉的合成1、Skraup法原料为苯胺和甘油,将原料与脱水剂浓硫酸、氧化剂硝基苯共热制得。
【反应历程】选择不同的苯胺衍生物为原料,可以合成不同的喹啉衍生物。
2、Doebner-Miller反应用不同的α,β-不饱和醛、酮代替甘油,也能合成不同的喹啉衍生物,这一反应称为Doebner-Miller反应。
实际操作为一次投料,但反应是分步进行的。