热力学函数间的关系
- 格式:ppt
- 大小:794.50 KB
- 文档页数:19








第一章热力学函数及其相互关系(1):热力学状态与气体方程系统与环境、平衡状态、非平衡状态、稳定状态、可逆过程与不可逆过程、局部平衡、部分平衡与介稳平衡、温标的发展、热力学温标、理想气体定律、van der Waals状态方程、virial方程、Redlich-Kwong方程、实际气体的液化与临界现象、对应态理论1.1系统、环境、热力学状态1.1.1 系统与系统的环境热力学把相互联系的客观真实世界区分为系统与系统的环境两部分。
系统(system)是我们要研究的那部分真实世界,即我们要研究的那部分物质或空间。
假如要研究一台运行着的热机汽缸内气体性质的变化,或者要研究一反应器中的全部物质,就分别是两种不同情况下的系统。
又如一氧气缸瓶在不断地向外喷射氧气,我们要研究喷射过程到某阶段时钢瓶中剩余氧气的性质,则该瞬间瓶中残留的氧应当是系统。
以往的书刊中曾用过一些系统的同义词,例如“物系”、“体系”等等。
系统的环境(surroundings)是系统以外与之相联系的真实世界,可以简单称为环境或外界。
需要指出,系统与环境之间可以有实际存在的边界隔开,例如上述汽缸、反应器壁等;也可能在系统与环境间只有假象的边界隔开,例如上述氧气瓶中作为系统的残留氧气与喷射出去的那些氧气本来是存在于同一钢瓶中,它们之间没有任何间隔,而喷射出去的那些氧气实际是环境的一部分。
系统与环境之间的联系包括有能量交换与物质交换两类。
针对二者之间联系情况的差别,可以把系统分成以下三种:(1) 隔离系统(孤立系统, isolated system)隔离系统(孤立系统)与环境之间既无能量交换,又无物质交换,所以环境对隔离系统中发生的任何变化不会有任何影响。
在热力学中,有时我们把所研究的系统及该系统的环境作为一个整体来看待,这个整体就应当是隔离系统。
(2)封闭系统(closed system)封闭系统与环境之间只有能量交换而无物质交换。
在前面提到的几个系统中,物质均被封闭于实有的容器间壁内或假象的边界内,使系统仅能通过界面与环境有热、功等形式的能量交换,故应当属于封闭系统。


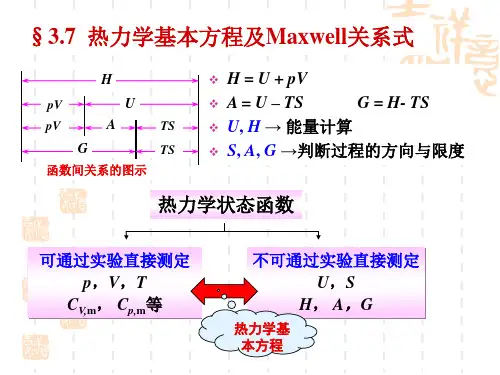
至今讨论中常应用的八个热力学函数--p、V、T、U、H、S、A、G。
其中 U 和 S 分别由热力学第一定律和第二定律导出;H、A、G 则由定义得来。
而 U、H、A、G 为具有能量量纲的函数。
这些热力学函数间通过一定关系式相互联系着。
基本热力学关系式共有十一个(以下分别用公式左边括弧中的数字标明)。
从这十一个基本关系式出发,可以导出许多其它衍生关系式,它们表示出各不同物理量间的相互关系,利用它们可以帮助我们由易于直接测量的物理量出发以计算难于直接测量的物理量的数值。
由定义可得如下三个关系式:(1) (3-136)(2) (3-137)(3) (3-138)又由热力学第一定律、第二定律联合公式,在无非膨胀功条件下:将它和式(3-136)、(3-137)、(3-138)联系起来:即可得以下四个一组被称为恒组成均相封闭系统的热力学基本方程。
又称 Gibbs 方程。
(4) (3-139)(5) (3-140)(6) (3-141)(7) (3-142)这四个基本方程均不受可逆过程的限制,因为 U、H、A、G 等随着相应两个独立的状态函数变化而变化,因而与变化的具体途径(可逆或不可逆)无关,自然亦可用于不可逆过程。
公式虽然是四个,但式(5)、(6)、(7)实际上是基本公式(4)在不同条件下的表示形式。
根据全微分定义可有如下关系:(3-143)(3-144)(3-145)(3-146)式(3-139)与式(3-143)对比、式(3-140)与式(3-144)对比、式(3-141)与式(3-145)对比、式(3-142)与式(3-146)对比,可得如下关系(或称"对应系数式"):(3-147)(3-148)(3-149)和 (3-150)如分别将尤拉(Euler)定则:应用于热力学基本方程(4)、(5)、(6)、(7)可得如下四式:(8) (3-151)(9) (3-152)(10) (3-153)(11) (3-154)这四式常称为"麦克斯威关系式"。
热力学一般关系(热学-高等数学-偏微分)第二部分工质的热力性质六热力学函数的一般关系式由热力学基本定律引出的一些基本热力学状态函数(如内能U、熵S)及其为某一研究方便而设的组合函数(如焓H、自由能F、自由焓G等)许多都是不可测量,必须将它们与可测量(如压力p、体积V、温度T等)联系起来,否则我们将得不到实际的结果,解决不了诸如上一章讲的最大功计算等一些具体的问题。
这就需要发展热力学的数学理论以将热力学基本定律应用到各种具体问题中去。
热力学函数一般关系式 全微分性质+基本热力学关系式6.1 状态函数的数学特性对于状态参数,当我们强调它们与独立变量的函数关系时,常称它们为状态函数。
从数学上说,状态函数必定具有全微分性质。
这一数学特性十分重要,利用它可导出一系列很有实用价值的热力学关系式。
下面我们扼要介绍全微分的一些基本定理。
设函数),(y x f z =具有全微分性质dy y z dx x z dz xy ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂= (6-1) 则必然有(1) 互易关系令式(6-1)中),(y x M x z y=⎪⎪⎭⎫⎝⎛∂∂,),(y x N y z x=⎪⎪⎭⎫⎝⎛∂∂ 则 y xx N yM ⎪⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫⎝⎛∂∂ (6-2)互易关系与⎰=0dz 等价。
它不仅是全微分的必要条件,而且是充分条件。
因此,可反过来检验某一物理量是否具有全微分。
(2) 循环关系当保持z 不变,即0=dz 时,由式(6-1),得0=⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂z xz y dy y z dx x z则 xy zy z x z x y ⎪⎪⎭⎫ ⎝⎛∂∂⎪⎪⎭⎫⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂ 故有 1-=⎪⎪⎭⎫⎝⎛∂∂⎪⎪⎭⎫⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂yz x z x x y y z (6-3)此式的功能是:若能直接求得两个偏导数,便可确定第三个偏导数。
结果也很容易记忆,只需将三个变量依上、下、外次序,即))()((xzy yxz zyx 循环就行了。
用特性函数G与特征变量p,T求所有热力学函数的表达式1.热力学函数间的关系(1) H=U+pV(2) A=U-TS(3) G=H-TS(4) G=A+pV根据定义,五个热力学函数有如下关系。
这些关系一方面反映了体系的热力学函数之间的联系,另一方面可以利用这种关系从已知函数值求未知函数值。
它们的关系用图示的方法可看得更清楚。
(1) 这是焓的定义式,因为在等压,不作非膨胀功的条件下,焓变等于等压热效应。
等压热效应容易测定,所以定义了焓。
(2) 这是亥姆霍兹自由能的定义式。
在等温可逆条件下,亥氏自由能的降低等于对外所作的最大功,可以衡量体系的作功能力,所以又称功函。
(3) 这是吉布斯自由能的定义式。
在等温等压可逆条件下,吉布斯自由能的下降等于对外所作的最大非膨胀功。
(4) 从上面三个公式可导出G与A之间的关系式,该式也可看作吉布斯自由能的定义式.2. 用特性函数G与特征变量p,T求所有热力学函数的表达式。
用特性函数及其特征变量可以求出所有热力学函数的表达式。
现以吉布斯自由能G为特性函数,其特征变量为T,p,从而求出热力学能,焓,熵,亥氏自由能和体积的表达式。
之所以可以这样做是因为U,H,S,A,G,T,p,V这8个量之间只有两个变量是独立的,其它都是这两个变量的函数。
所有根据两个变量热力学函数之间的关系可以写出其它热力学量的表达式。
画面中间是G与特征变量T,p之间的关系式。
(1) 保持p不变,对T求偏导,得到熵的表达式(2) 保持T不变,对p求偏导,得到体积V 的表达式(3) 根据焓的定义式代入熵的表达式,得到焓的表达式(4) 根据亥氏自由能的定义式,代入体积的表达式,得到亥氏自由能的表达式(5) 根据焓的定义式,代入焓和体积的表达式,就得到热力学能的表达式。
热力学中的热力学平衡与热力学势函数热力学是研究能量转化和传递的科学领域,而热力学平衡和热力学势函数则是热力学理论中的重要概念。
本文将着重讨论热力学平衡与热力学势函数的内涵、应用及其相互关系。
一、热力学平衡的概念与条件热力学平衡指的是在封闭系统中,系统各部分之间达到一种稳定状态,不再发生宏观可视化变化的状态。
在热力学平衡状态下,系统各部分之间的各项物理量呈现均衡状态,包括温度、压力、浓度等。
而要使系统达到热力学平衡,需要满足热力学平衡条件。
热力学平衡条件主要有三个方面。
首先是热力学平衡的力学条件,即系统各处物体的压力要相等。
其次是热力学平衡的热力学条件,即系统各处温度要相等。
最后是热力学平衡的物质平衡条件,即系统内各种组分的浓度要达到稳定状态。
二、热力学势函数的定义与特点热力学势函数是热力学系统的特性函数,它描述了系统在不同平衡态下的性质,并通过热力学势函数的变化来判断系统的稳定状态。
常见的热力学势函数包括内能、焓、自由能和吉布斯自由能等。
1. 内能(U)是描述系统内部能量的函数,它包括了系统的热能和势能。
内能的变化与系统的热交换和功交换有关,通过内能的变化可以判断系统的热力学状态。
2. 焓(H)是内能和系统对外界做功之和,它常用于描述恒压过程中的能量变化。
焓的变化可以提供系统在常压条件下的稳定性信息。
3. 自由能(F)是描述系统在恒温恒压条件下的稳定性的函数。
自由能分为哈密顿函数和亥姆霍兹函数,它们与系统的熵和能量有关。
通过自由能的变化可以判断系统的热力学稳定性。
4. 吉布斯自由能(G)是描述系统在恒温恒压条件下的稳定性和平衡的函数。
吉布斯自由能与自由能类似,但它是在恒压条件下选择的理想势函数,广泛应用于化学反应和相平衡的研究。
三、热力学平衡与热力学势函数的关系热力学平衡与热力学势函数有着密切的关系。
热力学平衡的达成正是通过热力学势函数的最小值原理来实现的。
对于一个封闭系统,当系统处于热力学平衡时,它的热力学势函数将达到最小值。