元素就是具有相同即核电荷数
- 格式:ppt
- 大小:640.00 KB
- 文档页数:33

化学名词解释1、元素——具有相同核电荷数的同一类原子的总称。
2、单质——由同一种元素组成的物质。
3、化合物——由两种或两种以上元素的原子组成的物质。
4、纯净物——凡含有一种单质或一种化合物的物质。
5、混合物——由几种不同的单质或化合物混杂在一起形成的物质。
6、化学变化——物质在发生变化时有新物质生成的变化叫做化学变化,也叫做化学反应。
7、酸——能在水中电离释放出阳离子且全部是氢离子的化合物。
8、碱——能在水中电离释放出阴离子且全部是氢阳根离子的化合物。
9、盐——金属离子与酸根离子组成的化合物。
10、摩尔浓度——1升溶液中含有溶质的摩尔数。
11、电解质——化学上把溶于水后或在熔融状态下能导电的物质叫电解质。
12、误差——测量值和真实值之间的差异叫误差。
13、硬度——指水中某些易于形成沉淀的金属离子,通常指钙镁离子含量14、酸度——水中含有能接受氢阳根离子的物质的量的总和。
15、碱度——表示水中氢阳根、碳酸根、重碳酸根及其他一些弱酸盐类的总和。
16、指示剂——滴定分析中,通过改变颜色指示化学计量点的试剂。
17、滴定终点——在滴定分析中,指示剂变色点称为滴定终点。
18、标准溶液——在分析中,已知准确浓度的溶液。
19、掩蔽剂——一种能与干扰离子起作用而不影响试验结果的试剂。
20、生水——未经任何处理的天然水(江、河、湖、地下水等)。
21、碱性水——其特征是碱度大于硬度的水。
22、锅炉补给水——生水经各种方法净化处理后,用来补充热力发电厂汽水损失的水。
23、给水——送进锅炉的水。
24、炉水——在锅炉本体的蒸发系统中流动的水。
25、凝结水——在汽轮机中作功后的蒸汽冷凝成的水。
26、冷却水——用作冷却介质的水。
27、疏水——指各种蒸汽管道和用汽设备中的蒸汽凝结水。
28、PH——氢离子浓度的负对数。
29、Pna——钠离子浓度的负对数。
30、树脂的工作交换容量——树脂在实际条件下对离子的交换吸附能力。
31、树脂的再生——使实效树脂恢复其对离子的交换吸附能力的操作。

元素的定义初中化学元素的定义是初中化学中的基础概念之一。
元素是物质世界中最基本的构成单位,是由一类具有相同原子核电荷数的原子组成的纯粹物质。
在化学中,元素是化学反应的基础,是构建物质世界的基本组成部分。
元素的定义可以从不同的角度进行解释。
从原子的角度来看,元素是由具有相同原子核电荷数的原子组成的物质。
每个元素都有一个特定的原子核电荷数,即原子序数,用来表示该元素在元素周期表中的位置。
例如,氢元素的原子核电荷数为1,氧元素的原子核电荷数为8。
不同元素的原子核电荷数不同,因此它们的性质也不同。
从化学符号的角度来看,元素是由不同的化学符号表示的。
化学符号是用来表示元素的简写方式,由一个或两个字母组成。
例如,氢元素的化学符号为H,氧元素的化学符号为O。
通过化学符号,我们可以快速地识别和表示不同的元素。
从元素周期表的角度来看,元素是按照一定规律排列在元素周期表上的。
元素周期表是由俄罗斯化学家门捷列夫于1869年提出的一种化学元素分类表。
它将元素按照其原子核电荷数的增加顺序排列,并将具有相似性质的元素放在同一列。
元素周期表的排列使得我们能够更好地理解和研究元素的性质和变化规律。
元素在自然界中广泛存在,包括地壳、大气层、水体等。
目前已经发现的元素有118个,其中92个是自然界中常见的元素,剩下的元素是人工合成的。
不同的元素具有不同的性质和用途。
例如,氧元素是呼吸和燃烧的必需物质,铁元素是制造钢铁的重要原料,金元素具有良好的导电性和耐腐蚀性,被广泛应用于珠宝和电子工业等领域。
元素在化学反应中起着重要的作用。
化学反应是指物质之间发生的变化,既包括物质的组成变化,也包括物质的性质变化。
在化学反应中,元素可以被转化为其他元素或化合物。
例如,氧元素可以与氢元素反应生成水,铁元素可以与氧元素反应生成铁锈。
元素的转化和组合使得我们能够利用化学反应来制备新的物质或改变物质的性质。
元素是构成物质世界的基本单位,是化学反应的基础。




课题3 元素一、教学目标知识与技能(1)了解元素的概念,将对物质的宏观组成与微观结构的认识统一起来。
(2)了解元素符号所表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号。
(3)初步认识元素周期表,知道它是学习和研究化学的工具,能根据原子序数在元素周期表中找到指定元素和有关该元素的一些其他的信息。
过程与方法(1)学习运用对比的方法获取信息。
(2)学习运用寻找规律性和特殊性的方法处理信息。
情感态度与价值观(1)保持对化学的浓厚兴趣。
(2)不向困难低头,相信随着知识的积累,所有的问题都会迎刃而解。
(3)逐步积累化学用浯,真正进入一个化学世界。
二、教学重点1.元素的概念。
2.元素符号的书写和意义。
三、教学难点1.元素概念的形成。
2.元素符号的书写和意义。
3.元素周期表的排列规律和相关信息。
四、课时安排2课时除这种碳原子外,还有质子数为6而中子数不同的碳原子,所以元素概念中的一类原子指的是核电荷数相同而核内中子数并不一定相同的一类原子。
搞清楚了元素的概念。
我们再来看元素有哪些特点。
2.特点由定义可知,元素是一类原子的总称,具体说就是具有相同核电荷数的一类原子的总称。
因为它是一个总称,所以它最大的一个特点是:只讲种类,不讲个数。
只讲种类,不讲个数;既然元素只讲种类,不讲个数,那么在用元素描述物质的组成时,只能说该物质由几种元素组成,而不能说该物质由几个元素组成。
请看下列练习。
展示下列练习。
下列说法有没有错误?把错误的说法加以改正。
①水是由1个氧元素和2个氢元素组成的。
②二氧化硫中有硫和氧2个元素。
①错误。
改正:水是由氧元素和氢元素两种元素组成的。
②错误。
改正:二氧化硫由硫和氧两种元素组成。
地球上的物质有千千万万种,是不是元素也有千千万万种呢?应该不是。
物质的种类很多,但是组成这些物质的元素并不多。
到目前为止,已经发现的元素只有一百多种,这一百多种元素在地壳中的含量差别很大。
放映教材图4-4的放大图1.地壳中含量最多的元素是氧,其次是硅。

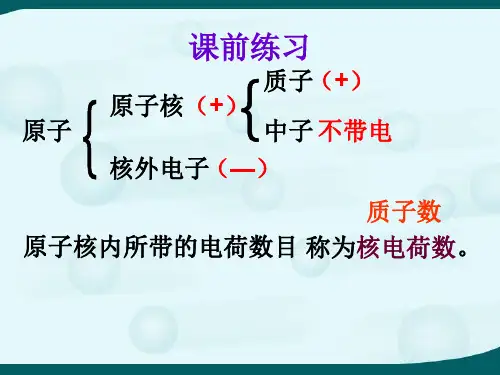
元素、离子主要内容:元素、离子一、元素1.概念元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
说明:(1)决定元素种类的是质子数(核电荷数),与中子数、核外电子数无关。
(2)必须要强调是“一类原子”,而不能说成“粒子”。
(3)元素是一个宏观概念,只论“种”,不论“个”。
(4)已发现的元素只有100余种,但组成的物质已超过3000万种。
2.元素与原子的区别和联系3.元素的分类(1)金属元素,中文名称通常具有“钅”偏旁,只有汞除外。
(2)非金属元素,中文名称通常具有“石”、“氵”或“气”偏旁,如碳、溴、氧等。
(3)稀有气体元素,包括氦、氖、氩等。
4.地壳中元素的质量分数地壳是指地球外表一层由岩石组成的固体硬壳,其中元素的含量排序前五位是:氧、硅、铝、铁、钙。
二、元素符号1.元素符号的意义:(1)表示一种元素。
(2)表示这种元素的一个原子。
2.写法、读法(1)读法:化学元素的读音,一般都是按照偏旁字来发音的。
例如,镁读作“美”,锂读作“里”,碘读作“典”等等。
但也有不少例外,如氧读作“养”,钠读作“纳”,溴读作“嗅”等等。
(2)写法:根据化学元素的拉丁文名称的首字母或者前几个字母来确定。
在书写时,注意一大二小,即第一个字母大写,第二个字母小写。
三、元素周期表根据元素的原子结构和性质,把现在已知的一百多种元素按原子序数(核电荷数)依次递增的顺序排列起来,这样得到的表叫元素周期表。
在周期表中,还用不同的颜色对金属元素、非金属元素做了分区。
1.元素周期表的结构:每一格:在元素周期表中,每一种元素均占据一格。
对于每一格,均包括原子序数、元素符号、元素名称、相对原子质量等内容。
每一横行(周期):元素周期表的每一横行叫做一个周期,共有7个横行,有7个周期。
说明:每周期开头是金属元素(第一周期除外),靠近尾部的是非金属元素,结尾的是稀有气体元素。
这说明随着原子序数的递增,元素原子的最外层上的电子数由1个递增到8个,达到稀有气体元素原子的稳定结构,然后又重复出现原子最外层电子数从1个递增到8个的变化规律。


案例名称课题2 元素(第一课时)科目化学教学对象九年级提供者杨万岳课时一课时一、教材内容分析本节课是初中化学“双基”的重要组成部分,元素的概念是初中化学核心概念。
课程标准指出,初中化学基础知识和基础技能是构成学生科学素养的基本要素,是为学生的终身学习和将来适应现代社会生活打好基础所必需的。
本课题包括元素、元素符号。
此前学生已经了解元素是组成物质的基本单位,已学习了原子的结构。
本节内容的学习是在学生掌握了水的组成、原子构成的基础上进行的。
通过本节课的学习,将引领学生把对物质的宏观组成和微观构成的认识统一起来,为今后学习化学式、化学方程式打下基础。
同时元素作为“双基”知识,是构成学生化学素养的基本要素,是为学生的终身学习所必需的。
因此,这部分知识对学生十分重要。
二、教学目标(知识,技能,情感态度、价值观)知识与技能1.认识元素的存在,形成元素的概念。
2.形成世界是物质的,物质是由元素组成的认识观。
3.知道元素的表示方法,并能书写元素符号。
过程与方法1.通过教师引导、学生自学,对比归纳出元素的概念。
2、学习运用寻找规律性和特殊性的方法处理信息3.通过学生积极主动地相互交流讨论、合作探究得出元素的书写规律。
情感态度、价值观形成世界是物质的,物质是由元素组成的认识观。
三、学习者特征分析在序言中,我们曾经把元素当成组成物质的基本成分介绍,现在他们已经学习了原子结构,就应该从微观的角度对元素下一个比较确切的定义,从而把对物质的宏观组成与微观结构的认识统一起来。
元素概念是本节课的教学难点,因为它比较抽象,而且对于“具有相同核电荷数的一类原子的总称”中的“一类原子”这一定义,在没有同位素知识准备时,学生难以理解。
这部分内容比较抽象,远离学生的生活经验,再加上前三个单元学生学到的元素化合物知识不多(主要是空气、氧气和水),感性知识不充分,这就给教学带来了一定的困难。
四、教学策略选择与设计基于对教材和学情的分析,结合学生的实际情况,我借助多媒体,采用了“讨论探究、引导点拨、合作归纳”教学模式,以学为主,切实培养学生的学习能力。
中考化学复习资料中考化学复习资料11分子是保持化学性质的最小微粒。
原子是化学变化中的最小微粒。
2元素是具有相同核电荷数(即质子数)的同一类原子的总称。
3分子和原子的主要区别是在化学反应中,分子可分,原子不可分。
4元素的化学性质主要决定于原子的最外层电子数。
5在原子中,质子数=核电荷数=核外电子数。
6相对原子质量=质子数+中子数7镁离子和镁原子具有相同的质子数或核电荷数。
8地壳中含量最多的元素是氧元素。
最多的金属元素是铝元素。
9决定元素的种类是质子数或核电荷数。
10.空气是由几种单质和几种化合物组成的混合物。
11.石油、煤、天然气都是混合物。
12.溶液都是混合物。
例如:稀硫酸、食盐水、石灰水等。
13.氧化物是由两种元素组成的,其中一种是氧元素的化合物。
14.化学变化的本质特征是有新物质生成。
15.燃烧、铁生锈、食物变质等都是化学变化。
16.化学反应的基本类型是化合反应、分解反应、置换反应、复分解反应。
17.金属活动性顺序表:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu18.具有还原性的物质是H2、C、CO。
其中属于单质的是C、H2。
属于化合物的是CO。
19.燃烧、缓慢氧化、自燃的相同点是都是氧化反应。
20.在化学反应前后,肯定不变的是原子的种类和数目、元素的种类、反应前后物质的总质量。
肯定变化的是物质的种类和分子的种类。
21.2H2表示两个氢分子;2H表示两个氢原子;2H+表示两个氢离子。
22.溶液都是均一、稳定的混合物。
溶液中各部分的性质相同。
溶液不一定是无色的。
23.溶液在稀释前后保持不变的是溶质的质量。
24.酸的pH<7;如:HCl、H2SO4、CO2通入水中;碱的pH>7;如:NaOH、Ca(OH)2、CaO溶于水、Na2O溶于水、Na2CO3中性溶液pH=7。
如:水、NaCl25.某原子的原子结构示意图+12282,该原子中的质子数为12,核电荷数为12,核外电子数为12,最外层电子数为2,该原子在化学反应中易失电子,成为阳离子。
分子、原子、离子、元素和化学式元素:具有相同核电荷数(即核内质子数)的一类原子总称元素。
原子的核电荷数(即核内质子数)决定原子或离子的元素种类。
①大部分单个的元素符号表示:一种元素、该元素的一个原子、一种单质但H N O Cl等符号不能表示单质,它们的单质是:H2 N2 O2 Cl2②地壳中元素按质量分数由多至少前四位是:O氧 Si硅 Al铝 Fe铁。
铝是地壳中含量最多的金属元素。
③化学的“语法”: “某分子”由“某原子构成”“某物质”由“某元素组成”或“某某分子构成”(金属单质、稀有气体讲由某原子直接构成)例:水由氢元素和氧元素组成,水由水分子构成。
1个水分子由2个氢原子和1个氧原子构成元素、物质都是宏观概念,只表示种类,不表示个数。
不能说“水是由二个氢元素和一个氧元素组成”④具有相同核电荷数的粒子不一定是同种元素,下列粒子有相同的核电荷数:⑴H2和He ⑵CO、N2和Si ⑶O2、S和S2- ⑷OH-和F-元素、分子和原子的区别与联系元素组成物质宏观概念,只讲种类,不讲个数同类原子总称构成构成构成微观概念,既讲种类,又讲个数原子分子粒子:如原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
金属单质和稀有气体由原子直接构成;非金属单质、非金属与非金属形成的共价化合物由分子构成,化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
分子:分子是保持物质化学性质的最小粒子。
分子由原子构成,例:1个水分子由2个氢原子和1个氧原子构成原子:原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子和不带电的中子构成。
在不显电性的粒子里:核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子;普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。
课题3 元素一、课标内容本课题在义务教育《化学课程标准2019版》中体现的内容为:1.认识氢、碳、氧、氮等与人类关系密切的常见元素。
2.记住并能正确书写一些常见元素的名称和符号。
3.知道元素的简单分类。
4. 能根据元素的原子序数在元素周期表中找到指定元素。
5. 形成“化学变化过程中元素不变”的概念。
二、地位与作用《元素》是人教版九年级化学第三单元的课题3,本课题是学生在学习了分子和原子、原子的结构的基础上进行学习的,教材从从宏观和微观两个角度,自然地把对物质的宏观组成和微观结构的认识统一起来,从而形成元素的概念。
元素符号是最基本的、重要的化学用语,是学习化学必备的基础知识。
因此本课既是对前几节内容的概括和总结,又为以后化学式、化学方程式的学习打下基础。
所以元素这节内容起着承上启下的作用,有着举足轻重的地位。
三、知识要点【要点1】元素1.元素:是质子数相同(即核电荷数)的一类原子的总称。
2.元素种类:100余种3.地壳中含量前四位元素(质量分数):氧、硅、铝、铁。
【要点2】元素符号1.元素符号:国际上统一用来表示元素的一种特定的化学符号。
2.意义:表示一种元素;表示这种元素的一个原子。
3.书写:(1)由一个字母表示的元素符号要大写(2)由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。
【要点3】元素周期表1. 元素周期表:根据元素的原子结构和性质,把现在已知的一百多种元素按原子序数(核电荷数)科学有序的排列起来,这样得到的表叫元素周期表。
2.元素周期表的意义:学习和研究化学的重要工具。
四、内容分析本课题包括元素、元素符号和元素周期表简介三部分内容。
(一)元素元素是一个比较抽象的概念,初中学生理解起来确实不易,所以教材开门见山,用类比26个字母可以可拼写出数十万个英语单词一样,告诉学生组成物质的元素是有限的,元素其实只有一百多种。
然后教材从宏观层面,分析图3-16常见的一些物质,如蛋壳、贝壳和石灰石的主要成分都是碳酸钙,而碳酸钙是由钙、碳、氧三种元素组成的。