炔烃和共轭二烯烃
- 格式:ppt
- 大小:5.45 MB
- 文档页数:68

第四章炔烃、二烯烃要求深刻理解和熟练掌握的内容:炔烃的化学性质;共轭二烯烃的结构;共轭二烯烃的化学性质要求一般理解和掌握的内容:乙炔的制法及用途;二烯烃的分类和命名;天然橡胶及合成橡胶难点:共轭效应和超共轭效应分子中含有碳碳叁键的烃叫做炔烃。
其通式为C n H2n-2;官能团为-C C-(一)炔烃一、炔烃的异构和命名(1)异构现象——从丁炔开始有异构体.由碳链不同和叁键位置不同所引起。
由于在碳链分支的地方不可能有叁键的存在,所以炔烃的异构体比同碳原子数的烯烃要少。
同时,由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象.(2) 炔烃的命名◎系统命名法:①以包含叁键在内的最长碳链为主链,按主链的碳原子数命名为某炔,代表叁键位置的阿拉伯数字以取最小的为原则而置于名词之前,侧链基团则作为主链上的取代基来命名.②炔烃分子中同时含有碳碳双键时,命名时选择含有双键和三键的最长碳链为主链,先命名烯再命名炔。
编号要使两者位次数值和最小,若有选择时应使双键的位次最小。
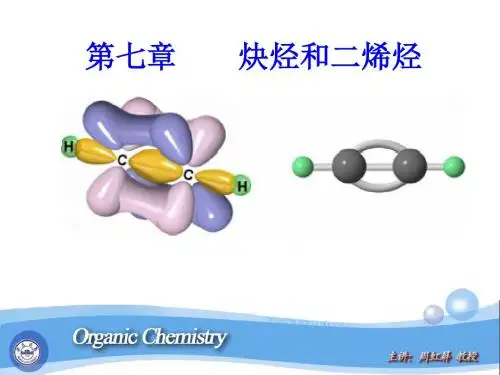
例如:乙炔分子是一个线形分子,四个原子都排布在同一条直线上.乙炔的两个碳原子共用了三对电子.二、炔烃的结构以最简单的分子乙炔为例炔烃的结构特征是分子中具有碳碳叁键。
由炔烃叁键同一个碳原子上的两个sp杂化轨道所组成的σ键是在同一直线上方向相反的两个键.•在乙炔中,每个碳原子各形成了两个具有圆柱形轴对称的σ键.它们是Csp -Csp和Csp-Hs.乙炔分子中的σ键乙炔分子中的π键◎乙炔的每个碳原子还各有两个相互垂直的未参加杂化的p轨道,不同碳原子的p轨道又是相互平行的.◎一个碳原子的两个p轨道和另一个碳原子对应的两个p轨道,在侧面交盖形成两个碳碳π键.两个互相垂直的π键中电子云的分布位于σ键轴的上下和前后部位,当π轨道重叠后,其电子云形成以C-Cσ键为对称轴的圆筒形状。
乙炔分子的π电子云三、炔烃的物理性质(1)炔烃的物理性质和烷烃,烯烃基本相似;(2)低级的炔烃在常温下是气体,但沸点比相同碳原子的烯烃略高;(3)随着碳原子数的增加,沸点升高.(4)叁键位于碳链末端的炔烃(又称末端炔烃)的沸点低于叁键位于碳链中间的异构体.(5)炔烃不溶于水,但易溶于极性小的有机溶剂,如石油醚,苯,乙醚,四氯化碳等.◎与硝酸银的液氨溶液作用CH≡CH+2Ag(NH3)2NO3→AgC≡CAg↓+2NH4NO3+2NH3乙炔银(白色沉淀)RC≡CH+Ag(NH3)2NO3→RC≡CAg↓+NH4NO3+NH3◎与氯化亚铜的液氨溶液作用CH≡CH+2Cu(NH3)2Cl→CuC≡CCu↓+2NH4Cl+2NH3乙炔亚铜(红色沉淀)RC≡CH+Cu(NH3)2Cl→RC≡CCu↓+NH4NO3+NH3(2) 生成炔化银和炔化亚铜--炔烃的定性检验注:1.炔化物和无机酸作用可分解为原来的炔烃。








1烷烃、烯烃、炔烃、共轭二烯烃烯烃和炔烃可使酸性高锰酸钾溶液或溴的CCl4溶液(烃的含氧衍生物均可以使高锰酸钾褪色)。
如果炔烃中含有炔氢可以与Cu2Cl2/氨水溶液生成红色沉淀,与硝酸银/氨水溶液,生成炔化银白色沉淀共轭二烯烃可与马来酸酐能产生沉淀2烷烃和芳香烃:苯可以用浓硫酸鉴别,反应后不会出现分层,而烷烃与浓硫酸会出现明显分层。
不过甲苯,二甲苯(与苯环相连的邻位碳)上要有可以和酸性高锰酸钾溶液反应,苯就不行。
3.卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
4.酚:苯酚还可以和氯化铁反应显紫色;可以与溴生成2,4,6-三溴苯酚白色沉淀5.醇与金属钠反应放出氢气(鉴别6个碳原子以下的醇)。
鉴别伯仲叔醇可以用卢卡斯试剂(ZnCl2的浓盐酸溶液)根据出现浑浊程度判别(伯醇:加热后出现浑浊;仲醇:放置片刻能出现浑浊;叔醇立刻出现浑浊。
6. 羰基类化合物醛与酮用托伦试剂,醛能生成银镜,而酮不能;(特例:α-羟基酮也可以发生银镜反应)芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,甲基酮和具有结构的醇用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能。
8.小环烃:三、四元脂环烃可使溴的四氯化碳溶液腿色9.胺:区别伯、仲、叔胺有两种方法(1)用苯磺酰氯(ArSO2Cl)或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
(2)用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。
芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
10.糖:(1)单糖都能与托伦试剂和斐林试剂作用,产生银镜或砖红色沉淀;(2)葡萄糖与果糖:用溴水可区别葡萄糖与果糖,葡萄糖能使溴水褪色,而果糖不能。
第三章烯烃炔烃二烯烃Ⅰ学习要求1. 了解不饱和烃的结构特点,熟练掌握烯烃、炔烃、二烯烃及烯烃顺反异构体的系统命名。
2. 掌握不饱和烃的化学反应及其应用,熟练掌握应用亲电加成反应历程,马氏规则及其影响因素判断加成反应的主要产物(或方向)。
3. 了解共轭体系的类型,掌握应用诱导效应和共轭效应判断亲电加成反应的速率。
4. 掌握鉴别烯烃、炔烃的化学方法。
5. 掌握各类碳正离子的稳定性顺序。
Ⅱ内容提要一.不饱和烃的结构1. 烯烃的官能团是碳碳双键,形成双键的两个碳原子是sp2杂化。
碳碳双键是由一个碳碳σ键和一个碳碳π键组成,具有刚性,不能绕碳碳双键自由旋转。
π键的键能较小,易被极化,容易和亲电试剂发生亲电加成反应。
2. 在炔烃分子中碳碳叁键是官能团,形成叁键的两个碳原子是sp杂化,碳碳叁键是直线型,其中两个π键相互垂直。
sp杂化的碳原子的电负性较sp2杂化的碳原子电负性大,所以炔烃中的π键比烯烃的π键较难极化,亲电加成反应炔烃较烯烃难。
3. 共轭二烯烃在结构特征上是指碳碳单键和碳碳双键交替排列的情况。
即分子中有四个sp2杂化的碳原子依次相连,称做共轭链。
共轭二烯烃的四个sp2碳原子共存在于同一平面,形成两个π键的四个p轨道相互平行,π键电子可在共轭链上离域,这种共轭体系的π键又称离域大π键。
它更易极化,亲电反应活性高于独立的π键。
4. 共轭体系是指在分子、离子或自由基中能够形成π键或p轨道离域的体系,在共轭体系中π键电子或p轨道电子不是定域,而是离域的。
这种电子在共轭体系中离域并传递的电子效应称共轭效应。
共轭体系与非共轭体系相比较,具有较低的热力学能,有较高的化学反应活性和特有的化学性质,存在有键长平均化现象。
共轭体系又具体分为:π–π共轭体系、p–π共轭体系、p–p共轭体系、σ–π超共轭体系和σ–p超共轭体系。
5. 共轭效应是指π键电子或p轨道电子在共轭体系中间离域并传递而产生的电子效应,仅存在于共轭体系中;诱导效应则是指σ键电子在σ键中偏移并传递的电子效应,存在于所有的极性σ键中。