荧光定量PCR引物设计原则
- 格式:doc
- 大小:86.50 KB
- 文档页数:8

荧光定量引物设计原则 This model paper was revised by the Standardization Office on December 10, 2020引物的具体设计要求:1.引物应用核酸系列保守区内设计并具有特异性。
最好位于编码区5’端的300-400bp区域内,可以用DNAman,Alignment 软件看看结果。
2. 产物不能形成二级结构(自由能小于mol)。
3.引物长度一般在17-25碱基之间,上下游引物不能相差太大。
+C含量在40%~60%之间,45-55%最佳。
5.碱基要随机分布,尽量均匀。
6.引物自身不能有连续4个碱基的互补。
7.引物之间不能有连续4个碱基的互补。
8.引物5′端可以修饰。
′端不可修饰,而且要避开AT,GC rich的区域,避开T/C,A/G连续结构(2-3个)。
10. 引物3′端要避开密码子的第3位。
11.引物整体设计自由能分布5‘端大于3’端,且3‘端自由能最好小于9KJ/mol。
可用oligo 6 软件进行比对看结果的情况。
12.做荧光定量产物长度80-150bp最好,最长是300bp.13.引物设计避免DNA污染,最好跨外显子接头区。
14.引物与非特异性扩增序列的同源性最好小于70%或者有8个互补碱基同源。
15.查看有无假基因的存在。
假基因就是无功能的DNA序列,与需要扩增的目的片段长度相似。
值在58-62度之间。
17.引物设计的软件Primer 有专门针对荧光的。
用染料做荧光定量不如探针特异性好,具体操作一下就知道了!可以多定几对引物,免得摸条件浪费时间和金钱!试剂很贵的!荧光定量PCR引物设计原则设计的目的是在两个目标间取得平衡:扩增特异性和扩增效率。
引物分析软件将试图通过使用每一引物设计变化的预定值在这两个目标间取得平衡。
设计引用有一些需要注意的基本原理:① 引物长度一般引物长度为18~30碱基。
总的说来,决定引物退火温度(Tm值)最重要的因素就是引物的长度。

荧光定量pcr甲基化检测指导原则荧光定量PCR甲基化检测是一种常用的分子生物学技术,用于检测DNA甲基化的程度。
下面是荧光定量PCR甲基化检测的一些指导原则:
1. 样品准备:收集所需DNA样品,并进行DNA提取。
提取的DNA 应为高质量的DNA,避免有降解或污染。
2. 甲基化特定位点选择:选择需要检测的甲基化位点。
可以通过DNA序列分析或文献调研确定感兴趣的位点。
3. 甲基化位点设计引物:为目标甲基化位点设计引物。
引物应能够特异性地扩增甲基化和非甲基化DNA区域,以及与甲基化程度相关的不同扩增产物。
4. 甲基化控制组建立:建立甲基化和非甲基化的控制组,用于定量PCR反应的标准曲线绘制和甲基化程度的计算。
控制组应包括未经处理的DNA模板和已知甲基化程度的DNA模板。
5. 荧光定量PCR反应设置:按照引物和模板的要求,设置荧光定量PCR反应体系。
确保引物的浓度适当,控制组和样品的反应条件一致。
6. 荧光定量PCR反应条件:参考引物的要求和已建立的标准曲线,选择适当的PCR循环条件和荧光检测方法。
7. 荧光信号读取和数据分析:根据荧光信号读取仪器的要求,读取PCR反应的荧光信号。
然后,使用标准曲线和控制组的数据,计算样品中甲基化程度。
8. 数据验证和结果解释:对得到的甲基化程度进行数据验证,确保结果的准确性。
最后,根据结果解释样品的甲基化状态。
以上是荧光定量PCR甲基化检测的一些指导原则,但具体实验步骤和条件可能因不同的实验目的和设备要求而有所差异。
在进行实验前,建议参考相关文献和技术手册,并咨询专业人员的建议。

1.引物应用核酸系列保守区内设计并具有特异性。
最好位于编码区5’端的300-400bp区域内,可以用DNAman,Alignment 软件看看结果。
2. 产物不能形成二级结构(自由能小于58.61KJ/mol)。
3.引物长度一般在17-25碱基之间,上下游引物不能相差太大。
4.G+C含量在40%~60%之间,45-55%最佳。
5.碱基要随机分布,尽量均匀。
6.引物自身不能有连续4个碱基的互补。
7.引物之间不能有连续4个碱基的互补。
8.引物5′端可以修饰。
9.3′端不可修饰,而且要避开AT,GC rich的区域,避开T/C,A/G连续结构(2-3个)。
10. 引物3′端要避开密码子的第3位。
11.引物整体设计自由能分布5‘端大于3’端,且3‘端自由能最好小于9KJ/mol。
可用oligo 6 软件进行比对看结果的情况。
12.做荧光定量产物长度80-150bp最好,最长是300bp.13.引物设计避免DNA污染,最好跨外显子接头区。
14.引物与非特异性扩增序列的同源性最好小于70%或者有8个互补碱基同源。
15.查看有无假基因的存在。
假基因就是无功能的DNA序列,与需要扩增的目的片段长度相似。
16.TM值在58-62度之间。
17.引物设计的软件Primer 5.0 有专门针对荧光的。
设计的目的是在两个目标间取得平衡:扩增特异性和扩增效率。
引物分析软件将试图通过使用每一引物设计变化的预定值在这两个目标间取得平衡。
设计引用有一些需要注意的基本原理:①引物长度一般引物长度为18~30碱基。
总的说来,决定引物退火温度(Tm值)最重要的因素就是引物的长度。
有以下公式可以用于粗略计算引物的退火温度。
在引物长度小于20bp时:[4(G+C)+2(A+T)]-5℃在引物长度大于20bp时:62.3℃+0.41℃(%G-C)-500/length-5℃另外有许多软件也可以对退火温度进行计算,其计算原理会各有不同,因此有时计算出的数值可能会有少量差距。


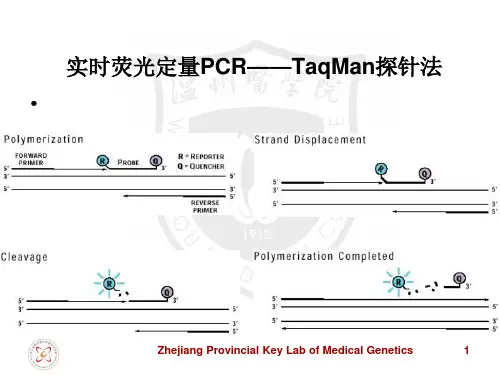
定量P C R引物、探针设计原则(总4页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除定量PCR 引物、探针设计原则自90年代Taqman探针诞生以来,虽然荧光探针(引物)不断有新的技术出现,但是作为一种经典的定量PCR技术,Taqman探针技术仍然是许多实验研究人员进行定量检测的首选,这主要是因为相对于SYBR荧光染料,Taqman探针具有序列特异性,只结合到互补区,而且荧光信号与扩增的拷贝数具有一一对应的关系,因此特异性强灵敏度高,而且条件优化容易;而相对于杂交探针,Taqman探针只要设计一条探针,因此探针设计较便宜方便,而且也能完成基本的定量PCR要求。
当然Taqman定量方法由于还是要合成探针,也给实验操作带来了挑战。
一般Taqman定量PCR实验过程为:目的基因查找比对→探针与引物设计→探针与引物合成→配置反应体系→反应参数→重复实验,优化条件→获得曲线数据,比对标准曲线→再重复验证。
第一步:在第一步目的基因查找比对过程中可以利用NCBI genbank序列以及DNAstar等软件完成目的DNA或者RNA的查找与比对——这在分析测序报告的时候相信很多人操作过,这一步需要注意的就是要保证所分析的序列在一个contig(重叠群,即染色体的一些区域中毗邻DNA片段重叠的情况)内。
第二步:如果其它条件一致,那么这个第二步——引物探针的设计就可以说是定量PCR成败的关键了,通过各方面经验的总结有以下几个基本的原则:总体原则先选择好探针,然后设计引物使其尽可能的靠近探针。
所选序列应该高度特异,尽量选择具有最小二级结构的扩增片段——这是因为二级结构会影响反应效率,而且还会阻碍酶的扩增。
建议先进行二级结构检测,如果不能避免二级结构,那么就要相应提高退火温度。
扩增长度应不超过400bp,理想的最好能在100-150bp内,扩增片段越短,有效的扩增反应就越容易获得。

荧光定量pcr引物设计原理荧光定量PCR(qPCR)引物设计的原理是基于PCR技术和荧光探针技术相结合。
PCR是一种从一小段DNA模板扩增特定DNA序列的技术,而荧光探针则是一种特殊的DNA探针,带有荧光物质,可以用来检测PCR反应过程中特定DNA序列的累积量。
荧光定量PCR的引物设计主要包括前向引物(forward primer)和反向引物(reverse primer)。
这两个引物被设计成具有与目标序列的两个不同区域互补的DNA序列。
在PCR反应中,这两个引物会结合到模板DNA上,并在酶的催化下引发DNA链的扩增。
为了确保引物能够选择性地结合到目标序列,需要注意以下几个原则:1. 引物长度:引物的长度通常在18-25个碱基对之间。
引物过短可能导致非特异性结合,引物过长则可能导致扩增效率降低。
2. GC含量:引物的GC含量通常在40-60%之间,过高或过低的GC含量可能导致引物结合不稳定或影响扩增效率。
3. 互补性:前向引物和反向引物应该在目标序列的不同位点,且二者之间不应有显著的互补性。
否则将导致引物之间的非特异性结合和产生副产物。
4. 特异性:引物应该能够特异性地结合到目标序列,而不结合到其他非目标序列。
为了确保特异性,可以使用计算软件进行序列比对和BLAST分析。
此外,为了进行荧光定量PCR,还需要引入荧光探针。
荧光探针是一种特殊设计的DNA或RNA探针,通常带有一个荧光物质和一个荧光耦合的荧光素(quencher)。
在PCR反应中,荧光探针与目标序列的靶标区域互补结合。
当荧光探针结合到目标序列时,荧光物质和荧光素之间的空间距离会增大,导致荧光物质释放出荧光信号。
这个信号可以被PCR仪器检测到,并用于测量PCR反应过程中目标序列的累积量。
总之,荧光定量PCR引物设计需要考虑引物的长度、GC含量、互补性和特异性。
同时,还需要设计荧光探针来检测目标序列的累积量,以实现定量PCR的功能。


定量PCR引物探针设计原则定量PCR(Quantitative Polymerase Chain Reaction)是一种用于测量DNA分子数量的技术。
在进行定量PCR实验时,合理设计引物和探针非常重要,下面将探讨一些定量PCR引物和探针设计的原则。
1.引物设计原则:1.1引物长度:引物的长度一般在18-30个碱基对之间,过短的引物可能导致非特异性扩增,而过长的引物可能导致扩增效率降低。
1.2引物的GC含量:引物的GC含量应在40-60%之间,过高或过低的GC含量都可能导致非特异性扩增。
1.3引物的熔解温度(Tm):引物的熔解温度应在50-60摄氏度之间,可以通过计算引物序列的碱基组成和长度来预测引物的Tm值。
1.4引物的特异性:引物的特异性是设计引物时最关键的考虑因素之一、引物的特异性可以通过检查与该引物匹配的靶标序列在基因组或转录组中的唯一性来评估。
可以使用生物信息学工具,如BLAST(基本局部序列比对)来分析引物的特异性。
此外,还可以使用引物的3'末端碱基序列的特异性来提高引物的特异性。
2.探针设计原则:2.1探针的长度:探针的长度一般在20-30个碱基对之间。
2.2探针的熔解温度(Tm):与引物类似,探针的Tm值也应在50-60摄氏度之间。
2.3探针的特异性:与引物一样,探针的特异性也是设计探针时需要考虑的重要因素。
探针的特异性可以通过生物信息学工具来分析,如BLAST。
此外,还可以设计探针的3'末端碱基序列来提高其特异性。
2.4探针的化学修饰:在实验中,通常使用荧光标记的探针来实现定量PCR。
探针可以通过荧光基团,如FAM、VIC、HEX等进行标记。
此外,还可以在探针的两端引入磷酸酯键或磷酸二酯键等化学修饰,以提高探针的稳定性和特异性。
总结起来,定量PCR引物和探针的设计需要考虑引物长度、GC含量、熔解温度和特异性等因素。
在设计引物和探针时,可以使用生物信息学工具来分析其特异性,并通过化学修饰来提高其稳定性和特异性。

多重荧光定量pcr引物和探针设计方法多重荧光定量PCR(Multiplex qPCR)是一种利用多组引物和探针同时扩增和检测多个靶标序列的技术。
它具有高通量、高灵敏度、高特异性和高精确性的优点,广泛应用于基因表达定量、基因突变检测、病毒感染检测等领域。
为了设计适用于多重荧光定量PCR的引物和探针,需要考虑以下几个方面。
1. 靶标选择与设计首先,需要选择适合于多重荧光定量PCR的靶标序列。
靶标序列应具有明显的差异性,能够有效区分不同的样本。
此外,还应该考虑靶标序列的长度,推荐长度在100-200bp之间。
最好通过生物信息学工具进行靶标序列的选择和设计。
2. 引物设计在多重荧光定量PCR中,每个靶标序列需要设计一对引物。
引物的设计应遵循以下原则:(1)引物长度:引物长度一般在18-24个碱基之间,尽量保持相似的长度。
(2)引物Tm值:引物的熔解温度(Tm)应相似,通常应在55-65℃之间。
(3)引物特异性:引物应具有较高的特异性,避免与非靶标序列发生非特异性扩增。
(4)引物相互作用:不同引物之间应避免相互作用,特别是避免引物间的二聚体形成。
(5)GC含量:引物的GC含量应在40-60%之间,以保证扩增效果和特异性。
3. 探针设计多重荧光定量PCR中可以选择使用探针进行定量分析。
探针的设计应遵循以下原则:(1)探针长度:探针长度通常在16-30个碱基之间,最好控制在20个碱基左右。
(2)探针Tm值:探针的Tm值应相似,通常要比引物的Tm 值高2-5℃。
(3)探针结构:选择合适的探针结构,常用的有TaqMan探针、MGB探针、Scorpion探针等。
根据实验需求选择合适的探针结构,以提高灵敏度和特异性。
4. 引物和探针的检测验证在设计引物和探针后,需要进行实验验证。
可以通过单引物和单探针PCR进行验证,检测目标序列的特异性和效果。
如果存在非特异性扩增或效果不理想,需要对引物和探针进行修改和优化。
总的来说,多重荧光定量PCR引物和探针的设计需要考虑靶标选择与设计、引物设计、探针设计以及引物和探针的检测验证等方面。

定量P C R引物探针设计原则Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】定量PCR引物、探针设计原则自90年代Taqman探针诞生以来,虽然荧光探针(引物)不断有新的技术出现,但是作为一种经典的定量PCR技术,Taqman探针技术仍然是许多实验研究人员进行定量检测的首选,这主要是因为相对于SYBR荧光染料,Taqman探针具有序列特异性,只结合到互补区,而且荧光信号与扩增的拷贝数具有一一对应的关系,因此特异性强灵敏度高,而且条件优化容易;而相对于杂交探针,Taqman探针只要设计一条探针,因此探针设计较便宜方便,而且也能完成基本的定量PCR 要求。
当然Taqman定量方法由于还是要合成探针,也给实验操作带来了挑战。
一般Taqman定量PCR实验过程为:目的基因查找比对→探针与引物设计→探针与引物合成→配置反应体系→反应参数→重复实验,优化条件→获得曲线数据,比对标准曲线→再重复验证。
第一步:在第一步目的基因查找比对过程中可以利用NCBIgenbank序列以及DNAstar等软件完成目的DNA或者RNA的查找与比对——这在分析测序报告的时候相信很多人操作过,这一步需要注意的就是要保证所分析的序列在一个contig(重叠群,即染色体的一些区域中毗邻DNA片段重叠的情况)内。
第二步:如果其它条件一致,那么这个第二步——引物探针的设计就可以说是定量PCR成败的关键了,通过各方面经验的总结有以下几个基本的原则:总体原则先选择好探针,然后设计引物使其尽可能的靠近探针。
所选序列应该高度特异,尽量选择具有最小二级结构的扩增片段——这是因为二级结构会影响反应效率,而且还会阻碍酶的扩增。
建议先进行二级结构检测,如果不能避免二级结构,那么就要相应提高退火温度。
扩增长度应不超过400bp,理想的最好能在100-150bp内,扩增片段越短,有效的扩增反应就越容易获得。
定量P C R引物探针设计原则TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】定量P C R引物、探针设计原则自90年代Taqman探针诞生以来,虽然荧光探针(引物)不断有新的技术出现,但是作为一种经典的定量PCR技术,Taqman探针技术仍然是许多实验研究人员进行定量检测的首选,这主要是因为相对于SYBR荧光染料,Taqman探针具有序列特异性,只结合到互补区,而且荧光信号与扩增的拷贝数具有一一对应的关系,因此特异性强灵敏度高,而且条件优化容易;而相对于杂交探针,Taqman探针只要设计一条探针,因此探针设计较便宜方便,而且也能完成基本的定量PCR要求。
当然Taqman定量方法由于还是要合成探针,也给实验操作带来了挑战。
一般Taqman定量PCR实验过程为:目的基因查找比对→探针与引物设计→探针与引物合成→配置反应体系→反应参数→重复实验,优化条件→获得曲线数据,比对标准曲线→再重复验证。
第一步:在第一步目的基因查找比对过程中可以利用NCBI genbank序列以及DNAstar 等软件完成目的DNA或者RNA的查找与比对——这在分析测序报告的时候相信很多人操作过,这一步需要注意的就是要保证所分析的序列在一个contig(重叠群,即染色体的一些区域中毗邻DNA片段重叠的情况)内。
第二步:如果其它条件一致,那么这个第二步——引物探针的设计就可以说是定量PCR成败的关键了,通过各方面经验的总结有以下几个基本的原则:总体原则先选择好探针,然后设计引物使其尽可能的靠近探针。
所选序列应该高度特异,尽量选择具有最小二级结构的扩增片段——这是因为二级结构会影响反应效率,而且还会阻碍酶的扩增。
建议先进行二级结构检测,如果不能避免二级结构,那么就要相应提高退火温度。
扩增长度应不超过400bp,理想的最好能在100-150bp内,扩增片段越短,有效的扩增反应就越容易获得。
荧光定量PCR技术的使用中常见问题引言:荧光定量PCR技术作为一种高效、灵敏和准确的基因定量方法,广泛应用于分子生物学、医学诊断、环境监测等领域。
然而,在使用荧光定量PCR技术的过程中,常常会遇到一些问题和挑战。
本文将就荧光定量PCR技术的使用中常见问题进行探讨和解答,旨在帮助读者更好地应对和解决实验中的困惑。
一、引物设计问题1. 引物设计原则荧光定量PCR实验的关键是引物的设计。
引物应具备特异性、高度选择性以及适当的配对特性,以确保PCR反应的准确性和灵敏度。
引物设计建议遵循以下原则:- 引物长度:一般选择长度在18-30个碱基对之间。
- 碱基组成:应尽量避免引物末端含有连续的鸟嘌呤(G)或鸟嘧啶(C)。
- 碱基序列:引物两端应该尽量避免含有重复的碱基序列,以防止不特异扩增。
- 温度计算:引物的Tm(解离温度)应该在50-60摄氏度之间,同时引物间的Tm差异应不大于5摄氏度。
2. 引物设计工具引物设计可以利用一些在线引物设计工具,如Primer3、NCBI Primer-BLAST 等。
这些工具能够根据用户提供的序列信息,自动生成符合上述引物设计原则的引物。
二、荧光探针选择和优化1. 探针选择荧光定量PCR常用的探针有TaqMan探针、Molecular beacon探针等。
选择合适的探针取决于实验需要和目标基因的特点。
TaqMan探针适用于高度特异性检测,而Molecular beacon探针则适用于检测低浓度的目标序列。
2. 探针的优化为了提高PCR反应的灵敏度和特异性,有时需要对探针进行优化。
以下是一些优化探针的建议:- 探针浓度优化:需根据实验条件和目标基因的特性进行探针浓度的优化。
- 探针长度:一般探针的长度限制在15-30个碱基对之间。
三、荧光定量PCR反应体系问题1. 反应体系的组成荧光定量PCR反应体系基本组成包括:模板DNA、引物、荧光探针、聚合酶、缓冲液和核苷酸等。
其中,重要的是要根据实验需要和试剂盒的要求确定各组分的浓度。
荧光定量引物设计原则1. 引子设计的基础知识引子(或称引物)在荧光定量PCR中就像是厨师做菜时用的调料,缺了它,成品可就大打折扣了。
想象一下,您要做一碗美味的番茄汤,调料不到位,味道就差了。
荧光定量引物的设计也是这个道理,必须精细入微,才能达到预期的效果。
引物的作用就是帮助你找到特定的DNA片段,进而进行放大和检测。
简单来说,引物的好坏直接影响到实验结果的准确性和灵敏度。
1.1 引物的基本特性好的引物一般要有合适的长度,通常在18到25个核苷酸之间,太长了容易出现非特异性结合,太短了则不容易稳定地附着在目标DNA上。
简而言之,就是“短小精悍”才行。
另外,GC含量也是个关键因素,通常在40%到60%之间为佳。
GC含量高的引物会更稳定,因为GC配对有三条氢键,而AT配对只有两条,这就像是把你的“火锅”加了足够的底料,汤才好喝嘛!1.2 特异性与灵敏度引物设计的特异性就好比是你的探险指南,指引你找到真正的“宝藏”,如果不够特异,那你可就可能挖错地方,浪费时间和精力。
在设计引物时,要确保它能专门结合到目标序列上,而不会去“攀附”那些不相关的序列。
灵敏度则是另一回事,好的引物要能在低浓度的DNA样本中也能成功扩增,正所谓“无中生有”,有时甚至要能“柳暗花明又一村”。
2. 设计原则好的引物设计有一些原则,咱们来聊聊那些“黄金法则”。
2.1 避免二聚体在设计引物的时候,要特别注意避免二聚体的形成。
想象一下,你和朋友一起玩,“捉迷藏”,你们两个躲在同一个地方,那就很容易被找到了。
在引物设计中,二聚体就像那两个躲在一起的朋友,导致PCR失败。
所以,设计时要避免引物之间的互补区域,尽量让它们各自“独立行动”,这样才能最大限度地提高扩增效率。
2.2 合适的熔解温度(Tm)熔解温度(Tm)也是一个重要的参数,简单说就是引物在什么温度下才能牢牢地结合到目标DNA上。
通常,前引物和后引物的Tm值要相近,这样可以确保它们能在相同的温度下“工作”,就像两个舞者在同一个节奏下跳舞,才不会出现“踩脚”的情况。
精心整理定量PCR引物、探针设计原则自90年代Taqman探针诞生以来,虽然荧光探针(引物)不断有新的技术出现,但是作为一种经典的定量PCR技术,Taqman探针技术仍然是许多实验研究人员进行定量检测的首选,这主要是因为相对于SYBR荧光染料,Taqman探针具有序列特异性,只结合到互补区,而且荧光信号与扩增的拷贝数具有一一对应的关系,因此特异性强灵敏度高,而且条件优化容易;而相对于杂交探针,Taqman探针只要设计一条探针,因此探针设计较便宜方便,而且也能完成基本的定量PCR要求。
当然Taqman定量方法由于还是要合成探针,也给实验操作带来了挑战。
一般Taqman定量PCR实验过程为:目的基因查找比对→探针与引物设计→探针与引物合成→配置反应体系→反应参数→重复实验,优化条件→获得曲线数据,比对标准曲线→再重复验证。
第一步:在第一步目的基因查找比对过程中可以利用NCBIgenbank序列以及DNAstar等软件完成目的DNA或者RNA的查找与比对——这在分析测序报告的时候相信很多人操作过,这一步需要注意的就是要保证所分析的序列在一个contig(重叠群,即染色体的一些区域中毗邻DNA片段重叠的情况)内。
第二步:如果其它条件一致,那么这个第二步——引物探针的设计就可以说是定量PCR成败的关键了,通过各方面经验的总结有以下几个基本的原则:总体原则先选择好探针,然后设计引物使其尽可能的靠近探针。
所选序列应该高度特异,尽量选择具有最小二级结构的扩增片段——这是因为二级结构会影响反应效率,而且还会阻碍酶的扩增。
建议先进行二级结构检测,如果不能避免二级结构,那么就要相应提高退火温度。
扩增长度应不超过400bp,理想的最好能在100-150bp内,扩增片段越短,有效的扩增反应就越容易获得。
较短的扩增片段也容易保证分析的一致性。
保持GC含量在20%和80%之间,GC富含区容易产生非特异反应,从而会导致扩增效率的降低,以及出现在荧光染料分析中非特异信号。
定量PCR引物探针设计原则1.引物长度:最好控制在18-25个碱基对之间。
过短的引物会导致特异性降低,而过长的引物则会增加杂交的机会,影响PCR的特异性。
2.引物序列:引物应与目标基因序列高度匹配,避免引物与非特异性DNA结合。
引物的GC含量应在40-60%之间,以确保适当的结合力。
3.引物互补性:引物设计时,互补性不应超过3个碱基对。
互补性太高可能会导致杂交产物增多,影响PCR的特异性。
4.引物Tm值:引物的熔解温度(Tm)应在55-65°C之间。
Tm值过高可能导致引物与非特异性DNA杂交,而Tm值过低可能导致引物无法精确结合目标DNA。
5.引物的位置:引物应设计在目标基因的保守区域,避免设计在多态性位点或重复序列区域。
1.引物-探针互补性:引物和探针应该具有很高的互补性,以确保探针与引物结合后能够产生一个稳定的引物-探针结合物。
2.探针设计:探针通常由一个荧光染料和一个QSY抑制剂构成。
荧光染料的选择应是稳定的、不受PCR反应条件的影响的。
QSY抑制剂充当了探针的标记基团,它通过修饰荧光染料对荧光信号进行猝灭。
3.探针-引物适配性:探针和引物之间应该是完全互补的,以确保引物和探针都能够准确结合目标DNA,并且防止任何非特异性杂交的发生。
4.简并位点:在设计探针时应避免引物和探针设计在简并位点上,这样可以确保在PCR过程中特异性扩增。
5.荧光信号强度:探针设计时还应考虑荧光信号的强度。
一般而言,较强的荧光信号会导致更高的检测灵敏度,但较低的信号可能会增加误差。
总而言之,定量PCR引物和探针的设计需要遵循一系列原则,以确保可靠性和准确性。
这些原则包括引物长度、序列、互补性和Tm值的控制,引物的位置选择以及荧光染料和QSY抑制剂的合理选择和设计。
通过遵循这些原则,可以提高定量PCR的特异性和灵敏度,并准确测量样本中的目标基因表达水平。
荧光定量PCR(qPCR)对基因表达的分析一、实验试剂SYBR Green premix(Takara,RR420A)二、试验设备和材料无RNase的离心管、PCR管、枪头。
三、操作步骤(一)引物设计原则(1)设计引物的长度一般为18–28个核苷酸。
(2)扩增产物长度80-150 bp最好,最长是300 bp。
(3)避免重复核苷酸延伸段。
(4)目标为50% GC含量,有助于防止错配稳定化。
(5)选择Tm值匹配的引物(相差在5°C范围内),60℃左右最好。
(6)避免一个Assay中采用的所有引物之间以及各引物内出现序列互补。
(二)总RNA提取(TaKaRa MiniBEST Universal RNA Extraction Kit,9767)准备工作:Buffer RL中加入50×DTT;Buffer RWB中加入无水乙醇;配制70%DEPC乙醇。
1. 动物培养细胞的 RNA 提取(1)细胞的裂解。
①倒出培养液,使用 1×PBS清洗一次。
②向培养细胞中加入适当量(Table 1 中推荐的使用量)的裂解 Buffer RL(使用前请确认已加入 50×DTT Solution),水平放置片刻,使裂解液均匀分布于细胞表面并裂解细胞,然后使用移液枪吹打细胞使其脱落。
(6 孔细胞培养板每孔加入 350μL)③将内含细胞的裂解液转移至离心管中,用移液枪反复吹吸直至裂解液中无明显沉淀。
(2)裂解液室温静置2 min。
注:对于基因组含量较多的材料或者材料起始量较大时,可以直接按步骤 7 进行(否则 DNA 含量过高可能造成 gDNA Eraser Spin Column 堵塞),如基因组含量较低或材料起始量较少时,可以按步骤 3-6 进行。
(3)将gDNA Eraser Spin Column放到2 mL 的Collection Tube(试剂盒提供)上。
(4)将裂解液转移入到gDNA Eraser Spin Column中。
1.引物应用核酸系列保守区内设计并具有特异性。
最好位于编码区5’端的300-400bp区域
内,可以用DNAman,Alignment 软件看看结果。
2. 产物不能形成二级结构(自由能小于58.61KJ/mol)。
3.引物长度一般在17-25碱基之间,上下游引物不能相差太大。
4.G+C含量在40%~60%之间,45-55%最佳。
5.碱基要随机分布,尽量均匀。
6.引物自身不能有连续4个碱基的互补。
7.引物之间不能有连续4个碱基的互补。
8.引物5′端可以修饰。
9.3′端不可修饰,而且要避开AT,GC rich的区域,避开T/C,A/G连续结构(2-3个)。
10. 引物3′端要避开密码子的第3位。
11.引物整体设计自由能分布5‘端大于3’端,且3‘端自由能最好小于9KJ/mol。
可用oligo 6 软件进行比对看结果的情况。
12.做荧光定量产物长度80-150bp最好,最长是300bp.
13.引物设计避免DNA污染,最好跨外显子接头区。
14.引物与非特异性扩增序列的同源性最好小于70%或者有8个互补碱基同源。
15.查看有无假基因的存在。
假基因就是无功能的DNA序列,与需要扩增的目的片段长
度相似。
16.TM值在58-62度之间。
17.引物设计的软件Primer 5.0 有专门针对荧光的。
设计的目的是在两个目标间取得平衡:扩增特异性和扩增效率。
引物分析软件将试图通过使用每一引物设计变化的预定值在这两个目标间取得平衡。
设计引用有一些需要注意的基本原理:
①引物长度
一般引物长度为18~30碱基。
总的说来,决定引物退火温度(Tm值)最重要的因素就是引物的长度。
有以下公式可以用于粗略计算引物的退火温度。
在引物长度小于20bp时:[4(G+C)+2(A+T)]-5℃
在引物长度大于20bp时:62.3℃+0.41℃(%G-C)-500/length-5℃
另外有许多软件也可以对退火温度进行计算,其计算原理会各有不同,因此有时计算出的数值可能会有少量差距。
为了优化PCR反应,使用确保退火温度不低于54℃的最短的引物可获得最好的效率和特异性。
总的说来,每增加一个核苷酸引物特异性提高4倍,这样,大多数应用的最短引物长度为18个核苷酸。
引物长度的上限并不很重要,主要与反应效率有关。
由于熵的原因,引物越长,它退火结合到靶DNA上形成供DNA聚合酶结合的稳定双链模板的速率越小。
②GC含量
一般引物序列中G+C含量一般为40%~60%,一对引物的GC含量和Tm值应该协调。
若是引物存在严重的GC倾向或AT倾向则可以在引物5’端加适量的A、T或G、C尾巴。
③退火温度
退火温度需要比解链温度低5℃,如果引物碱基数较少,可以适当提高退火温度,这样可以使PCR的特异性增加;如果碱基数较多,那么可以适当减低退火温度,是DNA双链结合。
一对引物的退火温度相差4℃~6℃不会影响PCR的产率,但是理想情况下一对引物的退火温度是一样的,可以在55℃~75℃间变化。
④避免扩增模板的二级结构区域
选择扩增片段时最好避开模板的二级结构区域。
用有关计算机软件可以预测估计目的片段的稳定二级结构,有助于选择模板。
实验表明,待扩区域自由能(△G)小于58.6lkJ/mol时,扩增往往不能成功。
若不能避开这一区域时,用7-deaza-2’-脱氧GTP取代dGTP对扩增的成功是有帮助的。
⑤与靶DNA的错配
当被扩增的靶DNA序列较大的时候,一个引物就有可能与靶DNA的多个地方结合,造成结果中有多个条带出现。
这个时候有必要先使用BLAST软件进行检测,网址:/BLAST/。
选择Align two sequences (bl2seq),如下图。
BLAST的使用方法也十分简单,如下图所示。
将引物序列粘贴到1区,将靶DNA序列粘贴到2区,这两者可以互换的,并且BLAST会计算互补、反义链等多种可能,所以不需要用户注意两条链是否都是有义链。
如果知道序列在数据库中的GI号也可以直接
输入GI号,这样就不用粘贴一大段的序列了。
最后在3处点击Align就可以查看引物在靶DNA中是否有多个同源位点了。
可是使用BLAST还是有其不方便的地方。
因为它一次只能比较两条序列,那么一对引物就需要分开进行比对。
如果存在错配,还需要自己计算由于错配形成的片段长度有多大。
在下一篇中将介绍一个软件,可以直接将靶DNA和引物输入对产物片段进行预测。
⑥引物末端
引物3’端是延伸开始的地方,因此要防止错配就从这里开始。
3’端不应超过3个连续的G或C,因这样会使引物在G+C富集序列区错误引发。
3′端也不能有形成任何二级结构可能,除在特殊的PCR(AS-PCR)反应中,引物3′端不能发生错配。
如扩增编码区域,引物3′端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增特异性与效率。
⑦引物的二级结构
引物自身不应存在互补序列,否则引物自身会折叠成发夹状结构,这种二级结构会因空间位阻而影响引物与模板的复性结合。
若用人工判断,引物自身连续互补碱基不能大于3bp。
两引物之间不应该存在互补性,尤应避免3′端的互补重叠以防引物二聚体的形成。
一般情况下,一对引物间不应多于4个连续碱基的同源性或互补性。
⑧为了下一步操作而产生的不完全匹配
5’端对扩增特异性影响不大,因此,可以被修饰而不影响扩增的特异性。
引物5′端修饰包括:加酶切位点;标记生物素、荧光、地高辛、Eu3+等;引入蛋白质结合DNA序列;引入突变位点、插入与缺失突变序列和引入一启动子序列等。
额外的碱基或多或少会影响扩增的效率,还加大引物二聚体形成的几率,但是为了下一步的操作就要作出适当的“牺牲”。
很多时候PCR只是初步克隆,之后我们还需要将目的片段亚克隆到各种载体上,那么就需要在PCR这个步骤为下一步的操作设计额外的碱基。
以下总结一些为了亚克隆所要设计的序列。
a 添加限制性内切酶酶切位点
添加酶切位点是将PCR产物进行亚克隆使用得最多的手段。
一般酶切位点是六个碱基,另外在酶切位点的5’端还需要加2~3个保护碱基。
但是不同的酶需要的保护碱基数目是不相同的,例如:SalⅠ不需要保护碱基,EcoRⅤ需要1个,NotⅠ需要2个,Hind Ⅲ3个。
其中,在原核表达设计引物时还有一些小技巧,大家可以参考:《原核表达之实验前的分析》。
里面一些规则是所有表达都通用的。
有一种做法是在进行PCR反应的同时进行酶切,这样就需要注意一些内切酶在PCR反应中的酶切反应率,见附录。
不过这种方法虽然方便但并不推荐。
有时候,就是把PCR产物回收后酶切再与载体连接效果都不尽理想,同步进行会使出现问题的原因变得更加复杂。
一旦出现问题,分析起来更麻烦。
b LIC添加尾巴
LIC的全称是Ligation-Independent cloning,它是Navogen公司专门为其部分的pET载体而发明的一种克隆方法。
用LIC 法制备的pET 载体有不互补的12–15 碱基单链粘端,与目的插入片段上相应粘端互补。
扩增目的插入片段的引物5'序列要与LIC载体互补。
T4 DNA 聚合酶的3'→5'外切活性经短时间即可在插入片段上形成单链粘端。
由于只能由制备好的插入片段和载体互相退火形成产物,这种方法非常快速高效,而且为定向克隆。
c 定向TA克隆添加尾巴
在T载体刚出的时候大家都拍手称赞,真是方便,哪个小子脑子这么聪明想出来的。
但是后来人们发现TA克隆无法将片段定向克隆到载体中,所以后来Invitrogen推出了可以定向克隆的载体,它的一端含有四个突出的碱基GTGG。
因此在PCR引物设计时也要相应的加上与之互补的序列,这样片段就可以“有方向”了。
d In-Fusion克隆方法
这项技术是Clontech还属于BD的时候推出的。
此技术就其步骤来说是及其方便的,不需连接酶,不需长时间的反应。
只要在设计引物的时候引入一段线性化载体两端的序列,然后将PCR产物和线性化的载体加入到含有BSA的In-Fusion酶溶液中,在室温下放置半个小时就可以进行转化了。
这种方法特别适合大批量的转化。
如果要加入额外的碱基总是或多或少会影响到整个PCR反应,比如在加入NotⅠ的酶切位点后整个引物的退火温度就会直线上升(它识别的是8个碱基,且全为GC),这样使另外一个引物的设计变得十分困难,因为一对引物间退火温度相差不宜太远。
因此上面提到许多设计原则在实际应用中往往难以做到
都符合。
在碰到这些情况的时候,我们只能秉着“实践是检验真理的唯一标准”这一原则,要试一试才能知道能否行得通了
如有侵权请联系告知删除,感谢你们的配合!如有侵权请联系告知删除,感谢你们的配合!。