2020高考化学一轮复习 分子结构与性质
- 格式:pptx
- 大小:4.40 MB
- 文档页数:100
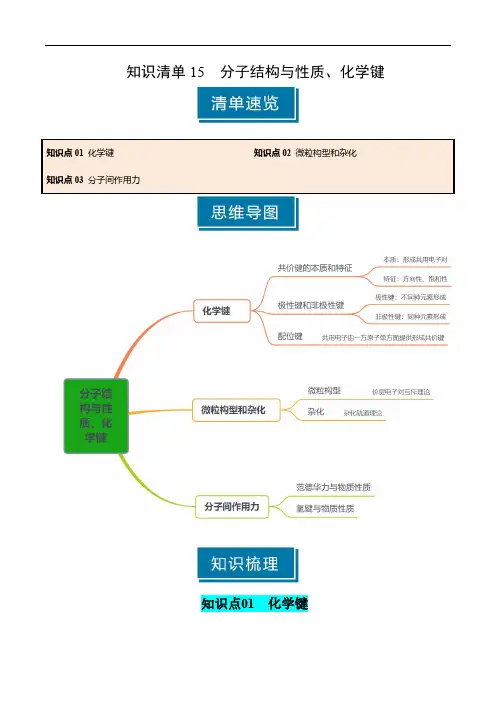
知识清单15分子结构与性质、化学键知识点01化学键一、共价键的特征及成键原则1.共价键的本质和特征共价键本质两原子之间形成共用电子对特征一定有饱和性有方向性(键除外)2.常见原子的成键数目IA IIA IIIA IVA VA VIA VIIA HBeB 、AlC 、SiN 、PO 、SF 、Cl 3.形成化学键的目的:使体系的能量最,达到稳定结构二、极性键和非极性键1.分类依据:2.极性键和非极性键的比较分类极性共价键非极性共价键成键原子元素原子元素原子电子对偏移偏移成键原子的电性一个原子呈电性(δ+),一个原子呈电性(δ-)呈3.极性强弱:成键元素的电负性越大,共用电子对偏移程度越大,极性越。
4.键的极性对化学性质的影响(1)共价键的极性越强,键的活泼性也越,发生断裂,发生相关的化学反应。
(2)成键元素的原子吸引电子能力越强,电负性越,共价键的极性就越,在化学反应中该分子的反应活性越,在化学反应中越断裂。
5.键的极性对羧酸酸性的影响(1)三氟乙酸与三氯乙酸的酸性强弱①酸性强弱三氟乙酸三氯乙酸②原因电负性:FCl极性:F -CCl -C极性:F 3C -Cl 3C -羟基极性:三氟乙酸三氯乙酸(2)甲酸、乙酸和丙酸的酸性强弱①酸性强弱:甲酸乙酸丙酸②原因烷基(-R )是基团,烷基越长效应越大,使羧基中的羟基极性,羧酸的酸性。
随着烷基加长,酸性差异越来越三、σ键和π键1.分类依据:2.形成(1)σ键的形成σ键形成由成键原子的s 轨道或p 轨道重叠形成类型1s-s型2s-p 型3p-p 型(2)π键的形成:由两个原子的p 轨道“肩并肩”重叠形成3.成键特点共价键σ键π键电子云重叠方式或轨道重叠程度电子云对称特征对称对称能否自由旋转3.(1)判断方法:一般来说,共价单键是键,共价双键是键,共价三键是键。
(2)常见分子中的键型和数目分子N 2HCN COS C 2H 4C 2H 2结构式H —C 三NO=C=S CC H H H HH-C 三C-H键型、数目个σ键个π键个σ键个π键个σ键个π键个σ键个π键个σ键个π键4.稳定性:一般键稳定,必须根据键能进行计算化学键N≡N N-N键能kJ·mol-1942247计算判断氮气中键的稳定。






分子结构与物质的性质1.下列物质中,由极性键形成的非极性分子是()A.CO2B.Br2C.CaCl2D.SO22.实验测得BeCl2为共价化合物,两个Be—Cl键的夹角为180°,由此可判断BeCl2属于()A.由极性键形成的极性分子B.由极性键形成的非极性分子C.由非极性键形成的极性分子D.由非极性键形成的非极性分子3.下列各组分子中,都属于含极性键的非极性分子的是()A.CO2、H2S B.C2H4、CH4C.Cl2、C2H2D.NH3、HCl4.X、Y为两种不同的元素,下列化学式一定为极性分子的是()A.XY B.XY2 C.XY3 D.XY45.下列物质发生状态变化时,克服了范德华力的是()A.食盐熔化B.HCl溶于水C.碘升华D.氢氧化钠熔化6.下列说法中正确的是()A.分子间作用力越大,分子越稳定B.分子间作用力越大,物质的熔、沸点越高C.相对分子质量越大,其分子间作用力越大D.分子间只存在范德华力7.下列叙述与分子间作用力无关的是()A.气体物质加压或降温时能凝结或凝固B.干冰易升华C.氟、氯、溴、碘单质的熔、沸点依次升高D.氯化钠的熔点较高8.下列有机物中含有两个手性碳原子的是()A.B.C .D .9.下列有机物分子中带“*”碳原子就是手性碳原子。
该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )A .与乙酸发生酯化反应B .与NaOH 水溶液反应C .与银氨溶液作用发生银镜反应D .催化剂作用下与H 2反应10.结合下表数据分析,下列关于乙醇、乙二醇的说法,不合理...的是( )物质 分子式 沸点/℃ 溶解性乙醇 C 2H 6O 78.5 与水以任意比混溶乙二醇 C 2H 6O 2 197.3 与水和乙醇以任意比混溶A .二者的溶解性与其在水中能够形成氢键有关B .可以采用蒸馏的方法将二者进行分离C .丙三醇的沸点应该高于乙二醇的沸点D .二者组成和结构相似,互为同系物11.下列分子为手性分子的是( )A .CH 3CH 2ClB .CH 3CH 2CHBrCH 2CH 2OHC .CH 3CCl(CH 3)CH 2CH 2CH 3D .CH 3CH 2C(CH 3)2CH 2Cl1.下列关于粒子结构的描述错误的是( )A .CS 2、C 2H 2、BeCl 2都是直线形分子B .CCl 4和CH 2Cl 2均是四面体构型的非极性分子C .H 2S 和NH 3均是由极性键构成的极性分子D .HCl 和HS -均是含有一个极性键的18电子粒子2.以下变化中只是共价键被破坏的是( )A .硫酸氢钠溶于水B .溴溶于四氯化碳C .氯化铵受热分解D .二氧化硅熔化3.下列反应中,同时有离子键、极性共价键和非极性共价键的断裂和形成的是() A .NH 4Cl=====△NH 3↑+HCl↑B.NH3+CO2+H2O===NH4HCO3C.2NaOH+Cl2===NaCl+NaClO+H2OD.2Na2O2+2CO2===2Na2CO3+O24.下列对分子及其性质的解释中,不正确的是()A.液态氟化氢分子间存在氢键,所以氟化氢的沸点比氯化氢高B.CH4、CO2、BF3都是含有极性键的非极性分子C.[Cu(NH3)4]2+ 中含有离子键、极性键、配位键D.因为非羟基氧原子数目逐渐减少,所以酸性HClO4>H2SO4>H3PO45.下列有关范德华力的叙述正确的是()A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键B.范德华力与化学键的区别是作用力的强弱不同C.任何分子间在任意情况下都会产生范德华力D.范德华力非常微弱,故破坏范德华力不需要消耗能量6.下列物质的性质可用范德华力的大小来解释的是()A.HF、HCl、HBr、HI的热稳定性依次减弱B.F2、Cl2、Br2、I2的熔、沸点依次升高C.、H—O—H、C2H5—OH中—OH上氢原子的活泼性依次减弱D.CH3—O—CH3、C2H5OH的沸点依次升高7.下列物质中不存在氢键的是()A.冰醋酸中醋酸分子之间B.液态氟化氢中氟化氢分子之间C.氨水中氨分子与水分子之间D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间8.下列说法正确的是()A.氢键是化学键B.甲烷可与水形成氢键C.乙醇分子跟水分子之间不只存在范德华力D.碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键9.下列说法正确的是()A.乙硫醇(CH3CH2—SH)比乙醇(CH3CH2—OH)熔点低,原因是乙醇分子间易形成氢键B.氯化钠易溶于水是因为形成了氢键C.氨易液化与氨分子间存在氢键无关D.H2O是一种非常稳定的化合物,这是由于氢键所致10.下列现象不能用“相似相溶”原理解释的是()3.下列说法不正确的是()A.互为手性异构体的分子互为镜像B.利用手性催化剂合成可主要得到一种手性分子C.手性异构体分子组成相同D.手性异构体性质相同11.碘单质在水中溶解度很小,但在CCl4中溶解度很大,这是因为()A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大B.CCl4与I2都是直线形分子,而H2O不是直线形分子C.CCl4和I2都不含氢元素,而H2O中含有氢元素D.CCl4和I2都是非极性分子,而H2O是极性分子12.丙氨酸(C3H7NO2)分子为手性分子,它存在手性异构体,如下图所示:下列关于丙氨酸的两种手性异构体(℃和℃)的说法正确的是()A.℃和℃分子中均存在2个手性碳原子B.℃和℃呈镜面对称,具有不同的分子极性C.℃和℃分子都是极性分子,只含有极性键,不含非极性键D.℃和℃的化学键相同,但分子的性质不同13.下列说法正确的是()A.甘油(CH2OH—CHOH—CH2OH)分子中含有1个手性碳原子B.互为手性异构体的化合物,所含化学键的种类和数目完全相同C.互为手性异构体的化合物,在三维空间不能重合,但物理、化学性质却几乎完全相同D.互为手性异构体的化合物,分子组成不同,所以物理、化学性质也不同14.下列说法中正确的是()A.CH4、C2H2、HCN都是含有极性键的非极性分子B.CO2与SO2的立体构型相似,都是非极性分子C.分子中含有1个手性碳原子D.含氧酸可用通式(HO)m RO n表示,若m值越大,则含氧酸的酸性越强15.有机物3具有手性,发生下列反应后,分子仍有手性的是()①与H2发生加成反应②与乙酸发生酯化反应③发生水解反应④发生消去反应A.①②B.②③C.①④D.②④1.中国化学家研究出一种新型复合光催化剂能利用太阳光高效分解水原理如图所示,下列说法正确的是()A.H2O2中存在非极性共价键,是非极性分子B.反应Ⅰ中涉及极性键的断裂和非极性键的形成C.非极性分子中一定有非极性键,极性分子中一定有极性键D.H2O由于是非极性分子而稳定性强2.下列叙述中正确的是()A.能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸B.无机含氧酸分子中含有几个羟基,它就属于几元酸C.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸D.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强3.过氧乙酸是一种绿色生态杀菌剂,,结构简式为下列说法不正确的是()A.分子中2个碳原子的杂化方式不相同B.其熔点主要取决于所含化学键的键能C.过氧乙酸中含有极性共价键和非极性共价键D.过氧乙酸易溶于水4.人们为了营养肌肤,往往需要搽用护肤品。

分子结构与性质1.三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是A.分子中每个原子最外层均达到8电子稳定结构B.P4S3中硫元素为-2价,磷元素为+3价C.热化学方程式为P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/molD.一个P4S3分子中含有三个非极性共价键【答案】B【解析】A、P原子最外层有5个电子,含3个未成键电子,S原子最外层有6个电子,含2个未成键电子,由P4S3的分子结构可知,每个P形成3个共价键,每个S形成2个共价键,分子中每个原子最外层均达到8电子稳定结构,A正确;B、由P4S3的分子结构可知,1个P为+3价,其它3个P都是+1价,正价总数为+6,而S为-2价,B错误;C、根据燃烧热的概念:1mol可燃物燃烧生成稳定氧化物放出的热量为燃烧热,则P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H= -3677kJ/mol,C正确;D、由P4S3的分子结构可知,P-P之间的键为非极性键,P-S之间的键为极性键,一个P4S3分子中含有三个非极性共价键,D正确。
2.常温下三氯化氮(NCl3)是一种淡黄色的液体,其分子结构呈三角锥形,以下关于NCl3说法正确的是()A.该物质中N-C1键是非极性键B.NCl3中N原子采用sp2杂化C.该物质是极性分子D.因N-C1键的键能大,所以NCl3的沸点高【答案】C【解析】A、N和Cl是不同的非金属,则N-Cl键属于极性键,故A错误;B、NCl3中N有3个σ键,孤电子对数5312-⨯=1,价层电子对数为4,价层电子对数等于杂化轨道数,即NCl3中N的杂化类型为sp3,故B错误;C、根据B选项分析,NCl3为三角锥形,属于极性分子,故C正确;D、NCl3是分子晶体,NCl3沸点高低与N-Cl键能大小无关,故D错误。

2020年高考化学一轮复习:物质的组成、性质和分类一、选择题(本题共10小题,每小题只有一个选项符合题意)1.清华大学的科学家将古老的养蚕技术与时兴的碳纳米管和石墨烯结合,发现通过给蚕宝宝喂食含有碳纳米管和石墨烯的桑叶,可以获得更加牢固的蚕丝纤维。
已知:当把石墨片剥成单层之后,这种只有一个碳原子厚度的单层就是石墨烯。
下列说法正确的是() A.蚕丝纤维的主要成分是纤维素B.石墨烯像烯烃一样,是一种有机物C.碳纳米管和石墨烯互为同素异形体D.碳纳米管具有丁达尔效应解析:选C A项,蚕丝的主要成分是蛋白质,错误;B项,石墨烯是单质,属于无机物,错误;C项,碳纳米管和石墨烯是碳元素的不同单质,互为同素异形体,正确;D项,碳纳米管在合适的分散剂中才能形成胶体分散系,错误。
2.化学与生产和生活密切相关。
下列过程中没有发生化学变化的是()A.氯气作水的杀菌消毒剂B.硅胶作袋装食品的干燥剂C.二氧化硫作纸浆的漂白剂D.肥皂水作蚊虫叮咬处的清洗剂解析:选B氯气作水的杀菌消毒剂是利用氯气与水反应生成的次氯酸的强氧化性,发生了化学变化;硅胶作袋装食品的干燥剂,是因为硅胶疏松多孔,具有吸收水分的作用,没有发生化学变化;二氧化硫作纸浆的漂白剂是因为二氧化硫可与某些有色物质发生化学反应生成不稳定的无色物质;肥皂的主要成分为高级脂肪酸钠,肥皂水作蚊虫叮咬处的清洗剂是利用高级脂肪酸钠在水中发生水解反应使溶液呈碱性的性质,发生了化学变化。
3.最近我国科研人员发现在温和的反应条件下,甲烷和二氧化碳在锌修饰的H-ZSM-5分子筛(催化剂)上可一步转化为乙酸。
CH4、CO2和CH3COOH均属于() A.有机物B.共价化合物C.电解质D.离子化合物解析:选B CH4、CO2和CH3COOH均属于共价化合物。
4.化学与生产、生活密切相关。
下列说法中,不正确的是()A.“血液透析”利用了胶体的性质B.服用铬含量超标的药用胶囊会对人体健康造成危害C.人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因D.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染解析:选C氮氧化物和二氧化硫的排放是形成酸雨的主要原因,C错误。

分子结构与性质一、单选题1.下列有关说法正确的是A.水分子间的氢键是一个水分子中氢原子与另一个水分子中的氧原子间形成的化学健B.Na与水反应时,增加水的用量可以明显加快化学反应速率C.纯碱溶液清洗油污时,加热可以增强其去污力D.向海水中加入净水剂明矾可以使海水淡化【答案】C【解析】A.氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的分子间作用力,不是化学键,故A错误;B.钠与水反应时,可将块状钠变成细小颗粒,能加快反应速率,由于水为纯净物,浓度为定值,增加水的用量,浓度不变,不能加快反应速率,故B错误;C.温度升高,使纯碱水解的程度增大,氢氧根变多,碱性增强,所以去污能力增强,故C正确;D.明矾中铝离子水解产生氢氧化铝胶体,具有吸附作用,可以吸附水中的悬浮物,只能用来净水,而不能使海水淡化,故D错误;故答案为C。
2.缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。
下列说法错误的是()A.NH3、BF3、CCl4中只有BF3是缺电子化合物B.BF3、CCl4中心原子的杂化方式分别为sp2、sp3C.BF3与NH3反应时有配位键生成D.CCl4的键角小于NH3【答案】D【解析】A.NH3电子式为,符合路易斯结构,BF3电子式为,B原子价层电子数为6,不符合路易斯结构,CCl4电子式为、,符合路易斯结构,只有BF3是缺电子化合物,故A正确;B.BF3中心原子B价层电子对数为3+12× (3-3×1)=3,则杂化方式为sp2杂化;CCl4中心原子C价层电子对数为4+12×(4-4×1)=4,则杂化方式为sp3杂化,故B正确;C.BF3与NH3反应时,NH3中N原子有孤电子对,BF3中B有空轨道,可生成配位键,故C正确;l4和NH3均为sp3杂化,CCl4中心原子无孤电子对,NH3有一对孤电子对,根据价层电子对互斥理论,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,键角减小,则CCl4的键角大于NH3,故D 错误;故答案选:D。

2020年高考化学复习物质结构与性质简答题模型一、物质熔沸点问题1、氯化铝的熔点为190°C,而氟化铝的熔点为1290°C,导致这种差异的原因为_______________【答】A1C13是分子晶体,而A1F3是离子晶体2、P4010的沸点明显高于P406,原因为______________________________【答】都是分子晶体,P4010的分子作用力高于P4063、H2S熔点为-85. 5°C,而与其具有类似结构的H20的熔点为0°C,极易结冰成固体,二者物理性质出现此差异的原因是:______________________________________________________【答】H20分子之间极易形成氢键,而H2S分子之间只存在较弱的范德华力。
4、二氧化硅的熔点比C02 高的原因:________________________________________________ 【答】C02是分子晶体,Si02是原子晶体。
5、CuO的熔点比CuS的高,原因是:________________________________________【答】氧离子半径小于硫离子半径,所以CuO的离子键强,晶格能较大,熔点较高。
6、邻疑基苯甲醛的沸点比对轻基苯甲醛的沸点低,原因是:_____________________________________________【答】邻疑基苯甲醛形成分子内氢键,而对疑基苯甲醛形成分子间氢键,分子间氢键使分子间作用力更大。
7、乙二胺分子(H2N—CH2—CH2—NH2)中氮原子杂化类型为SP3 ,乙二胺和三甲胺:N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是:_____________________________________________【答】乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键。
第30讲分子结构与性质1.下列叙述中正确的是()A.以非极性键结合起来的双原子分子一定是非极性分子B.BCl3与NCl3均为三角锥形结构,均为极性分子C.非极性分子只能是双原子单质分子D.非极性分子中一定含有非极性键2.硒是人体必需的微量元素之一,价电子排布式为2n s n2n p2n。
下列说法错误的是() A.沸点:H2Se>H2O B.稳定性:H2Se<HFC.电负性:Se<Br D.分子极性:SeO2>SO33.下列事实不能用分子间作用力或氢键解释的是()A.HF、H2O的沸点分别比HCl、H2S的沸点高很多B.正戊烷的沸点比新戊烷的沸点高C.的沸点比的沸点低D.Na2O的熔点比MgO的熔点低4.下列说法正确的是()A.甘油(CH2OH—CHOH—CH2OH)分子中含有1个手性碳原子B.互为手性异构体的化合物,所含化学键的种类和数目完全相同C.互为手性异构体的化合物,在三维空间不能重合,但物理、化学性质却几乎完全相同D.互为手性异构体的化合物,分子组成不同,所以物理、化学性质也不同5.已知几种共价键的键能如下:下列说法错误的是()A.键能:N≡N>N===N>N—NB.H(g)+Cl(g)===HCl(g)ΔH=-431.8 kJ·mol-1C.H—N键能小于H—Cl键能,所以NH3的沸点高于HClD.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g)ΔH=-463.9 kJ·mol-16.徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。
下列说法正确的是()A.H2O2分子中的O为sp2杂化B.CO2分子中C原子为sp杂化C.BF3分子中的B原子为sp3杂化D.CH3COOH分子中C原子均为sp2杂化7.膦又称磷化氢,化学式为PH3,在常温下是一种无色有大蒜臭味的有毒气体,它的分子呈三角锥形。
2020高考化学一轮复习第十二章有机化学基础12.3分类突破(2)醇、酚、醛学案(含解析)第3课时分类突破2醇、酚、醛知识点一醇的结构与性质1.醇的结构醇是羟基与烃基或苯环侧链上的碳原子相连的化合物,饱和一元脂肪醇的通式为CnH2n+1OHn≥1。
如乙醇的组成和结构2.醇的分类[提醒] 在二元醇或多元醇的分子中,两个或两个以上羟基结合在同一个碳原子上时物质不能稳定存在如。
3.醇的物理性质递变规律4.醇的化学性质反应类型条件断键位置化学方程式以乙醇为例氧化反应O2Cu,△①③2CH3CH2OH+O22CH3CHO+2H2O 点燃①②③④⑤CH3CH2OH+3O22CO2↑+3H2O 置换反应Na 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 取代反应浓HBr,△ CH3CH2OH+HBrCH3CH2Br+H2O 取代反应浓硫酸,140 ℃①和②2CH3CH2OHC2H5OC2H5+H2O 取代酯化反应CH3COOH 浓硫酸CH3CH2OH+CH3COOHCH3COOC2H5+H2O 消去反应浓硫酸,170 ℃②④CH3CH2OHCH2CH2↑+H2O 5.醇的两大反应规律1醇的消去反应规律醇分子中,连有羟基OH的碳原子必须有相邻的碳原子,并且此相邻的碳原子上必须连有氢原子时,才可发生消去反应,生成不饱和键。
表示为2醇的催化氧化规律醇的催化氧化产物的生成情况与跟羟基OH相连的碳原子上的氢原子的个数有关。
6.几种常见的醇名称甲醇乙二醇丙三醇俗称木精、木醇甘油结构简式CH3OH 状态液体液体液体溶解性易溶于水和乙醇[对点训练] 1.下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是A.CH3OH B.CH2OHCH2CH3 C.CH33COH D.CH32COHCH2CH3 解析选B CH3OH不能发生消去反应,故A错误;CH2OHCH2CH3发生消去反应生成丙烯,发生氧化反应生成丙醛,故B正确;CH33COH不能发生催化氧化生成相应的醛,只可以发生消去反应生成相应的烯烃,故C错误;CH32COHCH2CH3不能催化氧化生成相应的醛,能发生消去反应生成相应的烯烃,故D错误。
分子结构与性质1.在下列化学反应中,所断裂的共价键中,仅仅断裂σ键的是( )A .N 2+3H 2高温、高压催化剂2NH 3B .2C 2H 2+5O 2=====点燃2H 2O +4CO 2C .Cl 2+H 2=====光照2HClD .C 2H 4+H 2――→催化剂C 2H 6【答案】C【解析】A 项,N 2:N≡N ,分子中含1个σ键和2个π键;B 项,C 2H 2:CH≡CH ,分子中含1个σ键和2个π键;D 项,C 2H 4:CH 2===CH 2,分子中含1个σ键和1个π键。
2.下列物质中既有极性键,又有非极性键的非极性分子是( )A .二氧化硫B .四氯化碳C .二氧化碳D .乙炔 【答案】D【解析】分子中既有极性键又有非极性键,则分子中必须既有同种元素原子间所成的键,又有不同种元素原子间所成的键,而在A 、B 选项中同种原子间没有成键,也就没有非极性键。
要求分子为非极性分子,则分子中原子的排列一定是对称的,只有这样才能使分子中正、负电荷的中心重合,使分子无极性。
3.下列关于价层电子对互斥理论及杂化轨道理论的叙述不正确的是( )A .价层电子对互斥理论将分子分成两类:中心原子有孤电子对的和无孤电子对的B .价层电子对互斥理论既适用于单质分子,也适用于化合物分子C .sp 3杂化轨道是由同一个原子中能量相近的s 轨道和p 轨道通过杂化形成的一组能量相近的新轨道D .AB 2型共价化合物的中心原子A 采取的杂化方式可能不同【答案】B【解析】在VSEPR 理论中,将分子分成了中心原子含孤电子对与不含孤电子对两种情况,显然分子的VSEPR 模型与立体构型可能相同(不含孤电子对的情况下),也可能不同(含孤电子对的情况下),A 项正确;VSEPR 模型的研究对象仅限于化合物分子,不适用于单质分子,B 项错误;AB 2型共价化合物由于其中心原子具有的孤电子对数和σ键电子对数可能不同,则其采取的杂化方式也可能不同,D 项正确。
考点集训(三十九)分子结构与性质(建议用时:40分钟)(对应考点集训第305页)[A级基础达标]1.指出下列分子或离子的立体构型和中心原子的杂化类型。
(1)H2S________________,CO2________________________________________________________________________,PH3________,PCl3________,BF3________,HCN______________,HCHO________________________________________________________________________,SO2____________,SiH4________________________________________________________________________。
(2)NH+4________,NO-2________,SO2-4________,SO2-3______________,ClO-3______________,ClO-4________,SiO2-3________。
[答案](1)V形、sp3直线形、sp三角锥形、sp3三角锥形、sp3平面三角形、sp2直线形、sp平面三角形、sp2V形、sp2正四面体形、sp3(2)正四面体形、sp3V形、sp2正四面体形、sp3三角锥形、sp3三角锥形、sp3正四面体形、sp3平面三角形、sp22.比较下列分子或离子中键角大小。
(1)H2O________H3O+,NH3________NH+4。
(2)H2O________H2S,NH3________PH3。
(3)SO3________CCl4,CS2________SO2。
[解析](1)H2O与H3O+,NH3与NH+4的中心原子均采用sp3杂化,孤电子对越多,孤电子对间斥力越大,键角越小。