甲醇制氢工艺设计
- 格式:doc
- 大小:2.18 MB
- 文档页数:40

前言氢气是一种重要的工业产品,它广泛用于石油、化工、建材、冶金、电子、医药、电力、轻工、气象、交通等工业部门和服务部门,由于使用要求的不同,这些部门对氢气的纯度、对所含杂质的种类和含量都有不相同的要求,特别是改革开放以来,随着工业化的进程,大量高精产品的投产,对高纯度的需求量正逐步加大,等等对制氢工艺和装置的效率、经济性、灵活性、安全都提出了更高的要求,同时也促进了新型工艺、高效率装置的开发和投产。
依据原料及工艺路线的不同,目前氢气主要由以下几种方法获得:①电解水法;②氯碱工业中电解食盐水副产氢气;③烃类水蒸气转化法;④烃类部分氧化法;⑤煤气化和煤水蒸气转化法;⑥氨或甲醇催化裂解法;⑦石油炼制与石油化工过程中的各种副产氢;等等。
其中烃类水蒸气转化法是世界上应用最普遍的方法,但该方法适用于化肥及石油化工工业上大规模用氢的场合,工艺路线复杂,流程长,投资大。
随着精细化工的行业的发展,当其氢气用量在200~3000m3/h时,甲醇蒸气转化制氢技术表现出很好的技术经济指标,受到许多国家的重视。
甲醇蒸气转化制氢具有以下特点:(1与大规模的天然气、轻油蒸气转化制氢或水煤气制氢相比,投资省,能耗低。
(2与电解水制氢相比,单位氢气成本较低。
(3所用原料甲醇易得,运输、贮存方便。
(4可以做成组装式或可移动式的装置,操作方便,搬运灵活。
对于中小规模的用氢场合,在没有工业含氢尾气的情况下,甲醇蒸气转化及变压吸附的制氢路线是一较好的选择。
本设计采用甲醇裂解+吸收法脱二氧化碳+变压吸附工艺,增加吸收法的目的是为了提高氢气的回收率,同时在需要二氧化碳时,也可以方便的得到高纯度的二氧化碳。
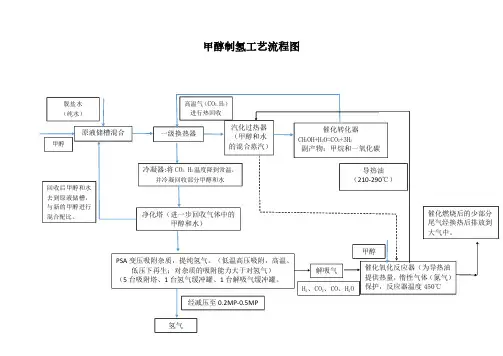
目录1.设计任务书 (32.甲醇制氢工艺设计 (42.1 甲醇制氢工艺流程 (42.2 物料衡算 (42.3 热量衡算 (63.反应器设计 (93.1 工艺计算 (93.2 结构设计 (134.管道设计………………………………………....…5.自控设计………………………………………....…6.技术经济评价、环境评价………………………7.结束语………………………………………....……8.致谢………………………………………....………9.参考文献………………………………………....…附录:1.反应器装配图,零件图2.管道平面布置图3.设备平面布置图4.管道仪表流程图5.管道空视图6.单参数控制方案图1、设计任务书2、甲醇制氢工艺设计2.1 甲醇制氢工艺流程甲醇制氢的物料流程如图1-2。

甲醇制氢装置工艺流程
甲醇制氢装置的工艺流程主要包括以下几个部分:
1. 甲醇重整:甲醇在催化剂的作用下,与脱盐水发生分解转化反应,生成氢气和二氧化碳。
这一步是甲醇制氢过程的关键环节,需要高效的催化剂和适当的反应条件。
2. 氢气和一氧化碳冷却:生成的氢气和一氧化碳混合物需要经过冷却,以便后续处理。
3. 甲醇蒸汽转化:冷却后的氢气和一氧化碳混合物在高温高压下,通过催化剂(如CuO、Al2O3、V2O3、Fe2O3等)的作用,生成更多的氢气。
4. 气体分离:转化后的氢气与二氧化碳混合物需要进行分离。
这可以通过吸附剂处理或化学方法实现。
吸附剂处理是一种常用的方法,如使用活性炭、分子筛等吸附剂,将氢气与二氧化碳分离。
5. 氢气提纯:分离出的氢气往往还需要进行进一步的提纯,以满足不同用途的要求。
常用的提纯方法包括冷冻分离、Pressure Swing Adsorption(PSA)等。
6. 产品储存和输送:提纯后的氢气需要储存和输送。
这可以通过高压储氢罐、管道输送等方式实现。
整个甲醇制氢装置工艺流程具有高效、可靠的特点,能够产生高纯度的氢气,满足不同应用场景的需求。
同时,该工艺原料来源广泛,装置简单,无污染,节能价廉,深受广大中小用户的欢迎。

甲醇裂解制氢工艺流程
甲醇裂解制氢工艺流程是利用催化剂将甲醇分解为氢气和一氧化碳的过程。
一般的甲醇裂解制氢工艺流程包括以下几个步骤:
1. 加热:将甲醇与蒸汽混合并加热到适当的温度,一般为
200-400摄氏度。
加热的目的是提高反应速率和降低催化剂的
活化能。
2. 反应器:将加热后的甲醇蒸汽混合物送入甲醇裂解反应器中。
反应器中装填有催化剂,常用的催化剂包括镍、铜、铁等。
3. 甲醇裂解:在催化剂的作用下,甲醇分解为氢气和一氧化碳。
反应式为:CH3OH → H2 + CO。
4. 分离:将反应后的气体混合物进行分离。
一氧化碳与氢气的物理性质不同,可以通过物理方法如吸附分离、升温分离等进行分离。
5. 纯化:将分离出来的氢气进行纯化处理,去除杂质。
6. 储存和利用:将纯化后的氢气储存起来,可以用于燃料电池等氢能应用。
需要注意的是,甲醇裂解制氢过程中也会生成一氧化碳等副产物,需要进行处理和排放。
此外,甲醇裂解制氢工艺还可能存在反应温度控制、催化剂选择、催化剂寿命等问题,需要根据具体情况进行优化。

甲醇裂解制氢工艺流程
1.原料准备:将纯度高于99%的甲醇作为原料。
由于甲醇的制备工艺
相对成熟,因此原料的准备相对简单。
2.增压处理:为了提高甲醇裂解反应的速率和效果,需要将甲醇经过
增压处理。
这样可以提供足够的反应压力,利于反应的进行。
增压处理常
用的方式是通过高压泵将甲醇送入反应器内。
3.热解反应:将增压处理后的甲醇注入到热解反应器中。
在反应器内,甲醇与催化剂发生作用,产生分解反应。
常见的催化剂包括钯、铑、铂等。
4.加热控制:为了使热解反应能够有效进行,需要对反应器进行加热
处理。
通常采用电加热的方式,提高反应体系的温度,以促进甲醇的分解
反应。
5.分离和收集氢气:在热解反应结束后,需要通过冷凝和分离的方式
将产生的氢气从反应体系中分离出来,并进行收集。
常用的分离方式是通
过冷却后,用水冷凝,将氢气收集进气体收集器中。
6.后处理:收集好的氢气需要进行后处理,以提高纯度和净化程度。
常见的方法是采用吸附剂来吸附气体中的杂质,从而净化氢气。
7.氢气储存:将净化后的氢气储存起来。
常用的方式是将氢气压缩并
从高压容器中储存起来,以便后续使用。
以上就是甲醇裂解制氢工艺的流程,通过以上的步骤可以将甲醇转化
为高纯度的氢气。
甲醇裂解制氢是一种相对成熟的工艺,具有较高的氢气
产率和能源利用率,因此在氢能源领域有一定的应用前景。
但同时也需要
注意处理废气和废水方面的环保问题,以确保工艺的整体可持续性。

工艺过程及化学反应原理一、甲醇裂解1.1.工艺过程甲醇催化转化制气工艺过程包括:原料汽化、催化转化反应、转化气冷却冷凝以及洗涤净化等。
1.1.1.原料汽化原料汽化是指,将甲醇和脱盐水按规定比例计量混合后,用泵加压送入系统进行预热、汽化过热至转化温度的过程。
完成此过程需:原料液罐(F102)、甲醇高位槽(F103)、原料液计量泵(J101A、B)、换热器(C102)、汽化过热器(C101)等设备及其配套仪表和阀门。
该工序目的是为催化转化反应提供规定的原料配比、温度、压力等条件。
1.1.2.催化转化反应在规定温度和压力下,原料混合气在转化器(D101)中,同时完成催化裂解和催化转化两个反应。
完成此反应过程仅需一台转化器(D101)及其配套仪表和阀门。
该工序的目的是完成化学反应,得到主要含有氢气和二氧化碳的转化气。
1.1.3.转化气冷却冷凝将转化器下部出来的高温转化气经冷却、冷凝降到常温。
完成该过程的设备有:换热器(C102)、冷凝器(C103)二台设备及其配套仪表和阀门。
该工序目的是降低转化气温度,将未反应的甲醇、水冷凝下来。
1.1.4.转化气洗涤净化经冷却冷凝后的低温转化气,进入净化塔(E101)用脱盐水洗涤回收未反应的甲醇和水的过程。
完成该过程的设备有:脱盐水计量泵(J102)、脱盐水储罐(F102)、净化塔(E101)、气液分离缓冲罐(F101)等设备及其配套仪表和阀门。
该工序目的是将转化气中未反应完的甲醇,洗涤净化后送PSA工段。
回收的水溶液去F102循环使用。
1.2.化学反应原理甲醇与水蒸汽混合物在转化器中加压催化裂解和转化一步完成,生成氢气和二氧化碳,其反应式如下:主反应:CH3OH=CO+2H2 -90.7kJ/molCO+H2O=CO2+H2 +41.2kJ/mol总反应:CH3OH+H2O=CO2+3H2 -49.5kJ/mol副反应:2CH3OH=CH3OCH3+H2O +24.90kJ/molCO+3H2=CH4+H2O +206.3kJ/mol二、PSAPSA提纯氢气装置是由七台吸附器(E201A~G,下简称A、B、C、D、E、F、G塔)、一台产品氢气缓冲罐(F201)、一台真空罐(F202)、两台真空泵(J201A/B)和一系列程控阀组成。

甲醇制氢工艺流程
甲醇制氢是一种常用的工艺流程,可以用于产生高纯度的氢气。
以下是甲醇制氢的工艺流程:
首先,将甲醇通过加热和蒸发进入甲醇重整器。
甲醇重整器内有一种催化剂,在高温和高压下,催化剂会将甲醇分解为一氧化碳和氢气。
一氧化碳是氢气的主要副产品之一。
然后,将甲醇重整器中产生的氢气和一氧化碳通过热交换器进行冷却,并进一步净化除去残留的杂质。
在热交换器中,氢气和一氧化碳被冷却,以便后续的处理步骤。
冷却后的气体被送入甲醇蒸汽转化器。
在甲醇蒸汽转化器中,一氧化碳在高温和高压下与水蒸汽进行反应,生成二氧化碳和更多的氢气。
该反应通常是一个均衡反应,需要通过适当的温度和压力来促进产氢反应。
从该步骤产生的气体已经相当纯净,但仍然含有少量的二氧化碳。
接下来,通过热交换器进一步冷却气体,并使用压力可变吸附剂装置(PSA)进行气体分离。
在PSA装置中,氢气和二氧
化碳根据其不同的物理特性进行分离。
氢气被收集,而二氧化碳则被释放。
这使得氢气的纯度接近于100% 。
最后,为了进一步提高氢气的纯度,将氢气通过异常压力降下的吸附剂进行处理。
吸附剂可以吸附其他杂质,如水蒸汽和低碳烃。
这样,从该步骤产生的氢气达到工业纯度,可以用于各种应用,如燃料电池和化学工业。
综上所述,甲醇制氢工艺流程主要包括甲醇重整、氢气和一氧化碳冷却、甲醇蒸汽转化、气体分离和吸附剂处理。
这种工艺流程具有高效、可靠的特点,能够产生高纯度的氢气,满足不同应用的需求。

甲醇裂解制氢技术早已成熟,由于水电解制氢设备费用昂贵,耗电量大,氨分解制氢仅对氢氮混合气的制取有明显的经济效果外,而甲醇裂解在某些用氢场合又显得有特殊的经济效果,甲醇是石油化工的一种产物,目前市声上供应比较充足,价格明显低于液氨,而且运输、储存比较方便和安全。
因此甲醇裂解制氢逐步大量推广,有广阔的前景。
甲醇裂解制氢通常将有如下方式:
1.无水甲醇 CH3OH→CO+2H2可得66.7%H2和33.3%CO;
2.甲醇+水 CH3OH+H2O→CO2+H2可得75%H2和25%CO2
上述裂解的混合气,可以用钯管或PSA分离得到含氢99.9%以上的纯氢。
一般小气量情况下应用钯管,大气量情况下应用PSA法提取纯氢,还可以从甲醇裂解中获取二氧化碳。
甲醇裂解制氢装置工艺流程:
甲醇和蒸馏水以一定的比例混合后,经过滤器和计量泵、流量计入汽化器,转为气相后,进入裂炉,内装催化剂,反应温度可控制在300℃左右,裂解气可经过吸收二氧化碳塔来回收二氧化碳,也可直接进入钯管膜或PSA分离装置来提取纯
氢。
氢气纯度达99.999%.。


甲醇裂解制氢含甲醇蒸汽转化和变压吸附制氢两部分甲醇、脱盐水混合后经加热汽化、过热后进入转化炉,甲醇、水蒸气在催化剂的作用下,在转化炉中完成甲醇裂解、一氧化碳变换二氧化碳二步化学反应,反应产物经换热、冷却、冷凝和水洗分离,得到含氢73%、含二氧化碳25%的转化气,甲醇单程转化率90%以上,未反应部分循环使用,转化气进入变压吸附,过程为吸附、逐级降压解吸、逐级升压、吸附,循环进行。
吸附塔数越多,氢气回收率越高。
本系统还需要一个导热油加热系统,可根据厂家不同采用不同的加热办法。
本系统为自动控制系统,在操作室内就可操作。
系统所用原料、消耗及动力、消耗情况:(以1000立方米氢气计)甲醇(0.56t)、脱盐水(0.32t)、柴油(加热导热油)(0.125t)、循环水(40t)、仪表空气(100立方米)、电(90kwh)、蒸汽(0.02t)、专用催化剂(0.2kg)、开车用氮气、开车用氢气。
主要设备有:汽化塔、过热器、转化炉、换热器、冷却器、水洗塔、循环液贮罐、甲醇中间罐、脱盐水中间罐、转化气缓冲罐、过滤器、吸附器、氢气缓冲罐、鼓风机、真空泵、进料泵、缓冲气囊、导热油加热炉。
一、氢气的物化性质••1.氢的存在••••氢是自然界分布最广的一种元素。
它在地球上主要以化合态存在于化合物中,如:水、石油、煤、天然气以及各种生物的组成中。
自然界中,水含有11%重量的氢,泥土中约含1.5%,100公里高空主要成分也是氢。
在地球表面大气中很低,约1PPM。
••2.氢气的物化性质••••1)物理参数:••••分子量:2.02;密度:0.08988克/升(0℃,1大气压);熔点:-259.19℃;沸点:-252.71℃;比热容=14.30焦/度•克;溶解度(毫升/100毫升水)=2.15(0℃),1.95(10℃),1.85(20℃),1.75(25℃),1.70(30℃),1.64(40℃),1.61(50℃),1.60(60℃);溶于乙醇:6.925毫升/100毫升。

甲醇制氢反应方程式及制取工艺流程
反应方程式
甲醇与水蒸气在一定的温度、压力条件下通过催化剂, 在催化剂的作用下, 发生甲醇裂解反应和一氧化碳的变换反应,生成氢和二氧化碳, 这是一个多组份、多反应的气固催化反应系统。
反应方程如下:
CH3OH→CO+2H2 (1)
H2O+CO→CO2+H2 (2)
CH3OH+H2O→CO2+3H2 (3)
重整反应生成的H2和CO2, 再经过变压吸附法(PSA)将H2和CO2分离,得到高纯氢气。
工艺流程
甲醇蒸汽重整是吸热反应,可以认为是甲醇分解和一氧化碳变换反应的综合结果。
甲醇蒸汽重整制氢工艺,经历了多次技术改进,已相当成熟。
甲醇蒸汽重整反应通常在250-300℃,1-5MPa,H2O与CH3OH摩尔比为1.0-5.0的条件下进行,重整产物气经过变压吸附等净化过程,可得不同规格的氢气产品。
甲醇蒸汽重整过程既可以使用等温反应系统,也可以使用绝热反应系统。
等温反应系统采用管式反应器,管壳中充满热载体进行换热,保持恒温反应。
在绝热反应系统中,蒸汽与甲醇混合物经过一系列绝热催化剂床层,床层之间配备换热器1。
反应产物净化系统可根据产品质量等级要求选择,变压吸附及膜分离技术是非常实用的气体净化技术。
变压吸附净化可获得纯度高于99.99%的氢气产品,依据所使用的不同吸附剂及工艺条件,氢回收率在70%-87%之间变化。
溶剂洗涤、CO催化转化、甲烷化等过程均可用于净化氢气。
甲醇重整制氢提纯技术解释说明以及概述1. 引言1.1 概述在能源短缺和环境问题日益突出的背景下,寻找清洁高效的能源替代品已成为当今社会的迫切需求。
氢气作为一种理想的清洁能源,具有高效、环保、可再生等特点,在能源领域具有广阔的应用前景。
甲醇重整制氢提纯技术是一种常用且有效的产氢方法,其可以将甲醇与水蒸汽在催化剂的作用下反应生成氢气,并使用一系列的分离与纯化步骤将产出的混合气体中杂质去除,得到高纯度的氢气。
1.2 文章结构本文将围绕甲醇重整制氢提纯技术展开详细介绍和解释。
首先,在第2部分中我们将对甲醇重整制氢提纯技术进行详细解释,包括甲醇重整概述、制氢过程以及氢气提纯方法。
接着,在第3部分中我们将概述该技术,从原理介绍、工艺流程到设备配置和要求进行全面说明。
随后,在第4部分中我们将探讨甲醇重整制氢提纯技术在工业应用场景下的实际运用情况,以及对环境的影响与管理措施。
最后,在第5部分中,我们将对本文进行总结,并展望该技术的未来发展前景。
1.3 目的本文旨在全面阐述甲醇重整制氢提纯技术,包括其技术原理、工艺流程、设备要求及配置等方面的内容。
同时,通过介绍其应用领域和发展前景,希望能够进一步推动该技术在能源领域的广泛应用,并为相关研究和实践提供参考和指导。
2. 甲醇重整制氢提纯技术解释:2.1 甲醇重整概述:甲醇重整是一种能够将甲醇转化为氢气的化学过程。
这个过程通常在高温和高压下进行,利用催化剂作用下的反应来转换甲醇分子结构并释放出氢气。
2.2 制氢过程:甲醇通过催化反应,首先在重整反应器中转化为一系列中间产物。
然后,在低温水煤气变换(LTS)反应器中,通过进一步催化转换,生成含有较高浓度氢气的混合物。
首先,在重整反应器中,甲醇与水蒸汽在高温(约250-350摄氏度)和压力条件下经过催化剂的作用发生反应。
这个过程被称为甲醇重整。
结果是产生了一系列有机物和少量一氧化碳(CO)、二氧化碳(CO2) 的混合物。
其次,在低温水煤气变换(LTS)反应器中,产生的混合物通过进一步的催化反应被清除了CO,并且部分CO2也会被还原。
甲醇重整制氢反应引言:甲醇重整制氢反应是一种重要的氢气生产方法,具有高效、环保、可持续等优点。
本文将介绍甲醇重整制氢反应的基本原理、反应机制、影响因素以及应用前景。
一、甲醇重整制氢的基本原理甲醇重整制氢是一种通过甲醇在高温下催化分解产生氢气的反应。
该反应是一个复杂的化学过程,主要包括甲醇脱氢、甲醇蒸汽重整和水气变换等步骤。
其中,甲醇脱氢是甲醇分子中的氢原子被脱除形成甲醛,而甲醇蒸汽重整则是通过甲醛和水蒸气在催化剂的作用下生成氢气和二氧化碳。
最后,水气变换反应将剩余的一氧化碳和水蒸气转化为二氧化碳和氢气。
二、甲醇重整制氢的反应机制甲醇重整制氢反应的机制主要涉及甲醇脱氢、甲醇蒸汽重整和水气变换三个步骤。
在甲醇脱氢过程中,甲醇分子中的氢原子被催化剂吸附,然后通过断裂甲醇分子和催化剂的键,形成甲醛和被脱氢的氢。
甲醛进一步参与甲醇蒸汽重整反应,通过与水蒸气反应生成氢气和二氧化碳。
最后,水气变换反应将剩余的一氧化碳和水蒸气转化为二氧化碳和氢气。
三、影响甲醇重整制氢反应的因素1. 温度:甲醇重整制氢反应需要在较高的温度下进行,一般在200-300摄氏度之间。
温度的提高可以提高反应速率,但过高的温度会导致催化剂失活。
2. 压力:反应压力对甲醇重整制氢反应的平衡和产氢速率有重要影响。
适当的压力可以提高产氢速率,但过高的压力会增加设备成本。
3. 催化剂选择:催化剂是甲醇重整制氢反应的关键,常用的催化剂包括镍基、铜基、铂基等。
不同催化剂具有不同的催化活性和选择性,选择合适的催化剂可以提高反应效率。
四、甲醇重整制氢的应用前景甲醇重整制氢是一种广泛应用于氢能源领域的方法。
由于甲醇是一种易得、易储、易运输的化合物,因此甲醇重整制氢成为大规模生产氢气的重要手段。
甲醇重整制氢还可以与燃料电池等技术相结合,用于汽车、船舶等领域的动力系统,实现清洁能源的利用。
结论:甲醇重整制氢反应是一种重要的氢气生产方法,具有高效、环保、可持续等优点。
工艺流程简述一、总述本装置采用的是甲醇水蒸汽转化制氢技术,通过变压吸附分离(PSA )的工艺方法生产纯氢,产品氢气的含量可达到99.99%。
流程主要分为甲醇蒸汽裂解转化和变压吸附分离两部分。
二、甲醇水蒸汽转化甲醇水蒸气转化过程分为配料、汽化、反应、脱酸、水冷以及水洗等过程组成,分述如下:1.配料甲醇经流量计输送到配料罐(V01)中层容器中(配料罐由上,中,下层三个不同的容器组成),去离子水经流量计输送到去离子水罐(V02)中,配料由来自配料罐(V01)上层容器的洗涤液(来自水洗塔)和纯甲醇在配料罐(V01)的中层容器中进行,为保证反应的顺利进行,配料罐中层容器的甲醇质量浓度必须保持在50%左右。
配好的甲醇溶液由配料罐(V01)中层容器自流进入配料罐(V01)的下层容器中(使甲醇与去离子水能混合均匀)。
2.汽化原料液由配料罐(V01)下层容器经隔膜计量泵(P01)加压至约 1.1MPa(g)输送到螺旋板式换热器(E02)用脱酸反应器(R02)出口气体热量对其预热。
预热后的原料进入螺旋板式汽化器(E01)汽化成反应所需的原料气体(质量浓度为50%的甲醇-水蒸汽)。
汽化所需的热量由1.0MPa(g)的饱和蒸汽提供。
3.反应由汽化器(E01)汽化产生的原料气体进入反应器(R01),反应器中填装有双功能催化剂,甲醇-水蒸汽通过催化剂在约230℃-280℃下一次完成裂解和转化二个反应,生成氢气和二氧化碳。
反应方程式如下:()()2/5.431/8.90222223mol KJ H CO O H CO mol KJ H CO OH CH ++→+-+→ 总的反应式为:mol KJ H CO O H OH CH /3.4732223-+→+整个反应过程是吸热的。
反应器(R01)催化裂解所需的热量由导热油提供。
4.脱酸及水冷从反应器(R01)出来的反应产物进入脱酸罐(R02)。
脱酸罐中的填料可脱除裂解气中的腐蚀性物质(主要为甲酸)。
甲醇制氢工艺简介1前言氢气在工业上有着广泛的用途。
近年来,由于精细化工、蒽醌法制双氧水、粉末冶金、油脂加氢、林业品和农业品加氢、生物工程、石油炼制加氢及氢燃料清洁汽车等的迅速发展,对纯氢需求量急速增加。
对没有方便氢源的地区,如果采用传统的以石油类、天然气或煤为原料造气来分离制氢需庞大投资,“相当于半个合成氨”,只适用于大规模用户。
对中小用户电解水可方便制得氢气,但能耗很大,每立方米氢气耗电达~6度,且氢纯度不理想,杂质多,同时规模也受到限制,因此近年来许多原用电解水制氢的厂家纷纷进行技术改造,改用甲醇蒸汽转化制氢新的工艺路线。
西南化工研究设计院研究开发的甲醇蒸汽转化配变压吸附分离制氢技术为中小用户提供了一条经济实用的新工艺路线。
第一套600Nm3/h制氢装置于1993年7月在广州金珠江化学有限公司首先投产开车,在得到纯度99.99%氢气同时还得到食品级二氧化碳,该技术属国内首创,取得良好的经济效益。
此项目于93年获得化工部优秀设计二等奖、94年获广东省科技进步二等奖。
2工艺原理及其特点本工艺以来源方便的甲醇和脱盐水为原料,在220~280℃下,专用催化剂上催化转化为组成为主要含氢和二氧化碳转化气,其原理如下:主反应: CH3OH=CO+2H2 +90.7 KJ/molCO+H2O=CO2+H2 -41.2 KJ/mol总反应: CH3OH+H2O=CO2+3H2 +49.5 KJ/mol副反应: 2CH3OH=CH3OCH3+H2O -24.9 KJ/molCO+3H2=CH4+H2O -+206.3KJ/mol上述反应生成的转化气经冷却、冷凝后其组成为H2 73~74%CO2 23~24.5%CO ~1.0%CH3OH 300ppmH2O 饱和该转化气很容易用变压吸附等技术分离提取纯氢。
广州金珠江化学有限公司600Nm3/h制氢装置自93年7月投产后,因后续用户双氧水的扩产,于97年4月扩产1000Nm3/h制氢装置投产,后又扩产至1800Nm3/h,于2000年3月投产。
分布式甲醇制氢工艺流程
首先,蒸汽重整法是一种常用的甲醇制氢工艺流程。
在这个过程中,甲醇和蒸汽在催化剂的作用下发生重整反应,生成氢气和二氧化碳。
这种工艺流程具有操作简单、能耗低的特点,因此在工业生产中得到广泛应用。
其次,部分氧化法是另一种常见的甲醇制氢工艺流程。
这种方法是将甲醇与氧气在催化剂的作用下部分氧化,生成氢气和一氧化碳。
部分氧化法具有反应速度快、产氢效率高的优点,但同时也会生成一氧化碳等有害气体,需要进行后续的净化处理。
此外,自热重整法也是甲醇制氢的一种工艺流程。
这种方法是利用甲醇自身的热量进行重整反应,生成氢气和二氧化碳。
自热重整法具有能耗低、操作简单的特点,但对催化剂的选择和反应条件的控制要求较高。
总的来说,分布式甲醇制氢工艺流程可以根据生产规模、原料成本、能源消耗等因素选择不同的方法。
在实际应用中,需要综合考虑工艺流程的经济性、环保性以及可操作性,以实现最佳的甲醇制氢效果。
前言氢气是一种重要的工业产品,它广泛用于石油、化工、建材、冶金、电子、医药、电力、轻工、气象、交通等工业部门和服务部门,由于使用要求的不同,这些部门对氢气的纯度、对所含杂质的种类和含量都有不相同的要求,特别是改革开放以来,随着工业化的进程,大量高精产品的投产,对高纯度的需求量正逐步加大,等等对制氢工艺和装置的效率、经济性、灵活性、安全都提出了更高的要求,同时也促进了新型工艺、高效率装置的开发和投产。
依据原料及工艺路线的不同,目前氢气主要由以下几种方法获得:①电解水法;②氯碱工业中电解食盐水副产氢气;③烃类水蒸气转化法;④烃类部分氧化法;⑤煤气化和煤水蒸气转化法;⑥氨或甲醇催化裂解法;⑦石油炼制与石油化工过程中的各种副产氢;等等。
其中烃类水蒸气转化法是世界上应用最普遍的方法,但该方法适用于化肥及石油化工工业上大规模用氢的场合,工艺路线复杂,流程长,投资大。
随着精细化工的行业的发展,当其氢气用量在200~3000m3/h时,甲醇蒸气转化制氢技术表现出很好的技术经济指标,受到许多国家的重视。
甲醇蒸气转化制氢具有以下特点:(1)与大规模的天然气、轻油蒸气转化制氢或水煤气制氢相比,投资省,能耗低。
(2)与电解水制氢相比,单位氢气成本较低。
(3)所用原料甲醇易得,运输、贮存方便。
(4)可以做成组装式或可移动式的装置,操作方便,搬运灵活。
对于中小规模的用氢场合,在没有工业含氢尾气的情况下,甲醇蒸气转化及变压吸附的制氢路线是一较好的选择。
本设计采用甲醇裂解+吸收法脱二氧化碳+变压吸附工艺,增加吸收法的目的是为了提高氢气的回收率,同时在需要二氧化碳时,也可以方便的得到高纯度的二氧化碳。
目录1.设计任务书 (3)2.甲醇制氢工艺设计 (4)2.1 甲醇制氢工艺流程 (4)2.2 物料衡算 (4)2.3 热量衡算 (6)3.反应器设计 (9)3.1 工艺计算 (9)3.2 结构设计 (13)4.管道设计………………………………………....…5.自控设计………………………………………....…6.技术经济评价、环境评价………………………7.结束语………………………………………....……8.致谢………………………………………....………9.参考文献………………………………………....…附录:1.反应器装配图,零件图2.管道平面布置图3.设备平面布置图4.管道仪表流程图5.管道空视图6.单参数控制方案图1、设计任务书2、甲醇制氢工艺设计2.1 甲醇制氢工艺流程甲醇制氢的物料流程如图1-2。
流程包括以下步骤:甲醇与水按配比1:1.5进入原料液储罐,通过计算泵进入换热器(E0101)预热,然后在汽化塔(T0101)汽化,在经过换热器(E0102)过热到反应温度进入转化器(R0101),转化反应生成H2、CO2的以及未反应的甲醇和水蒸气等首先与原料液换热(E0101)冷却,然后经水冷器(E0103)冷凝分离水和甲醇,这部分水和甲醇可以进入原料液储罐,水冷分离后的气体进入吸收塔,经碳酸丙烯脂吸收分离CO2,吸收饱和的吸收液进入解析塔降压解析后循环使用,最后进入PSA装置进一步脱除分离残余的CO2、CO及其它杂质,得到一定纯度要求的氢气。
图1-2 甲醇制氢的物料流程图及各节点物料量2.2 物料衡算1、依据甲醇蒸气转化反应方程式:CH3OH→CO↑+2H2↑ (1-1)CO+H2O→CO2↑+ H2↑ (1-2)CH3OH分解为CO转化率99%,反.应温度280℃,反应压力1.5MPa,醇水投料比1:1.5(mol).2、投料计算量代入转化率数据,式(1-3)和式(1-4)变为:CH3OH→0.99CO↑+1.98H2↑+0.01 CH3OHCO+0.99H 2O→0.99CO 2↑+ 1.99H 2+0.01CO 合并式(1-5),式(1-6)得到:CH 3OH+0.9801 H 2O→0.9801 CO 2↑+2.9601 H 2↑+0.01 CH 3OH+0.0099 CO↑ 氢气产量为: 1600m 3/h=71.429 kmol/h甲醇投料量为: 71.429/2.9601ⅹ32=772.179kg/h水投料量为: 71.429/2.9601ⅹ1.5ⅹ18=651.526 kg/h 3、原料液储槽(V0101)进: 甲醇 772.179 kg/h , 水 651.526 kg/h 出: 甲醇 772.179 kg/h , 水 651.526 kg/h4、换热器 (E0101),汽化塔(T0101),过热器(E0103) 没有物流变化.5、转化器 (R0101)进 : 甲醇 772.179 kg/h , 水651.526kg/h , 总计1423.705kg/h 出 : 生成 CO 2 772.179/32ⅹ0.9801ⅹ44 =1040.617kg/h H 2 772.179/32ⅹ2.9601ⅹ2 =142.858 kg/h CO 772.179/32ⅹ0.0099ⅹ28 =6.689 kg/h 剩余甲醇 772.179/32ⅹ0.01ⅹ32 =7.722kg/h 剩余水 651.526-772.179/32ⅹ0.9801ⅹ18=225.819 kg/h 总计 1423.705kg/h 6、吸收塔和解析塔吸收塔的总压为1.5MPa ,其中CO 2的分压为0.38 MPa ,操作温度为常温(25℃). 此时,每m 3吸收液可溶解CO 211.77 m 3.此数据可以在一般化工基础数据手册中找到,二氯 化碳在碳酸丙烯酯中的溶解度数据见表1一l 及表1—2。
解吸塔操作压力为0.1MPa , CO 2溶解度为2.32,则此时吸收塔的吸收能力为: 11.77-2.32=9.450.4MPa 压力下 2co ρ=p M/RT=0.4⨯44/[0.0082⨯(273.15+25)]=7.20kg/ m 3CO 2体积量 V 2CO =1040.617/7.20=144.530 m 3/h 据此,所需吸收液量为 144.530/9.45= 15.294m 3/h考虑吸收塔效率以及操作弹性需要,取吸收量为 15.294 m 3/h 3⨯=45.883 m 3/h 可知系统压力降至0.1MPa 时,析出CO 2量为144.530 m 3/h=1040.617 kg/h.混合气体中的其他组分如氢气,CO 以及微量甲醇等也可以按上述过程进行计算,在此,忽略这些组分在吸收液内的吸收.7、PSA系统略.8、各节点的物料量综合上面的工艺物料衡算结果,给出物料流程图及各节点的物料量,见图1一2.3.3 热量衡算1、汽化塔顶温确定在已知汽相组成和总压的条件下,可以根据汽液平衡关系确定汽化塔的操作温度·甲醇和水的蒸气压数据可以从一些化工基础数据手册中得到:表1-3列出了甲醇的蒸气压数据·水的物性数据在很多手册中都可以得到,这里从略。
在本工艺过程中,要使甲醇水完全汽化,则其汽相分率必然是甲醇40%,水60%(mol)且已知操作压力为1.5MPa,设温度为T,根据汽液平衡关系有0.4p甲醇+0.6p水=1.5MPa初设T=170℃p甲醇=2.19MPa; p水=0.824 MPap总=1.3704<1.5 MPa再设T=175℃p甲醇=2.4MPa; p水=0.93 MPap总=1.51 MPa蒸气压与总压基本一致,可以认为操作压力为1.5MPa时,汽化塔塔顶温度为175℃. 2、转换器(R0101)两步反应的总反应热为49.66kJ/mol,于是,在转化器内需要供给热量为:Q反应=772.179⨯0.99/32⨯1000⨯(-49.66)=-1.19⨯106 kJ/h此热量由导热油系统带来,反应温度为280℃,可以选用导热油温度为320℃,导热油温度降设定为5℃,从手册中查到导热油的物性参数,如比定压热容与温度的关系,可得:cæ320p =4.1868⨯0.68=2.85kJ/(kg·K), cæ300p=2.81kJ/(kg·K)取平均值 cp=2.83 kJ/(kg·K)则导热油用量 w=Q反应/(cp∆t)=1.19⨯610/(2.83⨯5)=84099 kg/h3、过热器(E0102)甲醇和水的饱和蒸气在过热器中175℃过热到280℃,此热量由导热油供给.从手册中可以方便地得到甲醇和水蒸气的部分比定压热容数据,见表1-4.气体升温所需热量为:Q=∑ c p m∆t=(1.90⨯579.126+4.82⨯488.638) ⨯(280-175)=3.63⨯105kJ/h导热油c p =2.826 kJ/(kg ·K), 于是其温降为:∆t=Q/(c P m)= 3.63⨯105/(2.826⨯62898)=2.04℃ 导热油出口温度为: 315-2.0=313.0℃ 4、汽化塔(TO101 )认为汽化塔仅有潜热变化。
175 ℃ 甲醇H = 727.2kJ/kg 水 H = 203IkJ/kg Q=772.1779⨯727.2+2031⨯651.526=1.88⨯106 kJ/h以300℃导热油c p 计算 c p =2.76 kJ/(kg ·K)∆t=Q/(c P m)=1.88⨯106/(2.76⨯83840)=8.12℃则导热油出口温度 t 2=313.0-8.1=304.9℃导热油系统温差为∆T=320-304.9=15.1℃ 基本合适. 5、换热器(EO101)壳程:甲醇和水液体混合物由常温(25 ℃ )升至175 ℃ ,其比热容数据也可以从手册中得到,表1 一5 列出了甲醇和水液体的部分比定压热容数据。
液体混合物升温所需热量Q=∑ c p m ∆t=(579.126⨯3.14+488.638⨯4.30) ⨯(175-25)=5.88⨯105kJ/h管程:没有相变化,同时一般气体在一定的温度范围内,热容变化不大,以恒定值计算,这里取各种气体的比定压热容为: c 2pco ≈10.47 kJ/(kg ·K) c 2pH ≈14.65 kJ/(kg ·K) c pco ≈4.19 kJ/(kg ·K)则管程中反应后气体混合物的温度变化为:∆t=Q/(c P m)=7.84⨯105/(10.47⨯1040.617+14.65⨯142.858+4.19⨯225.819)=56.3℃换热器出口温度为 280-56.3=223.7℃ 6、冷凝器(EO103)在E0103 中包含两方面的变化:①CO 2, CO, H 2的冷却以及②CH 3OH , H 2O 的冷却和冷凝.① CO 2, CO, H 2的冷却 Q=∑cpm ∆t=(10.47⨯1040.617+14.65⨯142.858+1.04⨯ 6.689)⨯(223.7-40)=2.39⨯106kJ/h②CH3OH的量很小,在此其冷凝和冷却忽略不计。