德宏州梁河高中化学第二章烃和卤代烃2.1.1烷烃学案新人教版选修5
- 格式:doc
- 大小:46.50 KB
- 文档页数:2
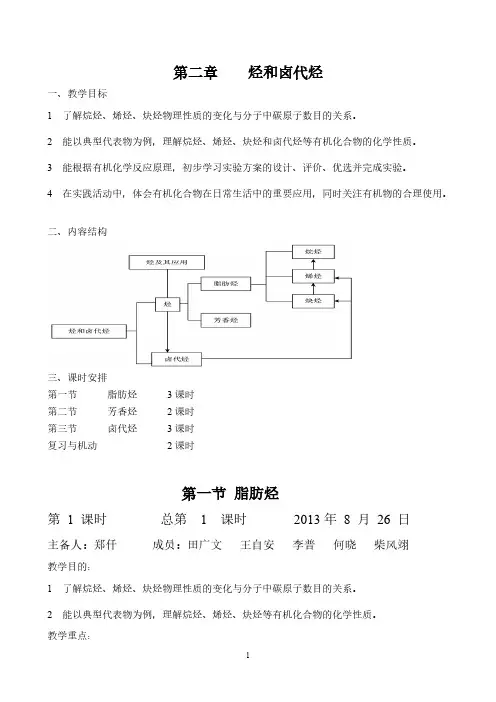

卤代烃一、教学目标【知识与技能】1、掌握溴乙烷的主要化学性质,理解在NaOH水溶液中发生的取代反应和在NaOH醇溶液中发生的消去反应。
2、了解卤代烃的一般通性和用途,并通过对有关卤代烃数据的分析、讨论,培养学生的分析、综合能力。
3、对氟利昂对环境的不良作用有一个大致的印象,增强环境保护意识。
【过程与方法】注意“结构决定性质”的思想,即卤代烃中的官能团——卤素原子(—X)决定了卤代烃的化学性质。
【情感、态度与价值观】分析有关卤代烃所发生化学反应的反应类型和反应规律,培养学生的逻辑思维能力和进行科学探究的能力。
二、教学重点溴乙烷的结构特点和主要化学性质三、教学难点溴乙烷发生取代反应和消去反应的基本规律四、课时安排1课时五、教学过程【引入】师:在高一我们就已经接触了1,2—二溴乙烷、氯乙烯、溴苯,它们属于烃的衍生物中的一类。
像这些在结构上可以看作是烃分子中的氢原子被卤素原子取代后生成的化合物,称为卤代烃。
下面我们先来学习卤代烃的代表物——溴乙烷。
【板书】第三节卤代烃一、溴乙烷1、溴乙烷的分子结构分子式:C2H5Br 结构简式:C2H5Br或者CH3CH2Br (官能团:—Br)师:从结构上看,溴乙烷可以看成是乙烷分子中的一个氢原子被溴原子取代后的产物,但由于官能团是(—Br),所以它的性质与乙烷有很大的差别。
【板书】2、物理性质溴乙烷是无色液体,沸点38.4ºC,密度比水大,难溶于水,易溶于有机溶剂。
师:从溴乙烷的核磁共振氢谱图中可以看到有两个吸收峰,可见只有其分子中只含两种不同的氢原子。
接下来我们重点学习溴乙烷的化学性质。
【板书】3、化学性质(1)溴乙烷的水解反应水CH 3CH 2—Br + NaOH →CH 3CH 2—OH + NaBr【讲解】 强调溴乙烷的水解反应的条件:碱性条件下水解。
【提问】1、乙烯与溴发生加成反应生成1,2—二溴乙烷;乙烯如何加成反应生成溴乙烷?2、溴乙烷能否生成乙烯?3、溴乙烷中的化学键如何断裂才能生成乙烯?(引导学生根据溴乙烷的结构分析、思考溴乙烷化学键可能的断裂方式。



第二章烃和卤代烃第一节脂肪烃第二课时烯烃【学习目标】知道烯烃的物理性质的变化与分子中碳原子数目的关系;能以典型代表物为例,理解烯烃的化学性质;认识烯烃的特征结构。
【知识回顾】1.有机物中碳原子的成键特征(1)碳原子的最外层有4个电子,可与其他原子形成______个共价键,而且碳碳原子之间也能相互形成______键;(2)碳原子不仅可以形成______键,还可以形成______键或______键;(3)多个碳原子可以相互结合形成碳链,也可以形成碳_____,碳链或碳环上还可以连有支链。
2.乙烯的分子式是______,结构式是_______,电子式_________,空间构型是__________ 3.烯烃的通式:写出几种常见的烯烃:烯烃燃烧的通式:4.回顾烯烃的系统命名原则_______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ 5.烷烃的同分异构体:请写出丁烯、戊烯的同分异构体同分异构体书写及数目巧确定(1)记忆法:记住常见有机物的同分异构体数。
例如:甲烷、乙烷、丙烷均无同分异构体,丁烷有2种,戊烷有3种。
(2)替代法:例如:二氯苯C6H4Cl2的同分异构体有3种,四氯苯的同分异构体也有3种。
(3)等效氢法:判断有机物发生取代反应后,能形成几种同分异构体的规律,可通过分析有几种等效氢原子来得出结论,又称为对称法。

选修5《第二章 绘和卤代桂》全章教案课题:第二章第一节脂肪炷第二章炷和卤代姪第一节脂肪烧 一、烷® (alkane)和烯® (alkene)1、 结构特点和通式:(1) 烷炷:仅含C —C 键和C —H 键的饱和链炷,又叫烷炷。
(若C —C 连成 环状,称为环烷炷。
)通式:CnH 2n+2 (n^l)(2) 烯炷:分子里含有一个碳碳双键的不饱和链绘叫做烯炷。
(分子里含有 两个双键的链炷叫做二烯炷) 通式:C n H 2n (nM2)2、 物理性质(1) 物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高, 相对密度逐渐增大;(2) 碳原子数相同时,支链越多,熔沸点越低。
⑶ 常温下的存在状态,也由气态(nW4)逐渐过渡到液态(5WnW16)、固 态(17Wn)。
(4)炷的密度比水小,不溶于水,易溶于有机溶剂。
重 点 难 点烯烧的顺反异构知 识 结 构 与 板 书 设 计教学 目的烯怪的结构特点和化啓性质3、基本反应类型(1)取代反应(substitution reaction):有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。
如炷的卤代反应。
(2)加成反应(addition reaction):有机物分子中双键(参键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。
如不饱和碳原子与也、X2>也0的加成。
(3)聚合反应(polymerization reaction):由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。
如加聚反应、缩聚反应。
4、烷坯化学性质(与甲烷相似)烷绘不能使酸性高猛酸钾溶液和漠水褪色(1)取代反应:CH3CH3+ Cl2—— CH3CH2CI + HC1(2)氧化反应:CJk+2 + 3jl±1- 02 3- nC02 +(n+l)H205、烯炷的化学性质(与乙鬲似)(1)加成反应3n(2)氧化反应① 燃烧:CJL+才。

本套资源目录2019高中化学第二章第一节第一课时烷烃和烯烃教案新人教版选修52019高中化学第二章第一节第二课时炔烃脂肪烃的来源及其应用教案新人教版选修52019高中化学第二章第三节卤代烃教案新人教版选修52019高中化学第二章第二节芳香烃教案新人教版选修5第一课时烷烃和烯烃[课标要求]1.了解烷烃和烯烃物理性质与碳原子数目的关系。
2.了解烷烃和烯烃的结构特征及烯烃的顺反异构。
3.以甲烷、乙烯为例,掌握烷烃、烯烃的化学性质。
1.烷烃的分子通式为C n H2n+2,烯烃的分子通式为C n H2n。
2.烷烃易发生取代、氧化反应,而烯烃易发生加成、加聚和氧化反应。
3.烷烃、烯烃随分子中碳原子数目的增多,密度增大,熔、沸点升高。
4.丙烯使溴水褪色、发生加聚反应的化学方程式为烷烃的结构与性质1.结构特点烷烃分子中碳原子之间以C—C单键结合成链状,碳原子剩余的价键全部跟氢原子结合达到饱和。
2.通式:C n H2n+2(n≥1)。
3.物理性质物理性质 变化规律状态 当碳原子数小于或等于4时,烷烃在常温下呈气态,其他的烷烃常温下呈固态或液态(新戊烷常温下为气态)溶解性 都不溶于水,易溶于有机溶剂沸点 随分子中碳原子数的增加,沸点逐渐升高。
碳原子数相同的烃,支链越多,沸点越低相对密度随分子中碳原子数的增加,相对密度逐渐增大。
烷烃的密度小于水的密度4.化学性质 (1)稳定性常温下烷烃很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件下(如光照或高温)才能发生某些反应。
(2)特征反应——取代反应烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如乙烷与氯气反应生成一氯乙烷,化学方程式为 CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
(3)氧化反应——可燃性烷烃可在空气或氧气中燃烧生成CO 2和H 2O ,燃烧的通式为 C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
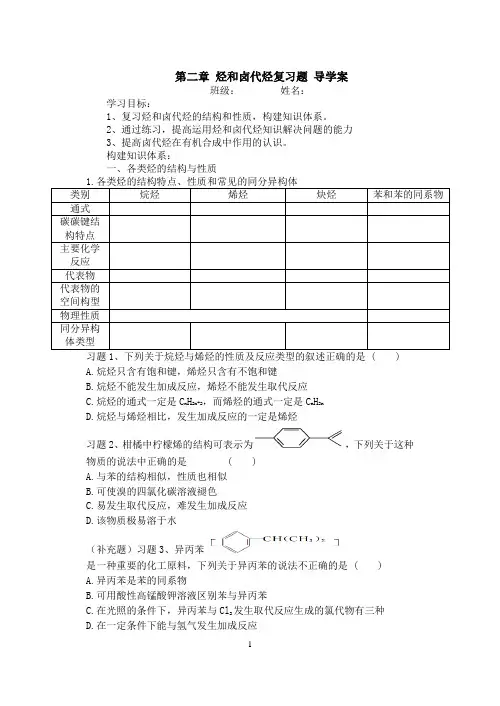
第二章烃和卤代烃复习题导学案班级:姓名:学习目标:1、复习烃和卤代烃的结构和性质,构建知识体系。
2、通过练习,提高运用烃和卤代烃知识解决问题的能力3、提高卤代烃在有机合成中作用的认识。
构建知识体系:一、各类烃的结构与性质A.烷烃只含有饱和键,烯烃只含有不饱和键B.烷烃不能发生加成反应,烯烃不能发生取代反应C.烷烃的通式一定是C n H2n+2,而烯烃的通式一定是C n H2nD.烷烃与烯烃相比,发生加成反应的一定是烯烃习题2、柑橘中柠檬烯的结构可表示为,下列关于这种物质的说法中正确的是( )A.与苯的结构相似,性质也相似B.可使溴的四氯化碳溶液褪色C.易发生取代反应,难发生加成反应D.该物质极易溶于水(补充题)习题3、异丙苯是一种重要的化工原料,下列关于异丙苯的说法不正确的是 ( )A.异丙苯是苯的同系物B.可用酸性高锰酸钾溶液区别苯与异丙苯C.在光照的条件下,异丙苯与Cl2发生取代反应生成的氯代物有三种D.在一定条件下能与氢气发生加成反应的分别是(1)不能与溴水或酸性KMnO4溶液反应,但在FeBr3作用下能与液溴反应的是____________,生成的有机物名称是______________________________,反应的化学方程式为_____________________________________。
此反应属于__________反应。
(2)与溴水或酸性KMnO4溶液都不反应的是______。
(3)能与溴水和酸性KMnO4溶液反应的是________。
(4)不与溴水反应但与酸性KMnO4溶液反应的是_________________。
(补充题)习题5、下列物质中因化学反应既能使溴水褪色又能使酸性KMnO4溶液褪色的是()A、聚丙烯 B.C、CH3C≡CHD.的是( )习题7、在实验室里鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加入MnO2固体;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用稀硝酸酸化。



高中化学第二章烃和卤代烃章末复习教案新人教版选修5编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学第二章烃和卤代烃章末复习教案新人教版选修5)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学第二章烃和卤代烃章末复习教案新人教版选修5的全部内容。
烃和卤代烃。
2.物理性质与存在(1)物理性质:通常是无色无味、难溶于水的气体,标况下密度为0。
717g/L。
(2)自然存在:天然气、坑气、沼气3.化学性质常温下甲烷的化学性质很稳定,与强酸、强碱和强氧化剂不反应,不能使酸性高锰酸钾、溴水褪色;在一定条件下,能与某些物质反应。
(1)取代反应:反应现象:容器内黄绿色变浅;容器内壁有无色油状物生成。
定量分析:取代1 mol氢原子,消耗1mol氯分子。
(2)燃烧反应:反应现象:淡蓝色火焰;无烟。
元素转化:碳的转化,C→CO2或C→CO;氢的转化,2H→H2O.二、乙烯1.分子组成与结构(1)分子组成:分子式为C2H4;乙烯是组成最简单的烯烃,碳的质量分数为6/7,氢的质量分数为1/7.(2)分子结构:平面构型,键角120°;结构简式为CH2=CH2,结构式为。
2.物理性质通常无色稍有气味、难溶于水,标况下密度为1。
25 g/L,比空气略轻。
3。
化学性质(1)加成反应(2)氧化反应①燃烧:燃烧现象:明亮火焰;黑烟。
②氧化:被酸性高锰酸钾溶液氧化。
反应现象:酸性高锰酸钾溶液褪色。
(3)加聚反应:生成高分子化合物三、乙炔1.分子组成与结构(1)分子组成:分子式为C2H2;乙炔是组成最简单的炔烃,碳的质量分数为12/13,氢的质量分数为1/13。
第二章烃和卤代烃第一节脂肪烃
第一课时烷烃
【学习目标】知道烷烃的物理性质的变化与分子中碳原子数目的关系;
能以典型代表物为例,理解烷烃的化学性质;认识烷烃的特征结构。
【知识回顾】
1.甲烷的分子式是______,结构式是_______,电子式_________,空间构型是__________ 2.烷烃的通式:
写出几种烷烃:
同系物的定义:
下列说法不正确的是( )
A.分子式为CH4和C5H12的两种烃互为同系物
B.分子式为C2H4和C3H6的两种烃一定互为同系物
C.等碳烷烃和炔烃,在分子组成上,相差4个氢原子
D.若C2H2和C4H6互为同系物,则C4H6分子中一定含有一个三键
注意:判断两种有机物互为同系物的关键:一看是否是同类物质;二看是否结构相似;三看是否至少相差一个CH2原子团。
3.回顾烷烃的系统命名原则
_______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ 4.烷烃的同分异构体:请写出戊烷、己烷的同分异构体
【问题与例题】
【问题1】烷烃的物理性质(参考并完成创新设计18页的内容)
注意:直链烷烃是锯齿形结构;液态的烃也是良好的有机溶剂。
【问题2】烷烃的化学性质(参考并完成创新设计18页的内容)
【例题】下列有关烷烃的叙述中,正确的是( )
A.在烷烃分子中,所有的化学键都是碳碳单键
B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
C.分子通式为C n H2n+2的烃不一定是烷烃
D.所有的烷烃在光照条件下都能与氯气发生取代反应
【目标检测】
1.下列说法不正确的是( )
A.分子式为C3H8与C6H14的两种有机物一定互为同系物
B.具有相同通式的有机物不一定互为同系物
C.两个相邻同系物的相对分子质量数值一定相差14
D.分子组成相差一个或几个CH2原子团的化合物必定互为同系物
2.已知烷烃A的密度是相同条件下H2密度的36倍。
(1)该烷烃A的分子式为____________________________________________________。
(2)写出A可能存在的结构简式:____________________________________________ ________________________________________________________________________。
(3)若A的某种同分异构体B的一氯代物只有一种。
①用系统命名法命名,B的名称为__________________________________________。
②B与Cl2发生反应生成一氯代物的化学方程式为____________________________
________________________________________________________________________。
③B燃烧的化学方程式为_________________________________________________。
3.完成创新设计20页“随堂达标检测”
【课后作业】请完成分层训练85页86页相关练习。