CE-SDS蛋白异构化分析
- 格式:docx
- 大小:58.76 KB
- 文档页数:2

附录XX 单抗纯度测定方法-CE-SDS毛细管电泳(还原和非还原)本法系采用十二烷基硫酸钠毛细管电泳(CE-SDS)紫外检测方法,在还原和非还原条件下,依据分子量大小,定量测定重组单抗产品的纯度。
参照毛细管电泳法(附录V G)测定。
1. 毛细管电泳系统(1)检测器:紫外检测器,波长:214 nm。
(2)毛细管:非涂层-熔融石英毛细管(内径50μm),切割至总长为31 cm、有效长度为21 cm。
(3)孔塞大小: 8 (100×800 μm)2. 试剂(1)SDS样品缓冲液:含1% SDS的0.1M Tris-HCl溶液, pH 9.0。
(2)SDS 凝胶分离缓冲液:含0.2% SDS的缓冲液(pH8.0),含有适当的亲水性聚合物作为分子筛。
(3)0.1 N盐酸溶液(4)0.1 N氢氧化钠溶液(5)纯的2-巯基乙醇(6)烷基化溶液:0.8 M的碘乙酰胺水溶液, 如称取约74 mg 碘乙酰胺,加入500µL超纯水溶解,新鲜制备,避免光照。
(7)参比品溶液:终浓度1 mg/mL。
3. 供试品处理:(1)供试品溶液制备:用SDS样品缓冲液将供试品稀释至1mg/mL。
样品缓冲液以相同稀释倍数稀释,为空白对照。
(2)非还原供试品溶液制备:取供试品溶液(1mg/ml)95µL,加入0.8 M 碘乙酰胺水溶液5 µL ,涡旋混匀。
取空白对照95µL,加入0.8 M碘乙酰胺水溶液5 µL,涡旋混匀,为非还原空白对照。
(3)还原供试品溶液制备:取供试品溶液(1mg/ml)95µL,加入2-巯基乙醇溶液5 µL ,涡旋混匀。
取空白试剂95µL,加入2-巯基乙醇溶液5 µL ,涡旋混匀,为还原空白对照。
将供试品溶液和空白对照在68︒C -7 2︒C孵育,非还原供试品溶液孵育5min,还原供试品溶液孵育15min 。
冷却到室温后6,000 转/分离心1分钟。

CE-SDS(Capillary Electrophoresis Sodium Dodecyl Sulfate)是一种基于毛细管电泳技术的蛋白质分析方法,通常用于测定蛋白质的大小、形状和电荷异质性。
在CE-SDS中,硫醚键(Sulfide Bonds或Sulfur Bridges)并不直接参与该分析过程。
硫醚键通常出现在蛋白质的二级结构中,特别是二硫键(Disulfide Bonds)。
二硫键是由两个半胱氨酸残基(Cysteine residues)通过其硫原子(Sulfur atoms)形成的共价键。
这些二硫键对蛋白质的三维结构和稳定性起着重要作用。
在进行CE-SDS分析时,为了使蛋白质解离并展开成线性形式,通常会使用还原剂(如DTT或β-巯基乙醇)来断裂二硫键,从而破坏蛋白质的天然三级和四级结构。
这样可以得到基于蛋白质亚基大小的电泳谱图。
因此,在CE-SDS中,虽然不直接测量硫醚键,但还原步骤是处理含有二硫键的蛋白质样品的重要环节,它影响着最终的分析结果。
通过比较还原前后蛋白质的电泳行为,可以间接了解样品中二硫键的存在和影响。

颁发部门:质量保证部分发部门:分析研究部拷贝号:NO. /目录1目的 (4)2范围 (4)3定义 (4)4环境、健康和安全 (4)5培训 (4)6职责 (4)7程序(内容) (4)7.1原理 (4)7.2实验材料 (4)7.3操作步骤 (5)7.4结果分析 (9)7.5判定标准 (9)7.6注意事项 (9)8相关文件 (10)9参考文献 (10)10流程图 (10)11附录 (10)十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)测定记录 (1)十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)测定记录(适用于多个样品) (1)1目的规范十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)检验的操作过程。
2范围本规程适用于常规十二烷基硫酸钠毛细管凝胶电泳检验,涉及到蛋白质纯度相关指标的测定。
3定义3.1CE-SDS:十二烷基硫酸钠毛细管凝胶电泳。
4环境、健康和安全还原电泳中使用的巯基乙醇为挥发性液体,具有较强烈的刺激性气味,会刺激眼睛、呼吸系统和皮肤,吞食有害,与皮肤接触有毒,取液时穿戴适当的防护服、手套和护目镜或面具。
如不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
该液体对水体环境能产生长期污染等不良影响,切勿倒入下水道,应倒入废液桶,由专业部门回收。
与空气混合、受热、明火可爆,如其燃烧可用二氧化碳、干粉类灭火剂。
储存库房应通风低温干燥,与氧化剂、食品分开储运。
5培训5.1培训部门:分析研究部。
5.2培训对象:分析研究部相关人员。
5.3培训方式和时数:自学,0.5小时。
5.4考核方式:问答。
6职责6.1质量保证部:负责监督本文件的执行。
6.2分析研究部:负责严格执行本规程规定。
7程序(内容)7.1原理该方法是指以弹性石英毛细管为分离管道,以高压直流电场为驱动力,通过目标蛋白在含有胶的溶液中的迁移速率不同而得到分离,较小分子量的分子迁移速度更快则其迁移时间短,较大分子的迁移速度慢则其迁移时间更长。

附录XX 单抗纯度测定方法-CE-SDS毛细管电泳(还原和非还原)本法系采用十二烷基硫酸钠毛细管电泳(CE-SDS)紫外检测方法,在还原和非还原条件下,依据分子量大小,定量测定重组单抗产品的纯度。
参照毛细管电泳法(附录V G)测定。
1. 毛细管电泳系统(1)检测器:紫外检测器,波长:214 nm。
(2)毛细管:非涂层-熔融石英毛细管(内径50μm),切割至总长为31 cm、有效长度为21 cm。
(3)孔塞大小: 8 (100×800 μm)2. 试剂(1)SDS样品缓冲液:含1% SDS的0.1M Tris-HCl溶液, pH 9.0。
(2)SDS 凝胶分离缓冲液:含0.2% SDS的缓冲液(pH8.0),含有适当的亲水性聚合物作为分子筛。
(3)0.1 N盐酸溶液(4)0.1 N氢氧化钠溶液(5)纯的2-巯基乙醇(6)烷基化溶液:0.8 M的碘乙酰胺水溶液, 如称取约74 mg 碘乙酰胺,加入500µL超纯水溶解,新鲜制备,避免光照。
(7)参比品溶液:终浓度1 mg/mL。
3. 供试品处理:(1)供试品溶液制备:用SDS样品缓冲液将供试品稀释至1mg/mL。
样品缓冲液以相同稀释倍数稀释,为空白对照。
(2)非还原供试品溶液制备:取供试品溶液(1mg/ml)95µL,加入0.8 M 碘乙酰胺水溶液5 µL ,涡旋混匀。
取空白对照95µL,加入0.8 M碘乙酰胺水溶液5 µL,涡旋混匀,为非还原空白对照。
(3)还原供试品溶液制备:取供试品溶液(1mg/ml)95µL,加入2-巯基乙醇溶液5 µL ,涡旋混匀。
取空白试剂95µL,加入2-巯基乙醇溶液5 µL ,涡旋混匀,为还原空白对照。
将供试品溶液和空白对照在68︒C -7 2︒C孵育,非还原供试品溶液孵育5min,还原供试品溶液孵育15min 。
冷却到室温后6,000 转/分离心1分钟。


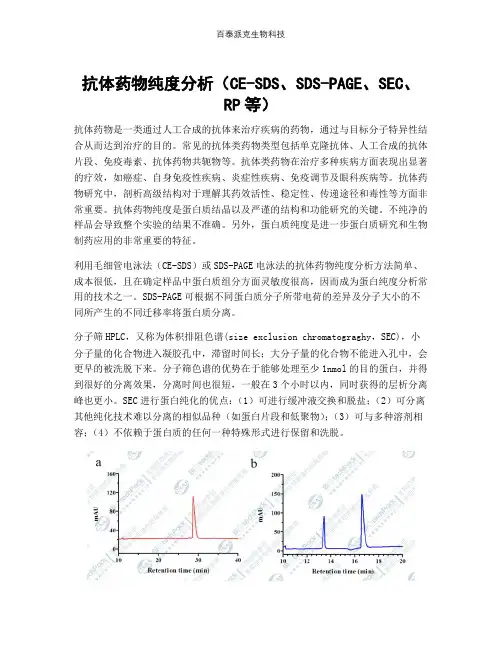
抗体药物纯度分析(CE-SDS、SDS-PAGE、SEC、RP等)抗体药物是一类通过人工合成的抗体来治疗疾病的药物,通过与目标分子特异性结合从而达到治疗的目的。
常见的抗体类药物类型包括单克隆抗体、人工合成的抗体片段、免疫毒素、抗体药物共轭物等。
抗体类药物在治疗多种疾病方面表现出显著的疗效,如癌症、自身免疫性疾病、炎症性疾病、免疫调节及眼科疾病等。
抗体药物研究中,剖析高级结构对于理解其药效活性、稳定性、传递途径和毒性等方面非常重要。
抗体药物纯度是蛋白质结晶以及严谨的结构和功能研究的关键。
不纯净的样品会导致整个实验的结果不准确。
另外,蛋白质纯度是进一步蛋白质研究和生物制药应用的非常重要的特征。
利用毛细管电泳法(CE-SDS)或SDS-PAGE电泳法的抗体药物纯度分析方法简单、成本很低,且在确定样品中蛋白质组分方面灵敏度很高,因而成为蛋白纯度分析常用的技术之一。
SDS-PAGE可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离。
分子筛HPLC,又称为体积排阻色谱(size exclusion chromatograghy,SEC),小分子量的化合物进入凝胶孔中,滞留时间长;大分子量的化合物不能进入孔中,会更早的被洗脱下来。
分子筛色谱的优势在于能够处理至少1nmol的目的蛋白,并得到很好的分离效果,分离时间也很短,一般在3个小时以内,同时获得的层析分离峰也更小。
SEC进行蛋白纯化的优点:(1)可进行缓冲液交换和脱盐;(2)可分离其他纯化技术难以分离的相似品种(如蛋白片段和低聚物);(3)可与多种溶剂相容;(4)不依赖于蛋白质的任何一种特殊形式进行保留和洗脱。
生物制品表征纯度分析(CE-SDS、SDS-PAGE、SEC、RP等)示意图。
百泰派克生物科技(BTP)采用ISO9001认证质量控制体系管理实验室,获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务。


蛋白质稳态技术中蛋白质异构体的分析与表征方法引言:蛋白质是生物体内最重要的功能分子之一,具有多样的结构和功能。
蛋白质异构体是指在同一菌株或组织中由同一基因编码生成的蛋白质,其氨基酸序列相同,但三维结构或表面糖基化等方面存在差异。
蛋白质异构体的分析与表征对于进一步理解其功能差异以及相关疾病的发生机制具有重要意义。
本文将介绍蛋白质稳态技术中常用的蛋白质异构体分析与表征方法,包括质谱分析、结构生物学研究和功能检测等方面。
一、质谱分析质谱分析是一种高灵敏度、高分辨率的蛋白质异构体分析方法。
蛋白质质谱分析通常包括两种方法:质谱-质谱分析和质谱-核磁共振联用分析。
1. 质谱-质谱分析:质谱-质谱分析是一种通过电离和碎片分析蛋白质质谱的方法。
常用的质谱-质谱分析方法包括MALDI-TOF、ESI-TOF、Q-TOF和Q-FTICR 等。
这些方法能够快速准确地确定蛋白质的分子质量和氨基酸序列,并鉴定蛋白质异构体之间的差异。
2. 质谱-核磁共振联用分析:质谱-核磁共振联用分析结合了质谱和核磁共振技术,能够同时获取蛋白质的质谱和结构信息。
这种方法在研究蛋白质异构体的结构和功能方面具有重要意义。
不过,由于其高昂的设备和技术要求,质谱-核磁共振联用分析目前还是比较高端的研究手段。
二、结构生物学研究结构生物学研究是研究蛋白质异构体的结构和构象变化的关键方法。
1. X射线晶体学:X射线晶体学是一种传统的用于解析蛋白质异构体三维结构的方法。
通过将蛋白质晶体暴露在X射线中,利用晶体衍射图像确定蛋白质的原子坐标。
这种方法对于小分子蛋白质异构体的结构解析非常有效,但对于大分子蛋白质异构体的结构研究存在一定的困难。
2. 核磁共振:核磁共振是另一种常用的蛋白质异构体结构研究方法。
核磁共振技术可以通过测量分子中核自旋和它们周围的化学环境之间的相互作用,获取蛋白质的高分辨率结构信息。
核磁共振技术对于大分子蛋白质异构体的结构解析非常有效,但其分辨率和灵敏度相对较低,对样品的要求较高。

ce-sds方法优化及其在抗体纯度检测中的应用与流程CE-SDS (Capillary Electrophoresis - Sodium Dodecyl Sulfate) 是一种常用的蛋白质分析技术,通常用于测定抗体的纯度和相关蛋白质的杂质含量。
以下是CE-SDS方法的优化和在抗体纯度检测中的应用和流程。
优化CE-SDS方法:1. 样品制备:抗体样品需要经过还原、热变性和去糖基化等处理步骤,以确保蛋白质在电泳过程中的准确分离。
此外,还需要考虑抗体浓度和载带缓冲液的选择等因素。
2. 电泳条件:需要优化电场强度、电泳缓冲液的pH等条件,以确保蛋白质在电泳毛细管中的迁移速度和准确分离度。
3. 标准品制备:准备适当的蛋白质标准品,可用于校准和定量分析。
4. 检测方法:选择适当的检测方法,如荧光检测、紫外检测等,以实现对蛋白质的敏感和准确检测。
CE-SDS方法在抗体纯度检测中的应用与流程:1. 样品准备:将抗体样品经过还原剂和变性缓冲液处理,以去除可能的杂质和聚集体。
2. 电泳操作:将经过处理的样品和蛋白质标准品分别加载到电泳芯片中,通过电场驱动蛋白质在毛细管中的迁移。
3. 分离和检测:在电泳过程中,蛋白质根据其大小和电荷进行分离。
在电泳结束后,使用适当的检测方法对蛋白质进行定性和定量分析。
4. 数据分析:根据蛋白质的迁移距离和标准品的浓度,计算样品中抗体的纯度和杂质含量。
总结:CE-SDS方法是一种高效、灵敏的抗体纯度检测技术,通过优化方法和流程,可以实现对抗体样品的准确分离和定量分析。
这种方法能够帮助研究人员评估抗体的纯度,并提供高质量的抗体样品,以保证后续研究的准确性和可靠性。
附录XX 单抗纯度测定方法-CE-SDS毛细管电泳(还原和非还原)本法系采用十二烷基硫酸钠毛细管电泳(CE-SDS)紫外检测方法,在还原和非还原条件下,依据分子量大小,定量测定重组单抗产品的纯度。
参照毛细管电泳法(附录V G)测定。
1. 毛细管电泳系统(1)检测器:紫外检测器,波长:214 nm。
(2)毛细管:非涂层-熔融石英毛细管(内径50μm),切割至总长为31 cm、有效长度为21 cm。
(3)孔塞大小: 8 (100×800 μm)2. 试剂(1)SDS样品缓冲液:含1% SDS的0.1M Tris-HCl溶液, pH 9.0。
(2)SDS 凝胶分离缓冲液:含0.2% SDS的缓冲液(pH8.0),含有适当的亲水性聚合物作为分子筛。
(3)0.1 N盐酸溶液(4)0.1 N氢氧化钠溶液(5)纯的2-巯基乙醇(6)烷基化溶液:0.8 M的碘乙酰胺水溶液, 如称取约74 mg 碘乙酰胺,加入500µL超纯水溶解,新鲜制备,避免光照。
(7)参比品溶液:终浓度1 mg/mL。
3. 供试品处理:(1)供试品溶液制备:用SDS样品缓冲液将供试品稀释至1mg/mL。
样品缓冲液以相同稀释倍数稀释,为空白对照。
(2)非还原供试品溶液制备:取供试品溶液(1mg/ml)95µL,加入0.8 M 碘乙酰胺水溶液5 µL ,涡旋混匀。
取空白对照95µL,加入0.8 M碘乙酰胺水溶液5 µL,涡旋混匀,为非还原空白对照。
(3)还原供试品溶液制备:取供试品溶液(1mg/ml)95µL,加入2-巯基乙醇溶液5 µL ,涡旋混匀。
取空白试剂95µL,加入2-巯基乙醇溶液5 µL ,涡旋混匀,为还原空白对照。
将供试品溶液和空白对照在68︒C -7 2︒C孵育,非还原供试品溶液孵育5min,还原供试品溶液孵育15min 。
冷却到室温后6,000 转/分离心1分钟。
蛋白质电泳常用的几个实验
1. 聚丙烯酰胺凝胶电泳(SDS-PAGE)
SDS-PAGE是研究蛋白质分子量和纯度的常用方法。
在电泳前,蛋白质样品需要加入SDS(十二烷基硫酸钠)和还原剂,使蛋白质变性并带上负电荷。
在电场作用下,蛋白质按照分子量的大小进行分离。
2. 等电聚焦电泳(IEF)
IEF是根据蛋白质的等电点(pI)进行分离。
样品先在一维pH梯度凝胶条中进行电泳,然后再在二维SDS-PAGE凝胶中按分子量进行分离。
这种二维电泳可以同时分析蛋白质的pI和分子量。
3. 免疫印迹(Western Blot)
免疫印迹是在电泳基础上进行的蛋白质检测方法。
将电泳分离后的蛋白质转移到一层膜上,然后用特异性抗体与目标蛋白质结合,最后通过显色反应检测目标蛋白质的存在和相对丰度。
4. 毛细管电泳(CE)
CE是一种高分辨率的微量分离技术,可以分析各种生物大分子,包括蛋白质。
由于使用毛细管作为分离介质,所以只需要很少量样品。
CE 操作简单,分离效率高。
5. 凝胶电泳移动度偏移分析(GEMSA)
GEMSA是研究蛋白质与核酸相互作用的方法。
先将蛋白质与核酸混合,然后进行非变性聚丙烯酰胺凝胶电泳。
由于结合了核酸后,蛋白质的电荷和构象发生改变,导致电泳迁移率发生偏移。
以上是一些常用的蛋白质电泳实验,它们在生物化学和分子生物学研究中发挥着重要作用。
ce-sds原理CE-SDS,即毛细管电泳-聚丙烯酰胺凝胶电泳(Capillary Electrophoresis-Sodium Dodecyl Sulfate),是目前应用十分广泛的蛋白质分析方法之一。
它通过将蛋白质与SDS 进行复合,使蛋白质分子带负电荷,可以在直径为10-100微米的玻璃毛细管中进行电泳分离。
本文将介绍CE-SDS原理,以便大家更好地了解这种分析方法。
CE-SDS原理包含几个方面,主要如下:1. 蛋白质与SDS复合SDS(十二烷基硫酸钠)是一种具有阴离子表面活性剂性质的分子,在水溶液中可自发地与蛋白质发生复合,使蛋白质分子带负电荷。
SDS与蛋白质复合的比例是1.4:1,即每个SDS分子与蛋白质复合时需要结合约3.3个氨基酸。
由于蛋白质分子的质量和形状不同,SDS的结合也有所不同,因此一般情况下,SDS与蛋白质的比例是一个近似值,这也使得SDS-PAGE成为蛋白质分析和鉴定的重要方法之一。
2. 毛细管电泳毛细管电泳是利用电场作用下分离样品的方法。
毛细管的直径非常小(通常为25-200μm),因此可以分离比分子量相近的蛋白质。
样品通过电场移动到毛细管两端,分子量较小的样品移动速度较快,分子量较大的样品移动速度较慢,从而实现样品的分离。
毛细管电泳具有分离时间短、分离效果好等特点,目前已广泛应用于蛋白质分析领域。
3. 聚丙烯酰胺凝胶电泳聚丙烯酰胺凝胶电泳是一种将样品通过聚丙烯酰胺凝胶(通常是10-15%)孔道进行分离的方法。
样品通过孔道时,由于凝胶的孔道直径不同,分子量小的样品可以进入更多的孔道,分子量大的样品则只能进入较少的孔道,从而实现样品的分离。
聚丙烯酰胺凝胶电泳是一种简单、易操作的蛋白质分析方法,已被广泛应用于蛋白质分析和检测。
综上所述,CE-SDS原理主要包括蛋白质与SDS复合、毛细管电泳和聚丙烯酰胺凝胶电泳三个方面。
通过这种方法,可以较为精确地确定蛋白质的分子量和含量,而且操作简单、灵敏度高、分离效果好,是一种非常有价值的蛋白质分析方法。
颁发部门:质量保证部分发部门:分析研究部拷贝号:NO. /目录1目的 (4)2范围 (4)3定义 (4)4环境、健康和安全 (4)5培训 (4)6职责 (4)7程序(内容) (4)7.1原理 (4)7.2实验材料 (4)7.3操作步骤 (5)7.4结果分析 (9)7.5判定标准 (9)7.6注意事项 (9)8相关文件 (10)9参考文献 (10)10流程图 (10)11附录 (10)十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)测定记录 (1)十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)测定记录(适用于多个样品) (1)1目的规范十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)检验的操作过程。
2范围本规程适用于常规十二烷基硫酸钠毛细管凝胶电泳检验,涉及到蛋白质纯度相关指标的测定。
3定义3.1CE-SDS:十二烷基硫酸钠毛细管凝胶电泳。
4环境、健康和安全还原电泳中使用的巯基乙醇为挥发性液体,具有较强烈的刺激性气味,会刺激眼睛、呼吸系统和皮肤,吞食有害,与皮肤接触有毒,取液时穿戴适当的防护服、手套和护目镜或面具。
如不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
该液体对水体环境能产生长期污染等不良影响,切勿倒入下水道,应倒入废液桶,由专业部门回收。
与空气混合、受热、明火可爆,如其燃烧可用二氧化碳、干粉类灭火剂。
储存库房应通风低温干燥,与氧化剂、食品分开储运。
5培训5.1培训部门:分析研究部。
5.2培训对象:分析研究部相关人员。
5.3培训方式和时数:自学,0.5小时。
5.4考核方式:问答。
6职责6.1质量保证部:负责监督本文件的执行。
6.2分析研究部:负责严格执行本规程规定。
7程序(内容)7.1原理该方法是指以弹性石英毛细管为分离管道,以高压直流电场为驱动力,通过目标蛋白在含有胶的溶液中的迁移速率不同而得到分离,较小分子量的分子迁移速度更快则其迁移时间短,较大分子的迁移速度慢则其迁移时间更长。
maurice ce-sds 分子量的分别率
Maurice CE-SDS(毛细管电泳-十二烷基硫酸钠)是一种先进的分析技术,具有出色的分子量分辨能力。
该技术结合了毛细管电泳的高分辨率和十二烷基硫酸钠(SDS)对蛋白质的变性作用,从而实现对蛋白质分子量的精确测定。
在分子量检测方面,Maurice CE-SDS具有较宽的检测范围,通常可以覆盖10-240kD 的分子量范围。
这意味着该技术可以应用于多种不同大小的蛋白质分析。
此外,其高分辨率的特性使得糖基化重链和非糖基化重链的分离度达到1.5,这一分离度完全满足国家药典的要求。
关于重复性,Maurice CE-SDS表现出极高的稳定性。
在单抗样品在还原条件下的连续24次CE-SDS检测中,相对标准偏差(RSD)小于1%,这充分证明了该技术的可靠性和稳定性。
此外,Maurice CE-SDS还具有使用方便的特点。
工厂预装的毛细管卡盒使得质量可控可靠,同时无需额外的管路连接,从而避免了管路堵塞的困扰。
内置的压力防倒流系统进一步增强了其使用的便捷性和安全性。
综上所述,Maurice CE-SDS以其宽泛的分子量检测范围、高分辨率、高重复性以及使用方便的特点,在蛋白质分子量分析领域具有显著的优势。
这些优势使得该技术成为蛋白质分子量分析的理想选择,为科研工作者和制药行业提供了强大的技术支持。
CE-SDS蛋白异构化分析
蛋白异构化分析是研究蛋白质在结构和功能上的差异性的一种方法。
蛋白质是生命活动中的关键分子,其功能与其结构紧密相关。
然而,相同的氨基酸序列可能存在多种三维结构形态,这些形态被称为异构体。
蛋白异构化可能是由于多种因素导致,如翻译后修饰、异源表达、环境因素等。
单克隆抗体的异构化是蛋白质降解的常见途径之一。
异构体不仅可能导致蛋白质功能的改变,还与多种疾病,如神经退行性疾病、癌症等有关。
因此,对蛋白质的异构化进行分析和鉴定至关重要,特别是在药物研发和蛋白质药物生产中。
同一个基因编码的不同蛋白质异构体。
毛细管电泳(Capillary Electrophoresis-Sodium Dodecyl Sulfate,CE-SDS)技术是一种有效的检测和区分蛋白异构体的方法,由于蛋白异构体之间存在着电荷、大小、形状等差异,使得它们在电场中的迁移速率不同,因而可以分离、检测并鉴定这些异构体。
这种技术的优势在于它可以分析纯化后的蛋白质样品,也可以分析复杂的生物样品,如细胞裂解物或组织提取物等。
CE-SDS的高分辨率使其能够区
分非常相近的异构体,其高灵敏度、分辨率高和快速的优点,为蛋白质异构体的结构和功能研究提供了有力的工具。
百泰派克生物科技(BTP)基于高精密毛细管电泳仪和蛋白质电泳原理,开发并验
证了蛋白异构化CE-SDS分析平台,为您提供符合CNAS/ISO9001双重质量体系标准的CE-SDS蛋白异构化分析服务,可用于分析正常和应激条件下蛋白质产品如单克
隆单体的异构性,助力药物开发过程中对易于降解的候选药物进行早期识别。
中/英文项目报告
在技术报告中,百泰派克会为您提供详细的中英文双语版技术报告,报告包括:
1.实验步骤(中英文)。
2.相关的实验参数(中英文)。
3.蛋白质异构体详细信息。
4.电泳图片。
5.原始数据。
CE-SDS蛋白异构化分析一站式服务
您只需下单-寄送样品。
百泰派克一站式服务完成:样品处理-上机分析-数据分析-项目报告。