九年级化学金属的化学性质4
- 格式:pdf
- 大小:1.20 MB
- 文档页数:10




金属的化学性质教案背景:本节内容在金属材料的物理性质的基础上,重点介绍了金属的化学性质。
【学习目标】知识与技能1、掌握金属与氧气的反应。
2、初步认识常见金属与盐酸、稀硫酸以及金属化合物溶液间的置换反应。
3、能利用金属的活动性顺序对有关的置换反应进行判断,并能运用金属的活动顺序解释一些日常生活中有关的化学现象。
4、学会利用金属与酸以及金属化合物溶液通过“置换”推断常见金属活动性顺序。
过程与方法1、学会运用控制实验条件探究金属活动性顺序,以及分析解决问题的能力。
2、学习通过对实验现象进行筛选、对比、归纳、分析、进行信息处理,获取科学结论的科学方法。
情感、态度与价值观:1、发展学生勤于动手的科学精神,发展求知欲和探究激情。
2、体验合作学习和共同竞争的愉悦。
学习重点1、利用金属的活动性顺序对有关的置换反应进行判断。
2、部分金属重要化学性质(与氧气反应,与盐酸、稀硫酸反应及金属间的置换)。
学习难点对实验事实进行筛选、分析、归纳、综合等科学方法的建构。
教学方法:在老师引导下,进行自主学习与小组合作相结合的方式进行科学探究,从而得出金属与酸的反应现象及其反映的剧烈程度,也是本节科的主要内容。
教学准备:1、镁、铝、锌、铁、铜等金属,盐酸,稀硫酸。
2、多媒体课件。
教学过程【课前预习】1、通过前面的学习,我们知道镁和铁都能与氧气反应。
实验表明大多数金属都与氧气反应,但反应的剧烈程度不同。
如_______、_______、常温下就可以与氧气反应。
2、铁、铜等金属在常温下几乎不与氧气反应,但在__________时能与氧气反应。
3、由一种单质与一种化合物反应,生成__________ 和__________ 的反应叫做置换反应。
4、金属的活动性顺序:K、Ca、Na、____ 、____、Zn、____ 、_____ 、_____(H)___Cu、Hg、Ag、____ 、______ 。
5、金属活动性顺序的意义①在金属活动顺序里,______________________________。


九年级化学下册《金属的化学性质》知识点汇总九年级化学下册《金属的化学性质》知识点汇总一、金属的化学性质1、大多数金属可与氧气的反应2Mg+O22MgO2Mg+O22MgO注:MgO:白色固体4Al+3O22Al2O34Al+3O22Al2O3注:Al2O3:白色固体3Fe+2O2Fe3O42Cu+O22CuO注:CuO:黑色固体注意:①、虽然铝在常温下能与氧气反应,但是在铝表面生成了一层致密的氧化铝薄膜,从而阻止了反应的进行,所以铝在常温下不会锈蚀。
②、“真金不怕火炼”说明金即使在高温时也不能与氧气反应,金的化学性质极不活泼。
2、金属+酸→盐+H2↑置换反应(条件:活动性:金属>H)H2SO4+MgMgSO4+H2↑2HCl+MgMgCl2+H2↑现象:反应剧烈,有大量气泡产生,液体仍为无色3H2SO4+2AlAl2(SO4)3+3H2↑6HCl+2Al2AlCl3+3H2↑现象:反应剧烈,有大量气泡产生,液体仍为无色H2SO4+ZnZnSO4+H2↑2HCl+ZnZnCl2+H2↑现象:反应比较剧烈,有大量气泡产生,液体仍为无色H2SO4+FeFeSO4+H2↑2HCl+FeFeCl2+H2↑现象:反应比较缓慢,有气泡产生,液体由无色变为浅绿色当一定质量的金属与足量的稀盐酸(或硫酸)反应时,产生的氢气质量与金属质量的关系:×M(金属)生成物中金属元素的化合价金属的相对原子质量一价金属相对原子质量法:M(H2)=3、金属+盐→另一金属+另一盐置换反应(条件:参加反应的金属>化合物中金属元素)Fe+CuSO4==Cu+FeSO4(“湿法冶金”原理)现象:铁钉表面有红色物质出现,液体由蓝色变为浅绿色2Al+3CuSO4Al2(SO4)3+3Cu现象:铝丝表面有红色物质出现,液体由蓝色变为无色Cu+2AgNO3Cu(NO3)2+2Ag现象:铜丝表面有银白色物质出现,液体由无色变为蓝色。
注意:①CuSO4溶液:蓝色FeSO4、FeCl2溶液:浅绿色②Fe在参加置换反应时,生成+2价的亚铁盐。

课题: 金属的化学性质一、教材分析《金属的化学性质》是人教版九年级化学第八单元第二节的内容。
教材把金属的化学性质编排在金属的物理性质及金属冶炼之后,在其后安排金属锈蚀与废旧金属回收利用,这是按知识的逻辑顺序编排,也符合学生的认知特点。
教材注意从学生的生活经验和实验事实出发,采用实验探究、讨论分析、对比归纳等方法,引导学生学习,降低了学习难度,体现以人为本的教育理念。
教材还注重科学、技术与社会的联系,体现“从生活走进化学、从化学走向社会”的课程理念.二、学情分析在日常生活中,学生对铁制品已是司空见惯,他们在此之前已经学习过氧气、水、二氧化碳等元素化合物,积累了较多知识,再学习金属的性质,有助于学生形成系统的知识体系,对物质之间的相互关系也有了比较全面的认识。
因此对金属与氧气的反应,我认为只要将学生现有的知识储备加以整理,并能根据反应现象就能比较金属活动性强弱,而对金属与盐溶液的反应在金属活动性顺序的推导上,我结合学生的现有的认知水平、思维能力、生活经验等因素,采用学生动手实验探究等方法使学生的学习由难变易,轻松掌握。
三、目标分析1、教学目标:(1)知道铁、铝、铜等常见金属与氧气的反应。
(2)能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释日常生活中的一些问题。
2、教学重难点:教学重点:通过实验探究认识金属活动性顺序。
教学难点:运用金属活动性顺序解释生活、生产中的实际问题。
3、情感态度与价值观(1)培养学生的合作意识以及勤于思考、严谨求实、勇于创新和实践的科学精神(2)培养学生辩证唯物主义观点,激发和增强对化学现象的好奇心和探究欲,提高学习化学的兴趣四、教学方案的设计分析说教具学具说教法学法说教学流程说教具学具▪教具:制作多媒体课件▪学具:铜丝、铁丝、铝丝、镁条、镊子、砂纸、稀盐酸、硝酸银溶液、硫酸铜溶液、铜片、铁钉、砂纸、试管(若干)、烧杯说教法学法▪教法:探究式实验教学法、讨论分析、对比归纳。


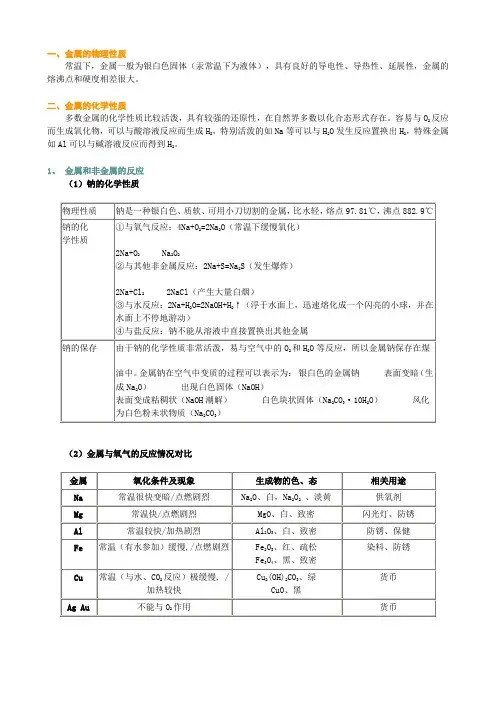
一、金属的物理性质常温下,金属一般为银白色固体(汞常温下为液体),具有良好的导电性、导热性、延展性,金属的熔沸点和硬度相差很大。
二、金属的化学性质多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。
容易与O2反应而生成氧化物,可以与酸溶液反应而生成H2,特别活泼的如Na等可以与H2O发生反应置换出H2,特殊金属如Al可以与碱溶液反应而得到H2。
1、金属和非金属的反应(1)钠的化学性质(2)金属与氧气的反应情况对比2、金属与酸和水的反应金属与酸、水、碱和盐的反应对比经典例题题1、(1)分别写出氧气在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O:__________________________________________。
②Na2O2:___________________________________________。
(2)指出氧元素在下列各物质中的化合价:O3______;Na2O2______;Na2O______。
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式________________________________________。
(4)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:□O2+□H2O====□H2O2+□O2+□□□【分析】本题涉及的知识点较多,有碱金属的性质,氧及臭氧的知识,化合价的概念等。
其中大部分知识是考生已经学过的,但也渗入了一些新知识,不过在题目所给信息的引导下,考生应能将所学知识迁移过去解决新问题。
【答案】(1)①2Na+O2Na2O2②4Na+O22Na2O(2) 0;-1;-2(3)4KO2+2CO2====2K2CO3+3O2(4)2O2-+2H2O====H2O2+O2+2OH-题2、一块表面已被氧化为Na2O的钠块10.8 g,将其投入到100 g水中,产生H2 0.2 g。
《金属的化学性质》说课稿3篇(实用版)编制人:______审核人:______审批人:______编制单位:______编制时间:__年__月__日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如工作文档、教学教案、企业文案、求职面试、实习范文、法律文书、演讲发言、范文模板、作文大全、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!And, our store provides various types of practical materials for everyone, such as work summaries, work plans, experiences, job reports, work reports, resignation reports, contract templates, speeches, lesson plans, other materials, etc. If you want to learn about different data formats and writing methods, please pay attention!《金属的化学性质》说课稿3篇《金属的化学性质》说课稿1说课有利于提高教师理论素养和驾驭教材的能力,也有利于提高教师的语言表达能力,因而受到广大教师的重视,登上了教育研究的大雅之堂。
金属的化学性质金属元素原子的最外层电子数少于4,只能失去电子,不能得到电子,金属元素只有正价;金属单质只有还原性,没有氧化性。
当电子层数相同时,最外层电子数越少,越容易失去电子,金属性越强。
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。
金属的上述特质都跟金属晶体内含有自由电子有关。
在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。
金属矿物多数是氧化物及硫化物。
其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。
金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属延展性良好的原因。
金属元素在化合物中通常只显正价。
相对原子质量较大的被称为重金属。
钾钙钠镁铝锌铁锡铅(氢) 铜汞银铂金K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au1、氢前面的金属能与弱氧化性强酸反应,置换出酸中的氢(浓硫酸、硝酸强氧化性强酸与金属反应不生成氢气)。
如:Fe + 2HCl ═FeCl2 + H2↑2、活动性强的金属能与活动性弱的金属盐溶液反应。
3、大多数金属能与氧气反应。
4、排在H前面的金属,理论上讲都能与水发生化学反应。
在常温下,钾,钙,钠等能与水发生剧烈反应,镁、铝等能与热水反应,铁等金属在高温下能与水蒸气反应。
5、金属均无氧化性,但金属离子有氧化性,活动性越弱的金属形成的离子氧化性越强。
6、金属都有还原性,活动性越弱的金属还原性越弱。
金属化学性能金属化学性能是指金属材料与周围介质扫触时抵抗发生化学或电化学反应的性能。
1、耐腐蚀性:指金属材料抵抗各种介质侵蚀的能力。
2、抗氧化性:指金属材料在高温下,抵抗产生氧化皮能力。
金属之最地壳中含量最高的金属元素:铝(含量为7.73%)人体中含量最高的金属元素:钙(含量为1.5%)目前世界年产量最高的金属:铁密度最小的金属:氢(2016年1月英国科学家在爱丁堡大学首次制成金属态氢,氢成为密度最小的金属)密度最大的金属:锇(22.48×10?㎏/m?)最硬的金属:铬(莫氏硬度约为9)最软的金属:铯(莫氏硬度约0.5)导电性最强的金属:银导热性最强的金属:银制造新型高速飞机最重要的金属:钛(被科学家称为“二十一世纪的金属”或“未来的钢铁”)海水中储量最大的放射性元素:铀(陆地铀矿的总储量约200万吨,海洋里含铀的总量高达40万万吨)含同位素最多的元素:锡(有10种稳定的同位素)含同位素最少的元素:钠(只有Na-23稳定)展性最强的金属:金(最薄的金厚度只有1/10000mm)延性最好的金属:铂(最细的铂丝直径只有1/5000mm)熔点最高的金属:钨(熔点:3410±20℃)熔点最低的金属:汞(熔点-38.8℃)熔沸点相差最大的元素是镓(熔点30℃,沸点2403℃)地壳中含量最少的金属是钫(即使是在含量最高的矿石中,每吨也只有37×10负13次方克;地壳中的含量约为1×10^-21 %) 光照下最易产生电流的金属元素:铯(当其表面受到光线照射时,电子便能获得能量从表面逸出,产生光电流)金属性最强的金属:铯世界上最贵的金属:锎(每克1千万美元,比金贵50多万倍)世界上最便宜的金属:铁最易应用的超导元素:铌(把它冷却到-263.9℃的超低温时,会变成一个几乎没有电阻的超导体)最能吸收气体的金属元素:钯(1体积胶状钯能吸收氢气1200体积)。