实验四 0.1molLHCL标准溶液的制备
- 格式:doc
- 大小:56.00 KB
- 文档页数:2

盐酸标准溶液的标定一.仪器与试剂仪器:全自动电光分析天平 1台(1)称量瓶 1只(2)试剂瓶 1000ml 1个(3)锥形瓶 250ml 3个(4)酸式滴定管 50ml 1支(5)量筒 50mL 1只试剂:(1)0.1mol/L盐酸待标定溶液(2)无水碳酸钠(固基准物)(3)溴甲酚绿-甲基红混合指示剂二、步骤0.1mol/L盐酸标准溶液的标定1.标定步骤用称量瓶按递减称量法称取在270~300℃灼烧至恒重的基准无水碳酸钠0.15~0.22g(称准至0.0002g),放入250ml锥形瓶中,以50ml蒸馏水溶解,加溴甲酚绿-甲基红混合指示剂10滴(或以25ml蒸馏水溶解,加甲基橙指示剂1~2滴),用0.1mol/L盐酸溶液滴定至溶液由绿色变为暗红色(或由黄色变为橙色),加热煮沸2分钟,冷却后继续滴定志溶液呈暗红色(或橙色)为终点。
平行测定3次,同时做空白实验。
以上平行测定3次的算术平均值为测定结果。
2.计算式中: m—基准无水碳酸钠的质量,g;V1—盐酸溶液的用量,ml;V—空白试验中盐酸溶液的用量,ml;52.99—1/2 Na2CO3摩尔质量,g/molCHCL—盐酸标准溶液的浓度,mol/L.氢氧化钠溶液的标定1、试剂:(1)0.1000mol/L 氢氧化钠待标定溶液(2)酚酞指示剂2、仪器:(1)全自动电光分析天平 1台(2)称量瓶 1只(3)碱式滴定管 (50mL ) 1支(4)锥形瓶 (250mL ) 3支(5)烧杯 (250mL ) 2只(6)洗瓶 1只(7)量筒 (50mL ) 1只3、测定步骤:准确称取在110℃~120℃准确称取在110~120℃烘至恒重的基准邻苯二甲酸氢钾0.5~0.6g(称准至0.0002g),放入250ml 三角瓶中,加入250ml 的蒸馏水溶解,加酚酞指示剂2滴,用0.1mol/LNaOH 溶液滴定至由无色变为红色30秒不褪色为终点,平行测定3次,同时作空白试验。

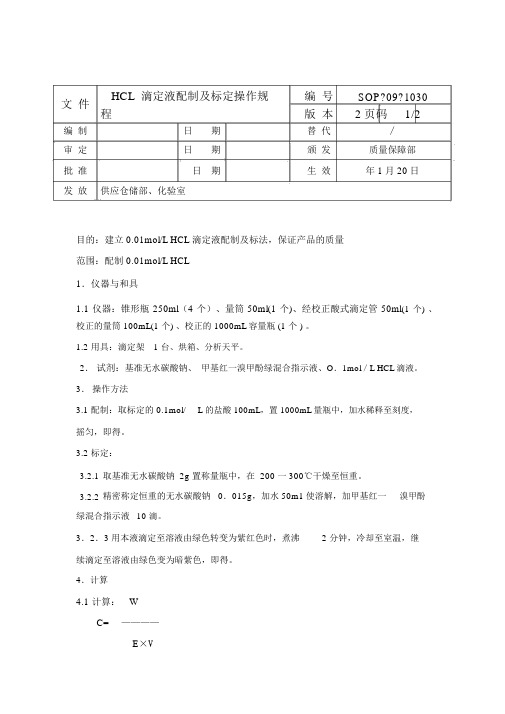
文件HCL 滴定液配制及标定操作规编号SOP?09?1030程版本2页码1/2编制日期替代∕审定日期颁发质量保障部批准日期生效年 1月 20日发放供应仓储部、化验室目的:建立 0.01mol/L HCL 滴定液配制及标法,保证产品的质量范围:配制 0.01mol/L HCL1.仪器与和具1.1 仪器:锥形瓶 250ml(4 个)、量筒 50ml(1 个)、经校正酸式滴定管 50ml(1个)、校正的量筒 100mL(1 个) 、校正的 1000mL容量瓶 (1 个 ) 。
1.2 用具:滴定架 1 台、烘箱、分析天平。
2.试剂:基准无水碳酸钠、甲基红一溴甲酚绿混合指示液、O.1mol/L HCL滴液。
3.操作方法3.1 配制:取标定的 0.1mol/L 的盐酸 100mL,置 1000mL量瓶中,加水稀释至刻度,摇匀,即得。
3.2 标定:3.2.1取基准无水碳酸钠 2g 置称量瓶中,在 200 一 300℃干燥至恒重。
3.2.2精密称定恒重的无水碳酸钠 0.015g,加水 50m1使溶解,加甲基红一溴甲酚绿混合指示液10 滴。
3.2.3 用本液滴定至溶液由绿色转变为紫红色时,煮沸 2 分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色,即得。
4.计算4.1 计算:WC=————E×V式中: C摩尔浓度; w 取样量; E 相当数: V 消耗毫升数。
5.1 配制时必须精暂量取。
5.2 标定时在相同条件下各作平行试验3 份,3 份平行试验结果的相对偏差,不得大于 0.1%,平均值计算,取 4 位有效数字。
5.3 标定时室温应在 (10 —30℃) 下进行,并应在记录中注明标定的室内温5.4 标定液存放和使用不得超过 3 个月,过期应重新标定。
5.5 当标定与使用时的室温相差超过10℃,应按 (3 .2) 的要求进行重新标定。
5.6 当滴定液出现浑浊或其他异常情况时,该滴定液应即弃去,不得再用。

实验一盐酸标准溶液的配制与标定一、目的要求1.练习溶液的配制和滴定的准备工作,训练滴定操作,进一步掌握滴定操作。
2.学会用基准物质标定盐酸浓度的方法。
3.了解强酸弱碱盐滴定过程中 pH 的变化。
4.熟悉指示剂的变色观察,掌握终点的控制。
二、实验原理市售盐酸为无色透明的HCl水溶液,HCl含量为36%~38%(W/W),相对密度约为1.18。
由于浓盐酸易挥发出HCl气体,若直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
标定盐酸的基准物质常用碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,无水碳酸钠作基准物质的优点是容易提纯,价格便宜。
缺点是碳酸钠摩尔质量较小,具有吸湿性。
因此Na2CO3固体需先在270℃~300℃高温炉中灼烧至恒重,然后置于干燥器中冷却后备用。
计量点时溶液的 pH为3.89,用待标定的盐酸溶液滴定至溶液由绿色变为暗红色后煮沸2 min,冷却后继续滴定至溶液再呈暗红色即为终点。
根据Na2CO3的质量和所消耗的 HCl 体积,可以计算出HCl的准确浓度。
用Na2CO3标定时反应为:2HCl + Na2CO3→ 2NaCl + H2O + CO2↑反应本身由于产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
三、实验用品分析天平(感量0.01mg/分度),量筒,称量瓶,25mL酸式滴定管,250mL锥形瓶。
工作基准试剂无水Na2CO3:先置于270℃~300℃高温炉中灼烧至恒重后,保存于干燥器中。
浓HCl(浓或0.1mol/L),溴甲酚绿(3.8-5.4)一甲基红(4.4-6.2)指示液(变色点pH=5.1):溶液Ⅰ: 称取0.1 g 溴甲酚绿,溶于乙醇(95%),用乙醇(95%)稀释至100m L;溶液Ⅱ; 称取0.2 g 甲基红,溶于乙醇(95%),用乙醇(95% )稀释至100m L;取 30 m L溶液I, 10m L溶液Ⅱ,混匀。

实验五盐酸标准溶液的配制和标定一、实验目的1. 掌握减量法准确称取基准物的方法。
2. 掌握滴定操作并学会正确判断滴定终点的方法。
3. 学会配制和标定盐酸标准溶液的方法。
二、实验原理由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:Na2CO3 +2HCl=2NaCl+CO2 +H2O滴定至反应完全时,溶液pH为3.89,通常选用溴甲酚绿-甲基红混合液或甲基橙作指示剂。
三、仪器及试剂仪器:25ml酸式滴定管、烧杯、锥形瓶、玻璃棒、250ml容量瓶试剂:浓盐酸(密度1.19)、无水Na2CO3、甲基橙或者溴甲酚绿-甲基红混合液指示剂:量取30mL溴甲酚绿乙醇溶液(2g/L),加入20mL甲基红乙醇溶液(1g/L),混匀。
四、实验内容(一)0.1mol·L-1盐酸标准溶液的配制:量取2.2ml浓盐酸,注入250 mL水中,摇匀。
装入试剂瓶中,贴上标签。
(二)盐酸标准溶液的标定:准确称取0.19~0.21克于270—300℃灼烧至质量恒定的基准无水碳酸钠,称准至0.0002 g,(至少二份)。
溶于50mL水中,加2~3滴甲基橙作指示剂,用配制好的盐酸溶液滴定至溶液由黄色变为橙色,记下盐酸溶液所消耗的体积。
同时作空白试验。
(空白试验即不加无水碳酸钠的情况下重复上述操作。
)五、数据记录与处理 1.数据记录2. 盐酸标准溶液的浓度计算式:1000106)()(2)(032⨯⋅-=V V CO Na m HCl c l HC式中:c (HCl )——盐酸标准溶液之物质的量浓度,mol/L ;m ——无水碳酸钠之质量,g V ——盐酸溶液之用量,mLV 0——空白试验盐酸溶液之用量,mL 106——无水碳酸钠的摩尔质量,g/ mol 。

盐酸滴定液(0 1mol/L)配制及标定记录
1. 实验目的
通过制备盐酸滴定液并进行标定,掌握滴定法的基本操作和方法,培养实验仔细、严谨的态度。
2. 实验原理
滴定法是一种通过一种已知浓度的溶液与另一种未知浓度的溶液反应,根据反应的等当点(即摩尔比例)以计算未知溶液浓度的方法。
标定是指通过已知浓度的溶液与一个待定浓度的溶液的反应,确定该待定溶液的浓度值的方法。
本实验中,通过配制一定浓度的盐酸溶液,再通过酸碱滴定法计算其浓度,从而得出盐酸滴定液的准确浓度值。
3. 实验仪器和药品
所需仪器:滴定管、容量瓶、洗瓶、草酸等。
所需药品:氢氧化钠、多聚甲醛指示剂、纯净水和实验用盐酸。
4. 实验步骤
4.1 盐酸滴定液配制
(1)准确称取7.5mL的实验用盐酸,加入250mL容量瓶中。
(2)加入50mL的纯净水,摇匀。
(3)用多聚甲醛指示剂,在试管中加入几滴。
(4)用氢氧化钠标准溶液来滴定,从而确定盐酸滴定液的摩尔浓度。
(1)在滴定管中取5mL草酸溶液。
(5)重复以上步骤2~3次,直到3次测量值之间误差小于0.1mL。
5.实验结果
盐酸滴定液摩尔浓度为0.101mol/L。
6.实验讨论
在制备盐酸滴定液的过程中,需准确地称取药品和加入纯净水,以避免因误差的产生导致浓度值的偏差。
同时,在滴定草酸溶液时,也需要注意每次滴定时滴管中残留的滴液
量,以免导致误差。
在实验过程中,需保持仪器和试剂的干燥和清洁,以免对实验结果产生影响。
生物工程系专业试验汇报书专业:生物技术及应用班级:生物专08-1 指导老师:刘杰凤姓名:吴诗平学号:成绩:试验一盐酸标准溶液配制和标定一、目标要求1.练习溶液配制和滴定准备工作,训练滴定操作深入掌握滴定操作。
2.学会用基准物质标定盐酸浓度方法。
3.了解强酸弱碱盐滴定过程中 pH 改变。
4.熟悉指示剂变色观察,掌握终点控制。
二、试验原理市售盐酸为无色透明HCl水溶液,HCl含量为36%~38%(W/W),相对密度约为1.18。
因为浓盐酸易挥发出HCl气体,若直接配制正确度差,所以配制盐酸标准溶液时需用间接配制法。
标定盐酸基准物质常见碳酸钠和硼砂等,本试验采取无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,无水碳酸钠作基准物质优点是轻易提纯,价格廉价。
缺点是碳酸钠摩尔质量较小,含有吸湿性。
所以Na2CO3固体需先在270℃~300℃高温炉中灼烧至恒重,然后置于干燥器中冷却后备用。
计量点时溶液 pH为 3.89,用待标定盐酸溶液滴定至溶液由绿色变为暗红色后煮沸 2min,冷却后继续滴定至溶液再呈暗红色即为终点。
依据Na2CO3质量和所消耗 HCl 体积,能够计算出HCl正确浓度。
用Na2CO3标定时反应为:2HCl + Na2CO3→ 2NaCl + H2O + CO2↑反应本身因为产生H2CO3会使滴定突跃不显著,致使指示剂颜色改变不够敏锐,所以,靠近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
三、试验用具分析天平(感量0.01mg/分度),量筒,称量瓶,25mL酸式滴定管,250mL锥形瓶。
工作基准试剂无水Na2CO3:先置于270℃~300℃高温炉中灼烧至恒重后,保留于干燥器中。
浓HCl(浓或0.1mol/L),溴甲酚绿一甲基红指示液(变色点pH=5.1):溶液Ⅰ: 称取0.1 g 溴甲酚绿,溶于乙醇(95%),用乙醇(95%)稀释至100m L;溶液Ⅱ; 称取0.2 g 甲基红,溶于乙醇(95%),用乙醇(95% )稀释至100m L;取 30 m L溶液I, 10m L溶液Ⅱ,混匀。
盐酸标准溶液的配置与标定
1.配制
按规定量取盐酸,注入1000ml水中,摇均。
盐酸标准滴定液的浓度[ C(HCl)]1(mol/L)盐酸的体积 90 mL 盐酸标准滴定液的浓度[ C(HCl)]0.5(mol/L)盐酸的体积 45 mL 盐酸标准滴定液的浓度[C(HCl)]0.1(mol/L)盐酸的体积 9 mL 2. 标定
按表4的规定称取于270℃~300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红,用配好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2分钟,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验。
表 4
盐酸标准滴定液的浓度 C(NaOH) 1mol L工作基准试剂无水碳酸钠的质量1.9g
盐酸标准滴定液的浓度 C(NaOH) 0.5mol L工作基准试剂无水碳酸钠的质量0.95g
盐酸标准滴定液的浓度 C(NaOH) 0.1mol L工作基准试剂无水碳酸钠的质量0.2g
3.计算
盐酸标准滴定液的浓度[ C(HCl)],数值以摩尔每升(mol/L)表示,按式(2)计算:
C(HCl)=m/[v1-v2]*0.05299
式中:m-----无水碳酸钠的质量的准确数值,单位为克(g);
V1---盐酸溶液的体积的数值,单位是毫升(mL);
V2---空白试验盐酸溶液的体积的数值,单位是毫升(mL);。
1.目的:建立本规程旨在为盐酸滴定液的配制、标定提供操作标准。
2.范围:本规程对本公司的中心化验室盐酸滴定液的配制,标定有效。
3.责任:中心化验室滴定液配制人、标定人。
4.检验依据:《中国药典》2015年版四部5.内容:分子式:HCl分子量:36.465.1 配制◆盐酸滴定液(1mol/L):取盐酸90ml,加水适量使成1000ml摇匀。
◆盐酸滴定液(0.5、0.2或0.1mol/L)照上法配制,但盐酸的取用量分别为45 ml、18 ml、或9.0ml。
5.2 标定◆盐酸滴定液(1mol/L):取在270-300℃干燥至恒重的基准无水碳酸钠约1.5 g,精密称定,加水50ml使溶解,加甲基红—溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
每1ml的盐酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
◆盐酸滴定液(0.5mol/L)照上法标定,但基准无水碳酸钠的取用量改为约0.8g。
每1ml的盐酸滴定液(0.5mol/L)相当于26.50 mg的无水碳酸钠。
◆盐酸滴定液(0.2mol/L)照上法标定,但基准无水碳酸钠的取用量改为0.3g。
每1ml的盐酸滴定液(0.2mol/L)相当于10.60 mg的无水碳酸钠。
◆盐酸滴定液(0.1mol/L)照上法标定,但基准无水碳酸钠的取用量改为约0.15g。
每1ml的盐酸滴定液(0.1mol/L)相当于5.30 mg的无水碳酸钠。
◆如需用盐酸滴定液(0.05mol/L、0.02mol/L、或0.01mol/L)时,可取盐酸滴定液(1mol/L或0.1mol/L)加水稀释制成。
必要时标定浓度。
5.3 原理Na2CO3+2HCl 2NaCl+CO2+H2O5.4 计算公式m×1000盐酸滴定液的浓度(mol/L):=V×T式中:m为基准无水碳酸钠的称取量(mg);v 为本滴定液的消耗量(ml);T为与每1ml的盐酸滴定液相当的无水碳酸钠的毫克数。
盐酸标准溶液的配制与标定一、【实验目的与要求】1、掌握用无水碳酸钠作基准物质标定盐酸溶液的原理和方法。
2、正确判断甲基橙指示剂的滴定终点二、【实验原理】市售浓盐酸为无色透明的HCl 水溶液 ,HCl 含量为 36%~ 38%(W/W ,相对密度约为 1.18。
由于浓盐酸易挥发放出HCl 气体,直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
标定盐酸的基准物质常用无水碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基橙指示剂指示终点,终点颜色由黄色变为橙色。
用 Na2CO3标定时反应为:2HCl + Na 2CO3 = 2NaCl + H 2O + CO 2↑反应本身由于产生H 2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此 ,在接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
三、【仪器、材料与试剂】1.仪器和材料2.试剂仪器:分析天平,酸式滴定管(25m1),锥形瓶 (250m1) ,量筒 (100m1) ,吸量管 (2ml) ,试剂瓶 (250ml) ,烧杯 (250ml), 电炉子。
试剂:浓盐酸 (分析纯 ),无水碳酸钠(基准物质 ),甲基橙(如何配制?)四、【实验步骤】-11、盐酸溶液 (0.1mol L·)的配制用量筒取浓盐酸 4.5ml,加水稀释至500mL 混匀,倒入试剂瓶中,密塞,即得。
-12、盐酸溶液 (0.1mol L·) 的标定递减质量称量法在分析天平上称取在270~ 300℃干燥至恒重的基准物无水碳酸钠 1.0~1.2g 于小烧杯中,加入适量水溶解。
然后定量地转入250mL 容量瓶中,用水稀释至刻度,摇匀。
用移液管取碳酸钠溶液25.00mL ,加甲基橙指示剂1-2 滴,用 HCl 溶液滴定至溶液由黄色刚变为橙色,即为终点。
记下所消耗HCl 的体积。
平行测定三份,计算盐酸溶液的浓度。
五、【实验结果与数据处理】1、数据记录表格:123 m 碳酸钠(g)V 碳酸钠 (mL)25.0025.0025.00 HCl 终读数(mL)HCl 初读数(mL)V HCl(mL)C HCl ( mol·L -1 )C HCl的平均值 ( mol·L-1)相对平均偏差 ( ﹪ )2、公式推导六、【注意事项】1、铬酸洗液的安全使用。
实验报告
安全专业班姓名学号日期 2010.9.29 实验(三) 0.1mol.L-1HCL溶液的制备
一、实验目的
1.学习酸碱标准溶液的配制、标定。
2.学习滴定操作,初步掌握准确地确定终点的方法。
3.学习滴定分析中容量器皿等的正确使用。
4.熟悉指示剂色性质和终点颜色的变化。
二、实验原理
盐酸滴定碳酸钠溶液进行中和反应。
三、实验试剂
1.盐酸:分析纯;
2. 甲基橙:指示剂;
4.碳酸钠:基准试剂、固体
三、实验步骤
1.0.1mol/LHCL溶液的配制:
用量筒量取浓HCL~9ml,加入到预先装有300mL蒸馏水烧杯中,再加水稀释至1000mL,搅拌均匀备用。
2.HCL溶液的标定
准确称取己于270~300℃烘干至恒重的基准试剂0.15~0.20g碳酸钠3份,分别置于3个250mL锥形瓶中,加水50mL使之溶解,加入2甲基橙红指示剂,用待标定的HCL标准溶液滴定,使溶液由黄色变为橙红色,为滴定终点。
四. 实验数据记录与计算
%
52.0%1001148.00006
.0%
100=⨯=
⨯=平均浓度
极差
相对极差
五、问题讨论
1、简要说明标定反应原理?
1151.0994.52)05.055.27(10001677.0994
.52)(1000
)(12=⨯-⨯=⨯-⨯=
V V m NaOH C。