固体结构
- 格式:doc
- 大小:1.14 MB
- 文档页数:12

固体的结构与性质固体是物质的一种基本状态,其结构和性质对于我们理解和应用物质至关重要。
本文将从固体的结构与性质两个方面进行探讨,帮助读者深入了解固体的特点和相关知识。
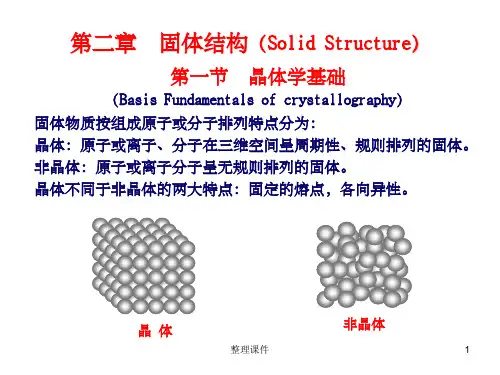
一、固体的结构固体是由原子、离子或分子组成的,其内部结构紧密有序。
常见的固体结构有晶体和非晶体两类。
1. 晶体结构晶体是由规则重复排列的三维晶体格点构成的。
按照晶格的形状分类,晶体又可分为立方晶系、四方晶系、六方晶系、正交晶系、单斜晶系和三斜晶系六类。
晶体结构的特点包括:(1)周期性:晶体结构呈现规律的重复性,几何形状具有对称性。
(2)硬度:晶体由于内部原子、离子或分子的结合力较强,因此常具有较高的硬度。
(3)透明性:某些晶体的结构对入射光具有高度的吸收和散射,从而使得它们呈现出透明的性质。
2. 非晶体结构非晶体没有明确的晶体结构,其原子、离子或分子的排列形式是无序的、杂乱的。
非晶体的特点包括:(1)无规则性:非晶体内部原子、离子或分子无明显的规律性排列,呈现无序状态。
(2)随机性:在非晶态下,固体的物理性质随着组成成分的变化呈现连续性、可调节性。
(3)折射性:非晶体对光的折射性较强,使得它们呈现出不透明的特征。
二、固体的性质固体的性质是其结构特点所决定的,在以下几个方面表现出差异:1. 密度不同结构的固体具有不同的密度。
在一定温度和压力下,晶体的密度较大,而非晶体的密度较小。
这是因为晶体的有序排列使得原子、离子或分子之间的间隙较小,而非晶体中的无序性使得间隙较大。
2. 热导率晶体的热导率一般较高,是因为晶体中原子、离子或分子的排列紧密有序,传热路径较短。
非晶体由于其无序性,传热路径较长,因此热导率较低。
3. 电导率根据固体中携带电荷的粒子类型和可移动性的不同,固体的电导率表现出多样性。
金属固体因其自由电子的存在具有优良的导电性;离子晶体由于离子在结构中的周期性排列具有较高的电离度和离子迁移性;而非金属固体的电导率则相对较低。
4. 弹性固体的弹性是指其在受力作用下产生的变形和恢复的能力。

一、实验目的1. 理解固体结构的组成及其基本特性。
2. 掌握固体结构实验的基本方法与操作。
3. 分析不同类型固体结构的力学性能。
4. 培养实验数据记录、处理及分析的能力。
二、实验原理固体结构是指由各种固体材料构成的建筑物、构筑物及其部件。
在实验中,我们将通过以下几种实验方法来研究固体结构的特性:1. 材料力学性能实验:通过拉伸、压缩、弯曲等实验,测定材料的弹性模量、屈服强度、极限强度等力学性能。
2. 结构模型实验:通过搭建不同类型的结构模型,观察和分析其在受力时的变形和破坏情况。
3. 结构动力特性实验:通过激振、测量等方法,研究结构的自振频率、阻尼比等动力特性。
三、实验内容及步骤1. 材料力学性能实验(1)实验仪器:万能试验机、拉伸试验机、压缩试验机、弯曲试验机等。
(2)实验步骤:① 根据实验要求,选取合适的实验材料,如钢材、木材、混凝土等。
② 对实验材料进行加工,制成标准试件。
③ 将试件安装到相应的试验机上,进行拉伸、压缩、弯曲等实验。
④ 记录实验数据,包括应力、应变、变形等。
⑤ 分析实验结果,计算材料的力学性能指标。
2. 结构模型实验(1)实验仪器:模型支架、加载装置、位移传感器等。
(2)实验步骤:① 根据实验要求,设计并搭建不同类型的结构模型,如梁、板、壳等。
② 将模型支架固定在实验台上,将结构模型安装在支架上。
③ 在模型上施加不同方向的载荷,如轴向、横向、弯曲等。
④ 使用位移传感器测量结构模型的变形情况。
⑤ 分析实验结果,研究结构的力学性能和破坏机理。
3. 结构动力特性实验(1)实验仪器:激振器、加速度传感器、频率分析仪等。
(2)实验步骤:① 将结构模型安装在实验台上,将加速度传感器安装在模型上。
② 通过激振器施加周期性激励,使结构模型产生振动。
③ 使用加速度传感器测量结构的振动加速度,通过频率分析仪分析振动信号。
④ 记录实验数据,包括自振频率、阻尼比等动力特性指标。
⑤ 分析实验结果,研究结构的动力特性。

固体理论知识点总结1. 固体的结构固体的结构是固态理论研究的重要内容之一。
固体的结构可以分为晶体和非晶体两种。
晶体是一种有序排列的固体,其中原子或分子以一定的规则排列,使得晶格结构具有周期性。
晶体的结构可以被描述为晶格和基元的组合。
晶格是空间中一组平行排列的点,在每个点上放置着一个基元,即晶体的最小重复单元。
晶体的结构可以根据晶格的对称性分为立方晶系、四方晶系、六角晶系、正交晶系、单斜晶系和三斜晶系六种。
非晶体是一种没有规则排列的固体,其中原子或分子的排列没有周期性,呈现出无序的结构。
非晶体的结构通常被描述为玻璃态或凝胶态。
2. 固体的性质固体的性质是由其结构和相互作用力决定的。
固体的性质包括机械性能、导电性、磁性、光学性质等。
其中,机械性能是固体最基本的性质之一,包括硬度、弹性模量、屈服强度等。
导电性是固态物理学中的重要研究内容,固体的导电性与其电子结构和晶格结构密切相关。
磁性是固态物理学中另一个重要的性质,固体的磁性可以分为铁磁性、反铁磁性、顺磁性和抗磁性四种。
光学性质是固体的另一个重要性质,包括折射率、吸收系数、反射率等。
3. 固体的相互作用固体中原子或分子之间存在着多种相互作用力,包括离子键、共价键、金属键、范德华力等。
离子键是一种电子转移的化学键,它是正离子和负离子之间的相互吸引力。
共价键是一种共享电子的化学键,它是由两个原子之间的电子共享所形成的化学键。
金属键是金属原子之间的一种特殊相互作用力,它是由金属原子之间的自由电子形成的。
范德华力是分子之间的一种弱相互作用力,它是由分子之间的瞬时偶极子相互作用所形成的力。
4. 固体的缺陷固体中存在着各种各样的缺陷,包括点缺陷、线缺陷、面缺陷等。
点缺陷是由于晶格中一个或多个原子的缺失或额外存在而形成的缺陷,包括空位缺陷、间隙缺陷、固溶体等。
线缺陷是由于晶体中晶格排列出现错误而形成的缺陷,包括蠕滑位错、螺位错、边界位错等。
面缺陷是由于晶格中晶面的形成而引起的缺陷,包括晶界、晶粒边界、孪晶界等。




固体的结构与性质固体是物质存在的一种状态,其分子或原子以固定的位置排列,相互间具有一定的结构和性质。
本文将探讨固体的结构特征以及对其性质的影响。
一、晶体结构晶体是固体中最有序、结构最规则的形态。
晶体的结构由重复排列的单位结构单元组成,这些结构单元通过晶体内部的转换与堆积形成整齐的晶体结构。
1. 点阵结构晶体结构的基本特征是点阵结构,即离子、分子或原子在晶体中以一定的法则排列。
常见的点阵结构包括立方晶系、四方晶系、正交晶系、斜方晶系、六方晶系和三斜晶系等。
2. 晶体面及晶胞晶体面指晶体的各个表面,其位置由晶胞决定。
晶胞是晶体中最小的结构单位,由一定数量的晶体面组成。
不同晶体的晶胞形状和大小各异,反映了各自的晶体结构。
3. 空间群空间群是描述晶体点阵结构的数学概念,它由旋转、平移、镜像操作和点群对称等元素组成。
空间群的不同反映了晶体的对称性,对晶体的性质和应用具有重要的影响。
二、非晶态结构非晶态是一种无典型结构的固体形态,其原子或分子排列无序。
非晶态是具有熵增益的形态,因而具有较高的熔点和较大的硬度。
非晶态结构的形成与快速冷却或高压下的固化有关。
1. 玻璃态玻璃是一种典型的非晶态结构,具有无序排列的原子或分子。
玻璃的制备通常通过快速冷却,使晶体无法形成有序结构,从而呈现出非晶态特征。
玻璃具有良好的透明性、热稳定性和化学稳定性。
2. 聚合物非晶态聚合物在液态聚合过程中,由于聚合物链的缩短和杂乱的分子运动,导致聚合物呈现无序排列的非晶态结构。
聚合物非晶态结构的形成直接影响了聚合物的物理性质、力学性能和热稳定性。
三、结构与性质的关系固体的结构直接影响其性质,不同结构的固体表现出不同的物理、化学性质。
以下是几个典型的例子。
1. 晶体的硬度晶体的硬度与其晶体结构以及离子或分子间的相互作用力有关。
通常,离子键和共价键较强,因此具有离子结构或共价结构的晶体通常比分子结构的晶体硬度更高。
2. 聚合物的弹性聚合物的结构对其弹性和可塑性起着关键作用。

固体的性质与结构一、固体的定义与特点1.定义:固体是一种物质状态,具有固定的形状和体积,分子间相互作用力较强。
2.特点:固体分子的运动范围有限,排列有序,密度大,稳定性好。
二、固体的结构1.晶体结构:具有规则的几何外形,分子排列有序,如金属、食盐等。
2.非晶体结构:没有规则的几何外形,分子排列无序,如玻璃、塑料等。
三、固体的性质1.密度:单位体积内物质的质量,反映了固体的紧密程度。
2.硬度:固体抵抗外力压缩的能力,反映了分子间的相互作用力。
3.熔点:固体转变为液体的温度,与分子间的相互作用力有关。
4.沸点:固体转变为气体的温度,与分子间的相互作用力有关。
5.导电性:固体导电的能力,与自由电子的多少有关。
6.导热性:固体导热的能力,与分子间的相互作用力有关。
7.延展性:固体抵抗拉伸的能力,与分子间的相互作用力有关。
四、固体的分类1.金属固体:具有良好的导电性、导热性和延展性,如铜、铁、铝等。
2.非金属固体:如食盐(氯化钠)、白糖(蔗糖)等。
3.有机固体:如塑料、橡胶等。
五、固体的应用1.建筑材料:如水泥、砖块、钢材等。
2.电子元件:如半导体材料、集成电路等。
3.日常生活用品:如瓷器、玻璃等。
4.医药领域:如药物制剂、生物材料等。
六、固体的研究方法1.实验观察:通过实验现象来研究固体的性质与结构。
2.理论分析:运用物理学、化学等知识来解释固体的性质与结构。
3.技术手段:如X射线衍射、电子显微镜等,用于观察固体微观结构。
通过以上介绍,希望你对固体的性质与结构有更深入的了解。
在今后的学习和生活中,你可以不断探索和发现固体世界的奥秘。
习题及方法:1.习题:固体的定义是什么?请简述其特点。
方法:回顾课本中关于固体的定义和特点的描述,提取关键信息。
答案:固体的定义是具有固定的形状和体积的物质状态,其特点是分子间相互作用力较强,分子的运动范围有限,排列有序,密度大,稳定性好。
2.习题:晶体的结构具有哪些特点?请举例说明。


化学物质的固体结构化学物质的固体结构是指化学物质在固体状态下的排列和组织方式。
通过研究固体结构,我们可以深入了解物质的性质和行为,为各种应用提供基础和指导。
本文将介绍固体结构的基本概念、不同类型的结构以及相关研究方法。
一、固体结构的基本概念固体结构是指原子、离子或分子在空间中的排列方式。
固体结构的研究可以揭示物质的宏观性质和微观行为。
固体结构的基本要素包括晶胞、晶体格点和结构因子等。
晶胞是最小的可重复单元,晶体格点是晶胞中原子、离子或分子存在的位置,而结构因子则反映了晶格中原子、离子或分子的信息。
二、固体结构的类型1. 晶体结构晶体结构是最有序的固体结构类型,具有周期性和平衡性。
晶体可以分为晶体胞和晶体点阵两个层次。
晶体胞是晶体中最小的可重复单元,晶体点阵则是指晶体胞的排列方式。
晶体结构可分为简单晶体结构(如立方晶系)和复杂晶体结构(如六方晶系)。
2. 非晶体结构非晶体结构是指没有规则重复排列的结构,也被称为无定形固体。
非晶体的原子、离子或分子呈现无序排列,没有明显的周期性。
不同于晶体的长程有序性,非晶体的结构是短程无序的。
3. 多晶结构多晶结构是指由多个晶体颗粒组成的结构。
每个晶体颗粒具有自己的晶体结构,而整体上呈现不规则的排列方式。
多晶结构中的晶粒边界对于材料的力学性能和电学性能等具有重要影响。
三、固体结构的研究方法1. X射线衍射X射线衍射是最常用的研究固体结构的方法之一。
通过测量固体样品中入射X射线的衍射图样,可以获取固体的晶胞参数、晶体点阵类型等信息。
2. 电子显微镜电子显微镜可以用于观察固体样品的微观结构,包括原子、离子或分子的排列方式。
通过电子衍射技术,可以进一步研究晶格的性质和杂质的分布等细节。
3. 傅里叶变换红外光谱傅里叶变换红外光谱(FTIR)是一种非常有用的研究固体结构的方法。
它通过分析物质在红外光区的吸收峰位置和强度,可以得到有关化学键、分子结构和固体结构等信息。
4. 核磁共振核磁共振(NMR)技术常用于研究化学物质的固态结构。
固体结构总结引言固体结构是研究和描述物质内部原子、分子、离子的排列方式和相互作用的学科。
固体结构具有重要的科学与工程应用意义,对于理解物质的特性和性能具有重要的指导意义。
本文将对固体结构的基本概念、分类和常见举例进行总结。
1. 固体结构的基本概念固体结构是指固体中原子、分子、离子等微观粒子的排列方式和相互作用。
由原子、分子、离子等微观粒子组成的固体,通过不同的结构方式呈现出不同的物理和化学性质。
固体结构的理解对于研究物质的性质以及工业生产中的材料设计和加工具有重要意义。
2. 固体结构的分类根据微观粒子的排列方式和结构特点,固体结构可以分为晶体结构和非晶态结构。
2.1 晶体结构晶体结构是指由粒子组成有序排列的固体。
晶体的粒子排列规则,并且在空间中周期性重复。
晶体结构的特点包括: - 空间群:晶体结构中原子或分子的周期性排列方式可以通过空间群来描述。
- 晶胞:晶体中最小可重复单元的结构单位称为晶胞,晶胞可以由晶体结构的晶格和基元组成。
- 晶格:晶体中,晶体结构中的原子、分子、离子等粒子的排列方式,可以通过晶格矢量来描述。
- 晶体特性:晶体的物理和化学性质与其晶体结构密切相关,如晶格常数、晶体缺陷等。
2.2 非晶态结构非晶态结构是指在微观尺度上没有长程有序、无规则排列的固体。
非晶态结构的特点包括: - 无序性:非晶态结构的粒子排列没有周期性和规则性。
- 高度局域性:非晶态结构中的微观粒子呈现出高度局域性,即某个粒子的环境与其它粒子无关。
- 玻璃态:非晶态结构可呈现出类似玻璃的特性,如透明度、脆性等。
3. 固体结构的常见举例3.1 简单立方结构(SC)简单立方结构是最简单的一种晶体结构,其晶胞只包含一个原子,原子位于晶胞的各个顶点。
简单立方结构的晶胞只有一个晶胞面,相邻晶胞沿着所有三个方向堆积。
3.2 面心立方结构(FCC)面心立方结构中,除了相应于简单立方结构的晶胞角上的原子外,每个晶胞的每个晶胞面上都有一个原子。
固体的结构和性质固体是物质的一种形态,具有固定的形状和体积,分子或离子在固定的位置上振动。
固态物质的结构和性质直接影响着物质的性质、用途和应用范围。
本文将探讨固体的结构和性质,以及它们在实际应用中的重要性。
一、固体的晶体结构固体的晶体结构是指固体中分子、离子或原子的有序排列方式。
晶体结构具有高度的有序性和周期性,可以分为原子晶体、离子晶体和分子晶体三类。
1. 原子晶体原子晶体是由相同元素的原子通过共价键或金属键组成的晶体。
常见的原子晶体包括金、银、铁等金属。
原子晶体的特点是原子间键结构强度高,导电性好,热稳定性强。
2. 离子晶体离子晶体是由正、负离子通过离子键结合而成的晶体。
典型的离子晶体包括氯化钠、氧化镁等。
离子晶体的特点是硬度高,熔点较高,导电性能差。
3. 分子晶体分子晶体是由分子通过范德华力结合而成的晶体。
常见的分子晶体有冰、石墨等。
分子晶体的特点是比较脆弱,破碎后容易分解成单独的分子。
二、固体的物理性质固体的物理性质包括密度、硬度、熔点、导电性和热膨胀等。
1. 密度固体的密度是指单位体积内所含的质量。
不同固体的密度由其成分和结构所决定,密度越大,固体通常越重。
2. 硬度固体的硬度是指其抵抗外力的能力。
常用的硬度测试方法是莫氏硬度测试,通过硬度测试可以评估固体的抗刮、抗压和抗切削等性能。
3. 熔点固体的熔点是指固体转变为液体的温度。
不同固体的熔点由其组成和结构所决定,熔点越高,固体的稳定性越强。
4. 导电性固体的导电性是指固体导电或不导电的能力。
金属晶体由于自由电子的存在而具有良好的导电性,而离子晶体和分子晶体由于离子或分子之间缺少自由电子而不导电。
5. 热膨胀固体的热膨胀是指固体体积随温度变化而发生的变化。
固体的热膨胀系数越大,其体积变化程度越大。
三、固体的化学性质固体的化学性质包括固体与其他物质的反应性、稳定性以及固体内部分子或离子的结构稳定性等。
1. 反应性固体与其他物质的反应性取决于其组成和结构。
10--固体结构[教学要求]1.熟悉晶体的类型、特征核组成晶体的微粒间的作用力。
2.了解金属晶体的三种密堆积结构及其特征。
理解金属键的形成核特征。
3.熟悉三种典型离子晶体的结构特征。
理解晶格能的概念和离子电荷、半径对晶格能的影响;熟悉晶格能对离子化合物熔点、硬度的影响;了解晶格能的热化学计算方法。
4.了解离子半径及其变化规律、离子极化及其对键型、晶格类型、溶解度、熔点、颜色的影响。
5.熟悉键的极性和分子的极性;了解分子的偶极矩和变形性及其变化规律,了解分子间力的产生及其对某些物性的影响。
[教学重点]1.晶胞2.各种类型晶体的结构特征,特别是离子晶体。
3.离子极化[教学难点]晶胞的概念, 离子极化[教学内容]§10.1 晶体结构和类型10.1.1 晶体结构的特征与晶格理论1. 晶体结构的特征晶体是由原子、离子或分子在空间按一定规律周期性地重复排列构成的固体。
特征:(1) 晶体具有规则的几何构形,这是晶体最明显的特征,同一种晶体由于生成条件的不同,外形上可能差别,但晶体的晶面角却不会变.(2) 晶体表现各向异性,例如热、光、电、硬度等常因晶体取向不同而异。
(3) 晶体都有固定的熔点,玻璃在加热时却是先软化,后粘度逐渐小,最后变成液体.2. 晶格理论的基本概念晶格(点阵)是晶体的数学抽象。
晶胞是晶体的最小重复单元,通过晶胞在空间平移并无限地堆砌而成晶体,它有二个要素:一是晶胞的大小、型式。
晶胞的大小、型式由a、b、c三个晶轴及它们间的夹角α.β.γ所确定。
另一是晶胞的内容。
由组成晶胞的原子或分子及它们在晶胞中的位置所决定晶胞的内容包括粒子的种类,数目及它在晶胞中的相对位置。
按晶胞参数的差异将晶体分成七种晶系。
按带心型式分类,将七大晶系分为14种型式。
例如,立方晶系分为简单立方、体心立方和面心立方三种型式。
10.1.2 晶体缺陷1. 本征缺陷:由于晶体中晶格结点上的微粒热涨落所导致的缺陷。
2. 杂质缺陷:由于杂质进入晶体后所形成的缺陷。
3. 非化学计量化合物:组成非化学计量化合物的各个元素原子的相对数目不能用整数比表示。
例如:方铁矿理想化学式为:FeO实际组成范围为Fe0.89O~ Fe0.96O镧镍合金作为吸氢材料:LaNi5H x10.1.3 非晶体准晶体玻璃、沥青、石蜡、橡胶等均为非晶体。
非晶体没有规则的外形,内部微粒的排列是无规则的,没有特定的晶面。
石英玻璃—近程有序(0.1nm以下)远程无序(20nm以上)制成光导纤维。
10.1.4 晶体类型晶体的分类§10.2 金属晶体10.2.1 金属晶体的结构金属晶体是金属原子或离子彼此靠金属键结合而成的。
金属键没有方向性,金属晶体内原子以配位数高为特征。
如果将金属原子看作等径圆球,金属晶体则是这些等径圆球互相靠近堆积而成. 显然,最紧密方式堆积将是最稳定的.金属晶体中粒子的排列方式常见的有三种:六方密堆积(hexagonal close packing);面心立方密堆积(face-centred cubic close packing);体心立方堆积(body-centred cubic packing)。
10.2.2 金属键理论1. 电子海模型认为金属原子和金属正离子沉浸在“电子海(electron sea)”中.2. 能带理论分子轨道理论将金属晶体看作一个巨大分子,结合在一起的无数个金属原子形成无数条分子轨道,某些电子就会处在涉及构成整块金属原子在内的轨道. 这样就产生了金属的能带理论(金属键的量子力学摸型).能带理论中的一些重要概念:能带(energy band): 一组连续状态的分子轨道导带(conduction band): 由未充满电子的原子轨道所形成的较高能量的能带或电子在其中能自由运动的能带价带(valence band):由充满电子的原子轨道所形成的较低能量的能带禁带(forbidden energy gap): 能带和能带之间的区域能带理论的基本要点:(1)成键时价电子必须是“离域”的,所有的价电子应该属于整个金属晶格的原子所共有;(2)金属晶格中原子很密集,能组成许多分子轨道,而且相邻的分子轨道间的能量差很小,以致形成“能带”;(3)“能带”也可以看成是紧密堆积的金属原子的电子能级发生的重叠,这种能带是属于整个金属晶体的;(4)以原子轨道能级的不同,金属晶体中可有不同的能带,例如导带、价带、禁带等;(5)金属中相邻的能带有时可以互相重叠.§10.3 离子晶体10.3.1 离子晶体的结构三种典型的AB型离子晶体离子半径与配位数 NaCl 晶体中一层横截面:22(4)2(22)r r r -+-=+ 1r -=令 /0.414r r +-=/0.414r r +-= 理想的稳定结构(NaCl)半径比规则10.3.2 晶格能定义:在标准状态下,按下列化学反应计量式使离子晶体变为气体正离子和气态负离子时所吸收的能量称为晶格能,用U 表示。
b+a-a b M X (s) aM (g) + bX (g)→1.Born-Haber 循环U =-f m H Θ∆2.Born-Lande 公式式中:R 0—正负离子核间距离,Z 1,Z 2 —分别为正负离子电荷的绝对值, A —Madelung 常数,与晶体类型有关, n —Born 指数,与离子电子层结构类型有关。
A 的取值:CsCl 型 A =1.763 NaCl 型 A =1.748 ZnS 型 A =1.638n 的取值:影响晶格能的因素:① 离子的电荷(晶体类型相同时)z ↑,U ↑ 例:U (NaCl)<U (MgO) ② 离子的半径(晶体类型相同时)R ↑,U ↓ 例:U (MgO)>U (CaO) ③ 晶体的结构类型(决定A 的取值) ④ 离子电子层结构类型(决定n 的取值)晶格能对离子晶体物理性质的影响:离子电荷数大,离子半径小的离子晶体晶格能大,相应表现为熔点高、硬度大等性能。
10.3.3 离子极化离子的极化率(α):描述离子本身变形性的物理量。
离子的极化力(f ):描述一个离子对其他离子变形的影响能力。
1.离子的极化率(α)一般规律:①离子半径r :r 愈大,α愈大。
如α:Li+<Na+<K+<Rb+<Cs+;F-<Cl-<Br-<I-②负离子极化率大于正离子的极化率。
③离子电荷:正离子电荷少的极化率大。
如:α(Na+) >α(Mg2+)④离子电荷:负离子电荷多的极化率大。
如:α(S2-) >α(Cl-)⑤离子的电子层构型: (18+2)e-,18e-> 9-17e->8e-如:α(Cd2+) >α(Ca2+);α(Cu+) >α(Na+)2.离子极化力(f )一般规律:①离子半径r :r小者,极化力大。
②离子电荷:电荷多者,极化力大。
③离子的外层电子构型:f :(18+2)e -,18e-> 9-17e->8e-当正负离子混合在一起时,着重考虑正离子的极化力,负离子的极化率,但是18e构型的正离子(Ag+, Cd 2+等)也要考虑其变形性。
3.离子极化的结果①键型过渡(离子键向共价键过渡)如:AgF AgCl AgBr AgI离子键共价键②晶型改变③性质改变例如;溶解度AgCl > AgBr > AgINaCl 易溶于水,CuCl 难溶于水。
§10.4 分子晶体10.4.1 分子的偶极矩和极化率1.分子的偶极矩(μ):用于定量地表示极性分子的极性大小。
μ=⋅q l式中q 为极上所带电量,l 为偶极长度。
极性分子μ≠0非极性分子μ=0分子的偶极矩与键矩的关系:极性键构成的双原子分子:分子偶极矩= 键矩多原子分子的偶极矩= 键矩的矢量和,例如:μ(SF6) = 0,键矩互相抵消,μ(H2O)≠0,键矩未能抵消。
2.分子的极化率:用于定量地表示分子的变形性大小。
分子的变形性大小指的是正电中心与负电中心发生位移(由重合变不重合,由偶极长度小变偶极长度大) 。
影响分子变形性大小的因素:外因:外加电场愈强,分子变形愈厉害;内因:分子愈大,分子变形愈厉害。
10.4.2 分子间的吸引作用分子间具有吸引作用的根本原因:任何分子都有正、负电中心;任何分子都有变形的性能。
1.色散作用(色散力):由于瞬时偶极而产生的分子间相互作用。
色散力与分子极化率有关。
α大,色散力大。
2.诱导作用(诱导力):由于诱导偶极而产生的分子间相互作用。
决定诱导作用强弱的因素:极性分子的偶极矩:μ愈大,诱导作用愈强。
非极性分子的极化率:α愈大,诱导作用愈强。
3.取向作用(取向力):两个固有偶极间存在的同极相斥、异极相吸的定向作用称为取向作用。
两个极性分子相互靠近时,由于同极相斥、异极相吸,分子发生转动,并按异极相邻状态取向,分子进一步相互靠近。
分子间力的特点:A.不同情况下,分子间力的组成不同。
例如,非极性分子之间只有色散力;极性分子之间有三种力,并以色散力为主,仅仅极性很大的H2O 分子例外。
B.分子间力作用的范围很小(一般是300-500pm)。
C.分子间作用力较弱,既无方向性又无饱和性。
分子间力的意义:决定物质的熔、沸点、汽化热、熔化热、蒸气压、溶解度及表面张力等物理性质的重要因素。
10.4.3 氢键HF为何反常的高?原因——存在氢键。
HF 分子中,共用电子对强烈偏向电负性大的F 原子一侧。
在几乎裸露的H 原子核与另一个HF 分子中 F 原子的某一孤对电子之间产生的吸引作用称为氢键。
氢键的形成条件:分子中有H和电负性大、半径小且有孤对电子的元素(F ,O,N)形成氢键。
氢键的特点:①键长特殊:F-H---F 270pm②键能小E(F-H---F) 28kJ·mol-1③具有饱和性和方向性除了HF、H2O、NH3 有分子间氢键外,在有机羧酸、醇、酚、胺、氨基酸和蛋白质中也有氢键的存在。
例如:甲酸靠氢键形成二聚体。
除了分子间氢键外,还有分子内氢键。
例如,硝酸的分子内氢键使其熔、沸点较低。
§10.5 层状晶体石墨具有层状结构,称为层状晶体。
同一层:C-C 键长为142pm,C 原子采用sp 2杂化轨道,与周围三个C 原子形成三个σ键,键角为120o,每个 C 原子还有一个2p 轨道,垂直于sp2杂化轨道平面,2p 电子参与形成了π键,这种包含着很多原子的π键称为大π键。
层与层间:距离为340pm,靠分子间力结合起来。
石墨晶体既有共价键,又有分子间力,是混合键型的晶体。
思考:石墨具有良好的导电传热性,又常用作润滑剂,各与什么结构有关?。