固体中的相结构分类和形成规律
- 格式:ppt
- 大小:1.49 MB
- 文档页数:30


材料科学基础名词解释第一章固体结构1、晶体 :原子按一定方式在三维空间内周期性地规则重复排列,有固定熔点、各向异性。
非晶体 :原子没有长程的周期排列,无固定的熔点,各向同性等。
2、中间相 : 两组元 A 和 B 组成合金时,除了形成以 A 为基或以 B 为基的固溶体外,还可能形成晶体结构与 A,B 两组元均不相同的新相。
由于它们在二元相图上的位置总是位于中间,故通常把这些相称为中间相。
3、晶体点阵:由实际原子、离子、分子或各种原子集团,按一定几何规律的具体排列方式称为晶体结构或晶体点阵。
4、配位数 :晶体结构中任一原子周围最近邻且等距离的原子数。
5、晶格:描述晶体中原子排列规律的空间格架称之为晶格。
6、晶胞 :在点阵中取出一个具有代表性的基本单元(最小平行六面体)作为点阵的组成单元,称为晶胞。
7、空间点阵:由周围环境相同的阵点在空间排列的三维列阵成为空间点阵。
8、晶向:在晶格中,穿过两个以节点的任一直线,都代表晶体中一个原子列在空间的位向,称为晶向。
9、晶面:由节点组成的任一平面都代表晶体的原子平面,称为晶面。
10、晶向指数(晶面指数):为了确定晶面、晶向在晶体中的相对取向、就需要一种符号,这种符号称为晶面指数和晶向指数。
国际上通用的是密勒指数。
一个晶向指数并不是代表一个晶向,二十代表一组互相平行、位向相同的晶向。
11、晶向族:原子排列相同但空间位向不同的所有晶向称为晶向族,以<uvw>表示。
12、晶面间距:相邻两个平行晶面之间的垂直距离。
低指数晶面的面间距较大,而高指数晶面的面间距较小。
晶面间距越大,则该晶面上原子排列越紧密,该原子密度越大。
13、配位数:每个原子周围最近邻且等距离的原子数目,称为配位数。
14、多晶型性:有些金属固态在不同温度或不同压力范围内具有不同的晶体结这种性质构,称为晶体的多晶型性。
15、多晶型性转变:具有多晶型性的金属在温度或压力变化由一种结构转变为另一种结时,构的过程称为多晶型性转变,也称为同素异构转变。

合金的相结构是指在固体状态下,合金中结构和成分均一的组成部分。
根据合金中各组元间相互作用不同,固态合金中的相可分为固溶体和金属化合物两类。
固溶体是指固态合金组元间互相溶解而形成的均匀相。
固溶体中保持原来晶格结构的组元称为溶剂,其含量较多;其他溶入且晶格结构消失了的组元称为溶质,其含量较少。
固溶体是合金的一种基本相结构,其晶格与溶剂组元晶格相同。
按溶质原子在溶剂晶格中所占位置不同,可分为间隙固溶体和置换固溶体两类。
间隙固溶体:溶质原子处于溶剂原子的间隙中而形成的固溶体。
由于溶剂晶格空隙有限,故间隙固溶体能溶解的溶质原子的数量也是有限的。
由于溶剂晶格空隙尺寸很小,因此能形成间隙固溶体的溶质原子,通常是一些半径很小的非金属元素,如碳、氮、硼等非金属元素溶于铁中形成的固溶体。
置换固溶体:单胞中的原子数目保持与纯溶剂相同,由一种元素替代另一种元素或替代一个化合物中的某一元素,或一个化合物替代另一个化合物。
形成置换固溶体的条件是:相互替代的组元应该具有相同的晶胞形状,原子半径差不超过15%,电负性和电子结构相近。
此外,金属化合物是指合金中的各组元通过相互作用,形成了与组元性质完全不同的新相。
金属化合物一般具有复杂的晶体结构,其晶格结构与单一组元相的晶格结构均不相同。
金属化合物在合金中以脆性相形式存在,降低合金的力学性能。
综上所述,相是组织的基本单元,组织是相的综合体。
如需了解更多关于合金在固体状态的相结构的信息,建议查阅金属学书籍或咨询材料学家获取。



第一章材料中的原子排列第一节原子的结合方式2 原子结合键(1)离子键与离子晶体原子结合:电子转移,结合力大,无方向性和饱和性;离子晶体;硬度高,脆性大,熔点高、导电性差。
如氧化物陶瓷。
(2)共价键与原子晶体原子结合:电子共用,结合力大,有方向性和饱和性;原子晶体:强度高、硬度高(金刚石)、熔点高、脆性大、导电性差。
如高分子材料。
(3)金属键与金属晶体原子结合:电子逸出共有,结合力较大,无方向性和饱和性;金属晶体:导电性、导热性、延展性好,熔点较高。
如金属。
金属键:依靠正离子与构成电子气的自由电子之间的静电引力而使诸原子结合到一起的方式。
(3)分子键与分子晶体原子结合:电子云偏移,结合力很小,无方向性和饱和性。
分子晶体:熔点低,硬度低。
如高分子材料。
氢键:(离子结合)X-H---Y(氢键结合),有方向性,如O-H—O(4)混合键。
如复合材料。
3 结合键分类(1)一次键(化学键):金属键、共价键、离子键。
(2)二次键(物理键):分子键和氢键。
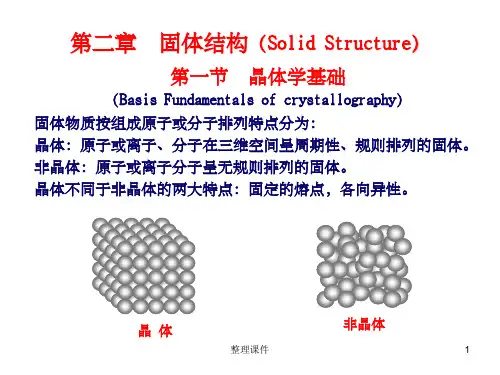
4 原子的排列方式(1)晶体:原子在三维空间内的周期性规则排列。
长程有序,各向异性。
(2)非晶体:――――――――――不规则排列。
长程无序,各向同性。
第二节原子的规则排列一晶体学基础1 空间点阵与晶体结构(1)空间点阵:由几何点做周期性的规则排列所形成的三维阵列。
图1-5特征:a 原子的理想排列;b 有14种。
其中:空间点阵中的点-阵点。
它是纯粹的几何点,各点周围环境相同。
描述晶体中原子排列规律的空间格架称之为晶格。
空间点阵中最小的几何单元称之为晶胞。
(2)晶体结构:原子、离子或原子团按照空间点阵的实际排列。
特征:a 可能存在局部缺陷;b 可有无限多种。
2 晶胞图1-6(1)――-:构成空间点阵的最基本单元。
(2)选取原则:a 能够充分反映空间点阵的对称性;b 相等的棱和角的数目最多;c 具有尽可能多的直角;d 体积最小。
(3)形状和大小有三个棱边的长度a,b,c及其夹角α,β,γ表示。

《材料科学基础》复习要点一、主要内容1. 工程材料中的原子排列(1)原子键合,工程材料种类;(2)原子的规则排列:晶体结构与空间点阵,晶向及晶面的特点及表示,金属的晶体结构,陶瓷的晶体结构。
(3)原子的不规则排列:点、线、面缺陷的类型及特征,位错的弹性性质,实际晶体中的位错。
2. 固体中的相结构(1)固溶体:分类、性能及影响固溶度的因素;(2)金属间化合物:分类、性能及特征;(3)陶瓷晶体相:分类、结构、性能及特征;(4)玻璃相:性能、特征及形成条件。
3. 凝固与结晶(1)结晶的基本规律;(2)结晶的基本条件;(3)晶核的形成:形核能量变化,临界晶核,形核功,形核率;(4)晶体的长大:长大条件,液固界面结构,长大机制,温度梯度,晶体形态;(5)凝固理论的应用。
4. 二元相图:(1)相图的基本知识;(2)二元匀晶相图、共晶相图及包晶相图:二元合金的平衡凝固及非平衡凝固,凝固过程中的成分变化及偏析,成分过冷与固溶体组织,共晶体形成机理及其形态,杠杆定律;(3)二元相图的分析方法,其他类型二元相图及其应用;(4)Fe-C相图分析及平衡凝固;(5)铸锭组织与偏析。
5. 材料中的扩散:(1)扩散定律及其应用;(2)扩散的微观机理,影响扩散的因素;(3)扩散的热力学理论;(4)反应扩散。
6. 塑性变形:(1)单晶体的塑性变形;(2)多晶体的塑性变形;(3)合金的塑性变形;(4)冷变形金属的组织与性能。
7. 回复与与结晶:(1)冷变形金属在加热时的变化;(2)回复:机制,热力学,动力学,应用,影响因素;(3)再结晶:机制,热力学,动力学,应用,影响因素;(4)再结晶后晶粒长大:机制,热力学,动力学,应用及组织控制,影响因素;(5)金属的热变形,超塑性。
二、参考书目1. 《材料科学基础》,胡庚祥,蔡珣,上海交通大学出版社,20002. 《材料科学基础》(第二版),刘智恩,西北工业大学出版社20033. 《材料科学基础》,石德珂,西安交通大学出版社,20004. 《材料科学基础》,潘金生,仝健民,清华大学出版社,1998《材料科学基础》复习纲要重要概念-键合、工程材料-晶体、非晶体、各向异性-点阵、晶体结构、晶胞、晶系、布拉菲点阵、晶面指数、晶向指数、晶面族、晶向族-晶格常数、晶胞原子数、配位数、致密度、间隙-堆垛、密排面、密排方向、堆垛次序、堆垛方向-缺陷、点缺陷、刃位错、螺位错、混合位错-柏氏矢量、滑移矢量-位错密度-滑移、攀移、交滑移、交割、割阶、扭折、塞积-位错应力场、应变能、线张力、位错线上的力-位错增殖、位错源-全位错、不全位错、堆垛层错、位错反应-晶界、相界、界面能、大角度晶界、小角度晶界、孪晶界-相、固溶体、置换固溶体、间隙固溶体-金属间化合物、玻璃相-凝固、结晶、短程有序、长程有序-结构起伏(相起伏)、能量起伏、成分起伏-过冷度、形核过冷度、动态过冷度、临界过冷度、有效形核过冷度-均匀形核、非均匀形核、晶核、临界晶核、临界形核功、形核率-光滑界面、粗糙界面、垂直长大、横向长大、温度梯度、树枝状-平衡转变(结晶)、非平衡转变(结晶)、正常凝固-匀晶、共晶、包晶、共析、包析、脱溶转变-平衡分配系数、有效分配系数-微观偏析(枝晶偏析)、宏观偏析-亚共晶、共晶、过共晶、伪共晶、离异共晶、非平衡共晶、包晶转变不完全性-铁素体、奥氏体、珠光体、莱氏体、渗碳体、工业纯铁、钢、铸铁-液相线、固相线、液相面、固相面、中间面、液相平均成分线、固相平均成分线-浓度三角形-垂直截面、水平界面、投影图-扩散、空位扩散、间隙扩散、稳态扩散、非稳态扩散-扩散系数、扩散激活能、扩散通量、迁移率-上坡扩散、反应扩散-滑移、滑移线、滑移带、滑移方向、滑移面、滑移系、临界分切应力、取向因子、吕德斯带-柯氏气团、屈服、应变时效-细晶强化、固溶强化、复相强化、弥散强化、加工硬化-纤维组织、带状组织、流线、位错胞、变形亚结构、织构-回复、再结晶、晶粒长大-低、中、高温回复,多边化,去应力退火-再结晶温度、再结晶退火-临界变形度、热蚀沟、再结晶图-动态回复、动态再结晶,热变形-复合材料、基体、增强体、界面各章知识要点一、工程材料中的原子排列§1.1 原子键合• 原子键合的种类、特点、典型例子• 工程材料的分类及其主要键合类型• 键合的多重性§1.2 原子的规则排列• 晶体的特点、晶体结构、点阵• 晶系、布拉菲点阵• 晶面指数、晶向指数(标定和作图)及其特点,晶面族、晶向族• 晶面间距• 典型金属结构(fcc、bcc、hcp)(晶胞原子数、点阵常数、配位数、致密度)(间隙种类及其特点)(堆垛方式)• 多晶型性、同素异晶转变• 陶瓷晶体结构(离子键晶体、共价键晶体)(结构规则、不等径刚球密堆原理)§1.3 原子的不规则排列• 缺陷的种类• 点缺陷的种类• 空位的平衡浓度• 点缺陷对晶体性能的影响• 位错的类型、特点• 柏氏矢量(柏氏回路)• 位错的运动方式、特点• 位错的力学性能(应力场、畸变能、位错线上的力、线张力)• 位错的交互作用(位错与点、线、面缺陷的交互作用)• 位错增殖• 实际晶体中的位错(全位错、不全位错、单位位错、部分位错、堆垛层错、弗兰克位错、肖克来位错)• 位错反应• 面缺陷(类型及其结构模型、界面能、界面的特点)二、固体中的相结构§ 2.1 固溶体-固溶体的概念、分类-影响固溶度的因素-固溶体的均匀性-固溶体的性能§ 2.2 金属间化合物-化合物的概念、分类-化合物的性能§ 2.3 陶瓷晶体相-陶瓷的概念、特征§ 2.4 玻璃相-陶瓷的概念、形成条件三、凝固§ 3.1 金属结晶的基本规律-微观规律(形核、长大、)-宏观规律(过冷)§ 3.2 金属结晶的基本条件-热力学条件(ΔG < 0、ΔT )-动力学条件(形核:结构条件、能量条件、成分条件)(长大:速度条件)§ 3.3 晶核的形成-形核的方式(均匀形核、非均匀形核)-结晶时的体系能量变化-形核的驱动力和阻力-临界晶核的概念-临界晶核半径及其计算-临界形核功及其计算-形核率(概念、影响因素、特点)-两种形核方式的比较§3.4 晶体的长大-液固界面的微观结构-晶体的长大机制-温度梯度-晶体长大的形态§3.6 凝固理论的应用-铸锭晶粒组织及其控制-单晶体的制备-定向凝固-非晶合金的制备-微晶合金的制备四、相图§ 4.1 相、相平衡及相图制作-相的定义-相平衡的定义-成分的表示方法(质量分数、摩尔分数)-相图的制作方法§ 4.2 匀晶相图-相图分析-成分变化(平衡、非平衡)(微观偏析、宏观偏析)-成分过冷(概念、形成原因)-固溶体形貌§ 4.3 共晶相图-相图分析-共晶转变特点-典型合金的结晶过程(平衡、非平衡)-成分变化(平衡、非平衡)-共晶形成机理(形核机理、长大机理)-共晶体形貌特征(平衡、非平衡)-杠杆定律计算(相组成、组织组成)§ 4.4 包晶相图-相图分析-包晶转变特点-典型合金的结晶过程(平衡、非平衡)-成分变化(平衡、非平衡)-包晶形成机理-杠杆定律计算(相组成、组织组成)§ 4.5 其它相图-相图分析方法、步骤-典型合金的结晶过程(平衡、非平衡)-成分变化(平衡、非平衡)-杠杆定律计算(相组成、组织组成)§ 4.6 Fe-C相图-相图分析-典型合金的平衡结晶过程-成分变化-典型合金的名称-杠杆定律计算(相组成、组织组成)§ 4.8 铸锭组织与偏析-偏析的类型§ 4.9 三元合金相图-成分表示法(浓度三角形)-三元匀晶相图(立体图、投影图)-三元匀晶相图(垂直截面、水平截面)-三元匀晶相图平衡结晶过程-简单三元共晶相图(立体图、投影图)-简单三元共晶相图(垂直截面、水平截面)-简单三元共晶相图平衡结晶过程五、材料中的扩散§5.1 扩散定律及其应用-扩散第一定律及其应用条件-扩散第二定律及其应用条件§ 5.2 扩散的微观机理-扩散的微观机理-原子热运动对扩散的影响-晶态、非晶态化合物中的扩散§ 5.3 扩散的热力学理论-扩散的驱动力-上坡扩散(概念、诱因)-扩散系数§ 5.4 反应扩散-反应扩散(概念、特点)陶瓷的概念、特征§ 5.5 扩散的影响因素-影响因素及其机理六、塑性变形§ 6.1 应力-应变曲线-工程应力应变曲线、真应力应变曲线及二者差别-强度及塑性指标,硬化系数§ 6.2 单晶体的塑性变形-滑移现象(滑移线、滑移带、滑移特征)-滑移系-临界分切应力-滑移的微观机理-晶体的转动、多滑移、交滑移及滑移线形貌-孪生的概念、特点§ 6.3 多晶体的塑性变形-位向差及晶界对塑变的影响-细晶强化机理、特征-霍尔-配奇公式§6.4 合金的塑性变形-固溶强化机理-屈服及应变时效-复相强化机理及特征-弥散强化机理§ 6.5 冷变形金属的组织和性能-组织变化(显微组织、变形亚结构、变形织构)-能量变化(内应力、畸变能)-力学性能(加工硬化)-物理、化学性能变化七、回复与再结晶§ 7.1 加热时的变化-显微组织变化-能量变化-力学性能变化-物理、化学性能变化§ 7.2 回复-回复机制-回复热力学-回复动力学-回复应用§ 7.3 再结晶-再结晶机制(形核机制、长大机制)-再结晶热力学-再结晶动力学-再结晶温度及其影响因素-再结晶组织及其影响因素§ 7.4 再结晶后晶粒长大-长大方式-晶粒长大(特征、热力学、动力学)-晶粒长大影响因素-再结晶应用八、固态相变-固态相变的分类九、复合效应与界面-复合材料定义、分类-复合材料的构成、各部分的作用-复合效应-界面结合种类热处理改变钢的性能的原因是因为采用不同的加热、保温、冷却方式使钢内部结构发生改变,从而获得所需性能。

结晶矿物学概念:此总结为概念整理,密堆积原理、推导过程以及各种单形、符号、点阵、对称型,空间群表格请查阅《晶体学基础》(秦善)晶体:晶体:具有格子构造的固体。
(晶体特征)点阵:将质点排列的周期性抽象成的只具有数学意义的周期性图形。
面网:质点的面状分布。
行列:分布在同一直线上的结点构成一个行列.。
结点间距:行列上两相邻结点的距离。
面网密度:单位面积内的结点数。
面网间距:任意两相邻面网的垂直距离。
点阵参数:表示平行六面体的大小和形状的节点间距a,b,c以及其间交角α,β,γ。
行列符号:表示一组互相平行、取向相同的行列: [uvw]。
晶体基本性质:均一性(任意区域物化性质相同);异向性(对不同取向表现出不同的物理性质与几何构造);对称性(某对称法则F控制下对称要素N1,N2…Nn有F(N1)=F(N2=…=F(Nn)));自范性(自发形成封闭集合体,满足欧拉定律);最小内能(相同热力学条件下与同种物质的非晶体,液体和气体相比内能最小且结构最稳定)。
准晶体:具有五次或六次以上对称轴,长程有序,但不体现周期重复,即无格子构造。
晶体的宏观对称:对称:物体相同部分间有规律的重复。
晶体对称:晶体是由在三维空间规则重复排列的原子或原子团组成的,通过平移,可使之重复;对称受格子构造限制;同时表现在外形和物理性质上。
对称操作:使相同部分重复的操作。
对称元素:对称操作中凭借的辅助几何要素。
对称心/面/轴,倒转轴,映转轴。
存在对称心——>晶面两两平行且相等;对称轴轴次:受格子构造限制,可为1、2、3、4、6。
对称元素的组合:也称点群、对称型。
晶体对称分类:晶族:依据高次轴(n>2)有无分及多少为高级(轴数>2)/中级(轴数=1)/低级(无高次轴)晶族。
晶系:依据轴次高低及轴数目划分。
晶类:同一点群的晶体。
晶体定向和晶体学符号:晶体定向:在晶体中设置符合晶体对称特征或与格子参数相一致的坐标系,并将晶体按相应的空间取向关系做好安置。


单斜相和四方相体积1. 引言在固体物质的研究中,晶体学是一个重要的分支领域。
晶体学主要研究晶体的结构、性质和形成过程等方面的问题。
在晶体学中,相是指具有一定结构和组成的区域。
不同相之间可以通过相变进行转化。
本文将重点讨论两种常见的晶体结构类型:单斜相和四方相。
我们将详细介绍这两种相的特点、结构以及它们的体积计算方法。
2. 单斜相2.1 特点单斜相是一种具有单轴对称性的晶体结构类型。
其空间群为C2/c,属于单斜晶系。
单斜晶系包括了所有具有一个垂直于基面的轴,并且该轴上没有镜面对称性或旋转对称性的晶体。
2.2 结构单斜相具有以下特点:•晶胞形状为平行四边形;•基元原子排列呈现周期性;•晶胞中原子数目有限;•晶胞内原子排列存在一定规律。
2.3 体积计算方法计算单斜相的体积需要知道晶胞参数。
晶胞参数包括晶胞的长度、角度和轴向。
单斜相晶胞的体积可以通过以下公式计算:V=a⋅b⋅c⋅√1−cos2(γ)其中,a、b、c分别表示晶胞的长度,γ表示晶胞中两个非直角边夹角。
3. 四方相3.1 特点四方相是一种具有四轴对称性的晶体结构类型。
其空间群为P4/mmm,属于四方晶系。
四方晶系包括了所有具有四个等长轴,并且这些轴之间呈90度角的晶体。
3.2 结构四方相具有以下特点:•晶胞形状为正方体;•基元原子排列呈现周期性;•晶胞中原子数目有限;•晶胞内原子排列存在一定规律。
3.3 体积计算方法计算四方相的体积同样需要知道晶胞参数。
晶胞参数包括晶胞的长度、角度和轴向。
四方相晶胞的体积可以通过以下公式计算:V=a2⋅c其中,a表示晶胞的长度,c表示晶胞中垂直于基面的轴的长度。
4. 总结单斜相和四方相是两种常见的晶体结构类型。
它们在晶体学研究中具有重要的地位。
本文对这两种相的特点、结构以及体积计算方法进行了详细介绍。
单斜相具有单轴对称性,其空间群为C2/c;四方相具有四轴对称性,其空间群为P4/mmm。
单斜相晶胞形状为平行四边形,而四方相晶胞形状为正方体。
绪论一固体物理的研究对象固体物理是研究固体的结构及其组成粒子原子离子电子等之间相互作用与运动规律以阐明其性能与用途的学科 固体按结构分类取向对称晶体学上不允许的长程平移序和同时具有长程准周期性准晶准晶体短有序程无明确周期性非晶态非晶体长程有序规则结构晶态晶体:)(,:)(,:)( 二固体物理的发展过程人们很早注意到晶体具有规则性的几何形状还发现晶体外形的对称性和其他物理性质之间有一定联系因而联想到晶体外形的规则性可能是内部规则性的反映十七世纪C Huygens 试图以椭球堆集的模型来解释方解石的双折射性质和解理面十八世纪RJH 认为方解石晶体是由一些坚实的y ua &&相同的平行六面体的小基石有规则地重复堆集而成的到十九世纪费多洛夫熊夫利巴罗等独立地发展了关于晶体微观几何结构的理论系统为进一步研究晶体机构的规律提供了理论依据1912年劳埃首先提出晶体可以作为X 射线的衍射光栅索末菲发展了固体量子论费米发展了统计理论在这些研究的基础上逐渐地建立了固体电子态理论能带论和晶格动力学固体的能带论提出了导电的微观机理指出了导体和绝缘体的区别并断定有一种固体它们的导电性质介乎两者之间叫半导体四十年代末五十年代初以锗硅为代表的半导体单晶的出现并以此制成了晶体三极管进而产生了半导体物理这标志着固体物理学发展过程的又一次飞跃为了适应微波低噪音放大的要求曾经出现过固体量子放大器脉泽1960年出现的第一具红宝石激光器就是由红宝石脉泽改造而成的可以说固体物理学尖端技术和其他学科的发展相互推动相辅相成的作用反映在上述的固体新材料与新元件的发现和使用上新技术和其他学科的发展也为固体物理学提供了空前有利的研究条件三固体物理的学科领域随着生产及科学的发展固体物理领域已经形成了象金属物理半导体物理晶体物理和晶体生长磁学电介质包括液晶物理固体发光超导体物理固态电子学和固态光电子学等十多个子学科同时固体物理的本身内核又在迅速发展中主要有1研究固体中的元激发及其能谱以更深入更详细地分析固体内部的微观过程揭示固体内部的微观奥妙2研究固体内部原子间结合力的综合性质与复杂结构的关系掌握缺陷形成和运动以及结构变化相变的规律从而发展多功能的复合材料以适应新的需要3研究在极低温超高压强磁场强辐射条件下固体的性质4表面物理----在研究体内过程的基础上进入了固体表面界面的研究5非晶态物理----在研究晶态的基础上开始进入非晶态的研究即非晶体中原子电子的微观过程四固体物理的研究方法固体物理主要是一门实验性学科但是为了阐明所揭示出来的现象之间的内在的本质联系就必须建立和发展关于固体的微观理论实验工作与理论工作之间要相互密切配合以实验促进理论以理论指导实验相辅相成相得益彰第一章晶体结构固体的结构决定其宏观性质和微观机理本章主要阐明晶体中原子排列的几何规则性1-1 一些晶格的实例晶体组成微粒具有空间上按周期性排列的结构基元当晶体中含有多种原子多种原子构成基本的结构单元格点结点结构中相同的位子图1-1-1 结构中相同的位子点阵晶体中格点的总体又称为布拉菲点阵布拉菲格子这种格子的特点是每点周围的情况都一样如果晶体由完全相同的一种原子组成则这种原子所组成的网格也就是布拉菲格子和结点所组成的相同如果晶体的基元中包含两种或两种以上的原子则每个基元中相应的同种原子各构成和结点相同的网格不过这些网格相对地有位移而形成所谓的复式格子显然复式格子是由若干相同的布拉菲格子相互位移套构而成晶格通过点阵中所有节点的平行直线簇和平行平面簇构成的网格元胞反映晶格周期性的最小重复单元侧重最小重复单元每个元胞中只有一个格点晶胞晶体学单胞既反映晶格周期性又反映晶格的空间对称性的最小重复单元侧重空间对称性每个元胞可能不止一个格点一单原子组成的元素晶格1简单立方晶格图1-1-2 原子球的正方排列及其各层球完全对应层叠形成的简单立方晶格2体心立方晶格的典型单元及堆积方式图1-1-3体心立方晶格的典型单元及体心立方晶格的堆积方式3原子球最紧密排列方式与面心立方晶格和六角密排晶格图1-1-4原子球最紧密排列方式当层叠是ABABAB方式则构成六角密排晶格当层叠是ABCABCABC方式则构成面心立方晶格4金刚石类晶格金刚石类晶格是由面心立方单元的中心到顶角引8条对角线在其中互不相邻的4条对角线的中点各加一个原子就得到金刚石类晶格结构也可看成面心立方沿体对角线平移1/4体对角线套购而成除金刚石外半导体硅和锗也具有类似金刚石类晶格结构图1-1-5金刚石类晶格结构的典型单元二化合物晶体的结构1NCl类晶格结构其好似于简单立方晶格只是每一行相间地排列着正的和负的离子N a+和Cl-碱金属和卤族元素的化合物都具有类似的结构Cl类晶格结构2C其好似体心立方晶格只是体心和顶角是不同的离子3闪锌矿ZS类晶格结构和金刚石类晶格结构相仿只要在金刚石晶格立方单元的对角线位置上放置一种原子在面心立方位置上放置另一种原子441-2晶格的周期性对于晶格的周期性通常用元胞和基矢来描述图1-2-1 中除4外均为最小单元由此元胞的选取并不是唯一的但各种晶格元胞都有习惯的选取方式并用元胞的边矢量作晶格的基矢基矢之间并不都相互正交图1-2-1平面元胞示意图1 简单立方晶格的元胞三个基矢分别zy x e a a e a a e a v v v v v v ===32,,为a 13321a a a a =×⋅vv r2 面心立方晶格的元胞三个基矢分别为)(2),(2),(2321j i a a j i a a j i a a v v v v v v v v v +=+=+=43321a a a a =×⋅vv r3体心立方晶格的元胞三个基矢分别为)(2),(2),(2321k j i a a k j i a a k j i a a v v v v v v v v v v v v −+=+−=++−=23321a a a =×⋅v v r a)3322a l a l ++}设为元胞中任意一处的位子矢量r vQ代表晶体中的任一物理量则Q ()(11a l r Q r +=vv l 1l 2l 3为整数即任意两元胞中相对应的点的物理性质相同我们可以用表示一种空间点阵{a l a l a l v v v 321++即一组l 1l 2l 3的取值表示格子中的一个格点l 1l 2l 3所有可能的集合就表示一个空间格子实际晶体可以看成在上述空间格子的每个格点上放置一组基元可为多种原子这个空间格子表征了晶格的周期性称为布拉菲格子Cu 的面心立方晶格Si 的金刚石晶格和NaCl 晶格均具有相同的布拉菲格子—面心立方格子它们的晶格结构虽然不同但具有相似的周期性自然界中晶格的类型很多但只可能有十四种布拉菲格子。
《分子动理论》固体结构,分子排列在我们生活的这个世界里,物质以各种各样的形态存在着,其中固体是最为常见的一种。
要深入理解固体的性质和特点,就不得不提到分子动理论中关于固体结构和分子排列的相关知识。
想象一下,我们周围的固体物体,比如一块金属、一块石头或者一块塑料,它们看似坚固不变,但实际上在微观层面,是由无数的分子组成的,并且这些分子有着特定的排列方式。
先来说说固体结构。
固体可以分为晶体和非晶体两大类。
晶体具有规则的几何外形和固定的熔点。
这是因为晶体中的分子排列是非常有序的,就好像是一支训练有素的军队,每个士兵都有自己明确的位置和职责。
比如氯化钠晶体,也就是我们常见的食盐,其钠离子和氯离子按照一定的规律交替排列,形成了立方体的结构。
这种有序的排列使得晶体在物理性质上表现出各向异性,也就是说,在不同的方向上,其物理性质可能会有所不同。
比如,有些晶体在沿着某个特定方向的导电性要比其他方向好很多。
而非晶体呢,就像是一群没有组织的群众,分子的排列没有明显的规律。
常见的非晶体有玻璃、橡胶、沥青等。
由于分子排列的无序性,非晶体没有固定的熔点,它们在加热时会逐渐变软,最终变成液体,这个过程是比较平缓的,没有明显的温度界限。
那么,分子是如何在固体中排列的呢?在晶体中,分子之间存在着较强的相互作用力,使得它们能够保持稳定的位置关系。
这种相互作用力可以是离子键、共价键、金属键等。
以离子键为例,就像前面提到的氯化钠晶体,钠离子和氯离子之间由于正负电荷的吸引而形成了离子键,从而使得它们紧密地排列在一起。
共价键则常见于一些原子晶体中,比如金刚石。
在金刚石中,每个碳原子都与周围的四个碳原子以共价键相连,形成了一个非常坚固的三维网状结构。
这种结构使得金刚石成为自然界中最坚硬的物质之一。
金属键存在于金属晶体中。
金属中的原子失去部分或全部外层电子,形成自由电子,这些自由电子在整个晶体中自由运动,而金属阳离子则沉浸在自由电子的“海洋”中。