医疗器械不良事件报告表(新版)
- 格式:docx
- 大小:99.57 KB
- 文档页数:1

医疗器械不良事件报告表医疗器械不良事件报告表是医疗器械监督管理部门规定的一种重要文件,用于记录和上报医疗器械不良事件的相关信息。
医疗器械不良事件是指使用医疗器械过程中出现的意外事件、不良反应、事故等不良情况。
及时、准确地填写医疗器械不良事件报告表,对于及时发现和解决医疗器械不良事件具有重要意义,有助于保障患者的用药安全和医疗质量。
医疗器械不良事件报告表通常包括以下内容,医疗机构基本信息、不良事件基本信息、医疗器械信息、不良事件的描述和分析、不良事件的处理和结果、报告人信息等。
在填写医疗器械不良事件报告表时,应当尽可能提供详细、准确的信息,以便监管部门对不良事件进行及时、全面的分析和处理。
首先,医疗机构基本信息是医疗器械不良事件报告表的重要组成部分。
医疗机构应当如实填写医疗机构的名称、地址、联系方式等基本信息,以便监管部门能够及时了解并联系到医疗机构。
其次,不良事件基本信息是医疗器械不良事件报告表的核心内容之一。
不良事件基本信息包括不良事件的发生时间、地点、患者基本信息、事件的性质和严重程度等。
这些信息对于监管部门分析不良事件的原因和趋势具有重要意义,有助于采取有效的措施预防和减少类似事件的再次发生。
另外,医疗器械信息是医疗器械不良事件报告表的关键内容之一。
医疗器械信息包括不良事件涉及的医疗器械的名称、型号、规格、生产批号、有效期等。
这些信息对于监管部门对医疗器械的安全性和有效性进行评估和监测具有重要意义,有助于及时发现和召回存在安全隐患的医疗器械。
此外,不良事件的描述和分析是医疗器械不良事件报告表的重要部分。
医疗机构应当如实描述不良事件的经过和相关情况,并对不良事件进行全面、客观的分析。
这有助于发现不良事件的深层原因,为预防类似事件的再次发生提供重要参考。
最后,不良事件的处理和结果是医疗器械不良事件报告表的必要内容。
医疗机构应当如实记录不良事件的处理过程和结果,并根据实际情况采取相应的措施,保障患者的权益和安全。


医疗器械不良事件报告表报告日期:年月日报告来源:✍生产企业✍经营企业✍使用单位单位名称(单位盖章):联系地址: 邮编:联系电话:编码:✍✍✍✍✍✍✍✍✍✍✍可疑医疗器械不良事件报告表填写说明国家药品不良反应监测中心一、医疗器械不良事件定义:获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。
二、报告范围:需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。
其中,严重伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。
“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
三、报告原则:1、基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
3、可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
这些事件可以是与使用医疗器械有关的,也可以是不能除外与医疗器械有关的事件。
注意事项:1、请务必填写清楚您的联系方式、产品名称和生产企业名称;2、若有内容填写不下,可加附表说明;3、进口产品在生产企业联系方式一栏请填写境内代理企业联系方式;相关事件在以下情况必须报告:⑴引起或造成死亡或严重伤害的几率较大;⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害;⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要;⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;⑹类似事件在过去实际已经引起或造成死亡或严重伤害。

国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:报告来源: 联系地址:A. 患者资料1.姓名:2 .年龄: 3•性别 男 女4 .预期治疗疾病或作用:B. 不良事件情况5. 事件主要表现: 6 .事件发生日期: 年 月曰 7 •发现或者知悉时间: 年 月曰8. 医疗器械实际使用场所:医疗机构 家庭 其它(请注明):9. 事件后果死亡 _________________________________ (时间); 危及生命;机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
10. 事件陈述:(至少包括器械使用时间、使用目的、使 用依据、使用情况、出现的不良事件情况、对受害者影 响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他邮 编:联系电话:报告人签名:附件1:年 月曰生产企业经营企业例子:附件1:可疑医疗器械不良事件报告表报告日期:2010年10月25日 编 码:邮 编:联系电话:A. 患者资料1.姓名:2 .年龄:3•性别男女"4 •预期治疗疾病或作用:输液B. 不良事件情况5•事件主要表现:穿刺部位红肿 6.事件发生日期: 2010年10 月22日7 .发现或者知悉时间: 2010年10月22日8. 医疗器械实际使用场所:V 医疗机构 家庭 其它(请注明):9. 事件后果死亡 _________________________________ (时间); 危及生命;机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤;V 其它(在事件陈述中说明)。
国家食品药品监督管理局制报告来源: 生产企业 经营企业 "使用单位 单位名称:按实际填写联系地址:按实际填写10. 事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)患者于2010年10月20日在我院留医治疗使用一次性使用静脉留置针,穿刺部位于穿刺输液后2天出现皮肤红肿,无发热等现象,拔除一次性使用静脉留置针1天后症状消失。

医疗器械不良事件监测报告表报告日期:年月日报告来源:? 生产企业 ? 经营企业 ? 使用单位单位名称(单位盖章):联系地址: 邮编:联系电话:编? ? ? ? ? ? ? ?报告人:医师? 技师? 护士? 其他?报告人签名:可疑医疗器械不良事件报告表填写说明国家药品不良反应监测中心一、医疗器械不良事件定义:获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。
二、报告范围:需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。
其中,严重伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。
“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
三、报告原则:1、基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
3、可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
这些事件可以是与使用医疗器械有关的,也可以是不能除外与医疗器械有关的事件。
注意事项:1、请务必填写清楚您的联系方式、产品名称和生产企业名称;2、若有内容填写不下,可加附表说明;3、进口产品在生产企业联系方式一栏请填写境内代理企业联系方式;相关事件在以下情况必须报告:⑴引起或造成死亡或严重伤害的几率较大;⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害;⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要;⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;⑹类似事件在过去实际已经引起或造成死亡或严重伤害。



医疗器械不良事件报告表
一、报告单位信息。
1. 报告单位名称:
2. 单位地址:
3. 联系人:
4. 联系电话:
5. 邮政编码:
二、器械基本信息。
1. 器械名称:
2. 型号:
3. 规格:
4. 生产厂家:
5. 出厂日期:
6. 有效期至:
三、不良事件描述。
1. 事件发生时间:
2. 事件发现时间:
3. 不良事件描述:
4. 不良事件对患者造成的影响:
5. 不良事件对医疗过程的影响:
6. 不良事件对医疗器械的影响:
四、不良事件原因分析。
1. 不良事件的直接原因:
2. 不良事件的间接原因:
3. 不良事件的根本原因:
4. 防范措施及改进建议:
五、处理结果。
1. 患者处理情况:
2. 医疗器械处理情况:
3. 相关人员处理情况:
4. 预防措施及改进措施:
六、报告人信息。
1. 姓名:
2. 职务:
3. 联系电话:
4. 电子邮箱:
5. 签名:
七、报告时间。
1. 年月日。
以上是医疗器械不良事件报告表的内容,医疗器械不良事件的及时报告对于医疗安全至关重要,希望各报告单位能够认真填写以上信息,确保医疗器械使用过程中的安全和有效性。
同时,对于不良事件的原因分析和处理结果也需要进行深入的思考和总结,以期减少类似事件的再次发生,保障患者和医护人员的安全。


附件4:医疗器械不良事件报告表报告日期:年月日报告来源:生产企业经营企业使用单位单位名称(单位盖章):联系地址: 邮编:联系电话:编码:3.性别男女7. 医疗器械实际使用场所:15. 操作人:专业人员非专业人员患者其它医院诊所家庭其它(在陈述中说明)8.事件后果死亡(时间);威胁生命;机体功能结构永久损伤;需要内、外科治疗避免上述永久损伤;其它(在事件陈述中说明)。
21.事件报告状态:已通知医院已通知企业已通知药监分局可疑医疗器械不良事件报告表填写说明国家药品不良反应监测中心一、医疗器械不良事件定义:获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。
二、报告范围:需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。
其中,严重伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。
“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
三、报告原则:1、基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
3、可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
这些事件可以是与使用医疗器械有关的,也可以是不能除外与医疗器械有关的事件。
注意事项:1、请务必填写清楚您的联系方式、产品名称和生产企业名称;2、若有内容填写不下,可加附表说明;3、进口产品在生产企业联系方式一栏请填写境内代理企业联系方式;相关事件在以下情况必须报告:⑴引起或造成死亡或严重伤害的几率较大;⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害;⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要;⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;⑹类似事件在过去实际已经引起或造成死亡或严重伤害。
附件1:《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称: 联系地址: 邮 编: 联系电话:报告人签名: 国家食品药品监督管理局制A .患者资料 1.姓名:2.年龄:3.性别 男 女4.预期治疗疾病或作用:B .不良事件情况 5.事件主要表现:6.事件发生日期: 年 月 日 7.发现或者知悉时间: 年 月 日 8. 医疗器械实际使用场所:医疗机构 家庭 其他(请注明):9.事件后果死亡 (时间); 危及生命;机体功能结构永久性损伤;可能导致机体功能结构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其他(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他C .医疗器械情况 11.产品名称: 12.商品名称: 13.注册证号: 14.生产企业名称:生产企业地址: 企业联系电话: 15.型号规格:产品编号: 产品批号:16. 操作人: 专业人员 非专业人员 患者 其他(请注明): 17. 有效期至: 年 月 日 18.生产日期: 年 月 日 19. 停用日期: 年 月 日 20. 植入日期(若植入): 年 月 日 21. 事件发生初步原因分析: 22. 事件初步处理情况:23.事件报告状态:已通知使用单位 已通知生产企业 已通知经营企业 已通知药监部门 D.关联性评价(1)使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序? 是□ 否□(2)已发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?是□ 否□ 不清楚□(3)已发生/可能发生的伤害事件是否可用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释? 是□ 否□ 不清楚□评价结论:很可能□可能有关□可能无关□无法确定□ E. 不良事件评价24.省级监测技术机构评价意见(可另附附页): 25.国家监测技术机构评价意见(可另附附页):填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
医疗器械不良事件报告表护人员的伤害,也应按可疑医疗器械不良事件报告。
3、主动报告原则:医疗器械生产企业、经营企业、使用单位发现可疑医疗器械不良事件应主动报告,不得隐瞒、谎报或者拖延报告。
四、报告流程:1、发现可疑医疗器械不良事件后,应立即停止使用该医疗器械,并采取必要的保护措施,保护患者和医护人员的安全。
2、填写可疑医疗器械不良事件报告表,详细描述事件的情况,包括患者资料、医疗器械情况、不良事件情况等。
3、将报告表及相关材料报送至所在地的药监部门,并抄送省级监测机构和国家监测机构。
4、药监部门收到报告后,应及时进行审核和调查,并根据调查结果及时采取措施,保护患者和医护人员的安全。
五、注意事项:1、填写报告表时,应尽量详细、准确地描述事件的情况,不得隐瞒或谎报。
2、对于医疗器械不良事件的调查和处理应及时、公正,保护患者和医护人员的合法权益。
3、医疗器械生产企业、经营企业、使用单位应加强医疗器械的质量管理,提高医疗器械的安全性和有效性,为患者提供更好的医疗保障。
1、格式错误已全部删除,文章已调整为连续段落。
2、小幅度改写如下:根据《医疗器械不良事件报告与处理管理办法》,医疗机构和医疗器械生产企业应当主动报告医疗器械不良事件。
其中,医疗器械不良事件包括医疗器械使用过程中发生的意外、不良反应、事故等。
若医疗器械使用过程中出现了死亡或严重伤害的情况,也需要及时报告。
3、在不确定是否属于医疗器械不良事件的情况下,应按照可疑医疗器械不良事件报告。
这些事件可能与使用医疗器械有关,也可能与医疗器械无关。
需要注意的是,填写报告时务必清楚地填写联系方式、产品名称和生产企业名称。
如果内容填写不下,可以加附表说明。
对于进口产品,应在生产企业联系方式一栏填写境内代理企业联系方式。
4、需要报告的医疗器械不良事件包括:⑴引起或造成死亡或严重伤害的几率较大;⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害;⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要;⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;⑹类似事件在过去实际已经引起或造成死亡或严重伤害。
可疑医疗器械不良事件报告表
D.关联性评价
1.使用医疗器械与已发生/可能发生的伤害事件之间是否有合理的先后时间顺序?是( 1 ) 否( )
2.发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?是( 1 )否( )无法确定( )
3.已发生/可能发生的伤害事件是否可以用合并药用和/或器械的作用、患者病情或其他非医疗器械因素来解释?是( ) 否( 1 ) 无法确定( )
关联性评价结果(1)很有可能( )可能有关( )可能无关( )无法确定
报告人姓名:李正永报告人类别:( 1 )医师()技师()护士()工程师()其他。
WORD 格式可以任意编辑
专业资料整理分享
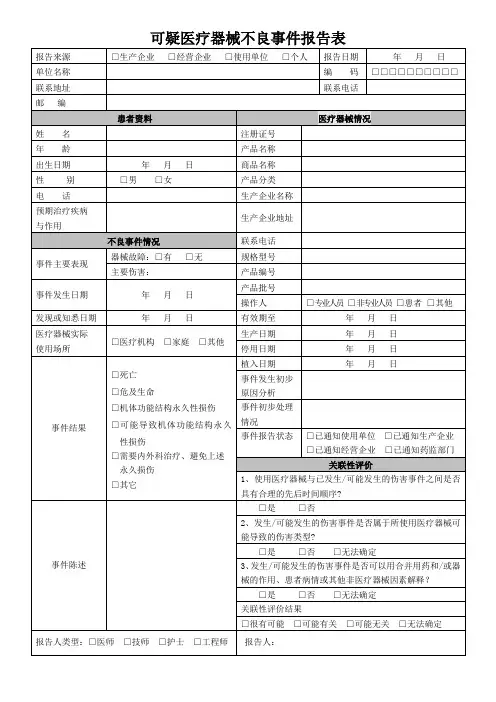
可疑医疗器械不良事件报告表
报告来源 □生产企业□经营企业□使用单位□个人报告日期
年 月 日 单位名称 编
码 □□□□□□□□□□
联系地址 联系电话
邮 编
姓 名 年 龄
出生日期 性 别 电 话
预期治疗疾病与作用
事件主要表现
事件发生日期
发现或知悉日期医疗器械实际使用场所
事件结果
事件陈述
患者资料 年 月 日
□男
□女
不良事件情况
器械故障:□有□无主要伤害:
年 月 日
年 月 日
□医疗机构 □家庭 □其他
□死亡
□危及生命
□机体功能结构永久性损伤
□可能导致机体功能结构永久
性损伤
□需要内外科治疗、避免上述
永久损伤
□其它
医疗器械情况
注册证号
产品名称
商品名称
产品分类
生产企业名称
生产企业地址
联系电话 规格型号 产品编号 产品批号
操作人 □专业人员□非专业人员□患者□其他
有效期至 年 月 日 生产日期 年 月 日 停用日期 年 月 日 植入日期 年
月
日
事件发生初步 原因分析
事件初步处理 情况
事件报告状态 □已通知使用单位 □已通知生产企
业
□已通知经营企业 □已通知药监部
门
关联性评价
1、使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序?
□是 □否
2、发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?
□是 □否 □无法确定
3、发生/可能发生的伤害事件是否可以用合并用药和 /或器
械的作用、患者病情或其他非医疗器械因素解释?
□是□否□无法确定关联性评价结果
□很有可能 □可能有关 □可能无关 □无法确定
报告人类型:□医师
□技师 □护士 □工程师
报告人:。